
- DAZ.online
- DAZ / AZ
- DAZ 31/2019
- Heiße Mandeln und mehr
Infektiologie
Heiße Mandeln und mehr
Infektionen mit dem Epstein-Barr-Virus und die Folgen
Beim Epstein-Barr-Virus (EBV, HHV4) handelt es sich um ein behülltes DNA-Doppelstrangvirus der Familie der Herpesviridae (Subfamilie: Gammaherpesviridae), zu denen auch das Zytomegalie- oder Herpes simplex- / Varizella zoster-Virus zählen. Serologisch werden die beiden Subtypen EBV-1 und EBV-2 differenziert, die sich klinisch jedoch nicht unterscheiden. Umfangreiche serologische Untersuchungen konnten zeigen, dass etwa 90 bis 95% aller Erwachsenen der Weltbevölkerung mit dem Epstein-Barr-Virus infiziert sind. Der Mensch ist der einzige bisher bekannte Wirt für das Virus, wobei die Infektion zumeist oral als Tröpfchen- bzw. Kontaktinfektion erfolgt, da sich das Virus hauptsächlich in Epithelzellen der Mundschleimhaut oder der Speicheldrüsen vermehrt und entsprechend massiv über den Speichel ausgeschieden wird. Die Erstinfektion erfolgt zumeist im frühen Kindesalter und verläuft typischerweise asymptomatisch bzw. symptomarm in Form eines grippalen Infektes [1 – 3].
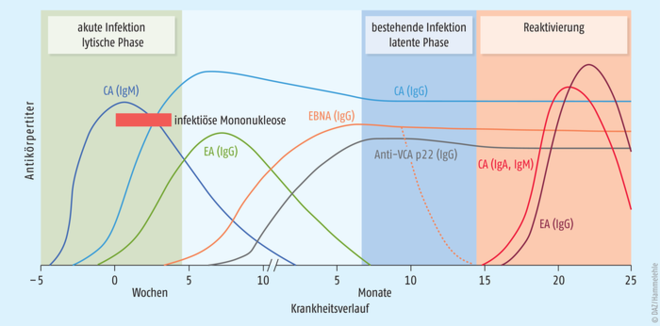
Nach Infektion von Epithelzellen der Mundschleimhaut oder Speicheldrüsen infiziert das Virus B-Lymphozyten der Mandeln und des Waldeyer Rachenrings. Hier bindet das Epstein-Barr-Virus zellulär an den Komplement-Rezeptor 2 (CR2, CD21), der ausschließlich von B-Lymphozyten exprimiert wird und folglich auf Gewebeebene nur in sekundären lymphatischen Organen wie Lymphknoten, Milz, Mandeln oder Appendix (Blinddarm) vorkommt. Die physiologische Bedeutung von CR2 liegt in der Realisierung von immunologisch essenziellen Zell-Interaktionen von B-Lymphozyten, wohingegen pathophysiologisch die Bindung von Epstein-Barr-Viren derart spezifisch ist, dass diese Antigenstruktur auch als EBV-Rezeptor bezeichnet wird. Nach der sogenannten lytischen Phase, in welcher die Viren massiv repliziert und sezerniert werden, geht das Epstein-Barr-Virus in seinen zweiten Lebenszyklus, die sogenannte latente Phase, über (Abb. 1, Tab. 1). Hierbei persistiert das Epstein-Barr-Virus nach Infektion von B-Lymphozyten in einer Subpopulation von langlebigen, ruhenden B-Lymphozyten (Gedächtniszellen). Die Virus-DNA liegt hierbei als zirkuläres Episom im Zellkern vor, und von den etwa 100 Virusproteinen werden nur wenige Vertreter wie das Epstein Barr nuclear antigen (EBNA) 1 und das Latent Membrane Protein (LMP) 2A exprimiert, so dass das Virus der Erkennung durch das körpereigene Immunsystem entgeht. Aufgrund dieses sehr nachhaltigen Infektionsmechanismus führt eine initiale Infektion zur lebenslang latent bestehenden Infektion. Hierbei kommt es immer wieder zu Reaktivierungen der Erkrankung, wobei diese für gesunde, immunkompetente Virusträger in der Regel unbemerkt bleibt, da die intensive Immunantwort das Virus in den meisten Fällen dauerhaft unter Kontrolle hält.
Virus-Protein |
Antikörper |
Interpretation |
|---|---|---|
VCA |
VCA-IgM |
akute Infektion (lytische Phase) |
VCA-IgG |
akute und bestehende Infektion (lytische und latente Phase) |
|
EA |
EA-IgM |
akute Infektion (lytische Phase) |
EA-IgG |
akute und bestehende Infektion (lytische und latente Phase) |
|
EBNA 1 |
EBNA1-IgG |
bestehende Infektion (latente Phase), Reaktivierung |
VCA: virus capsid antigen; EA: early antigen; EBNA 1: Epstein Barr nuclear antigen 1 | ||
Welche Erkrankungen verursacht das Epstein-Barr-Virus?
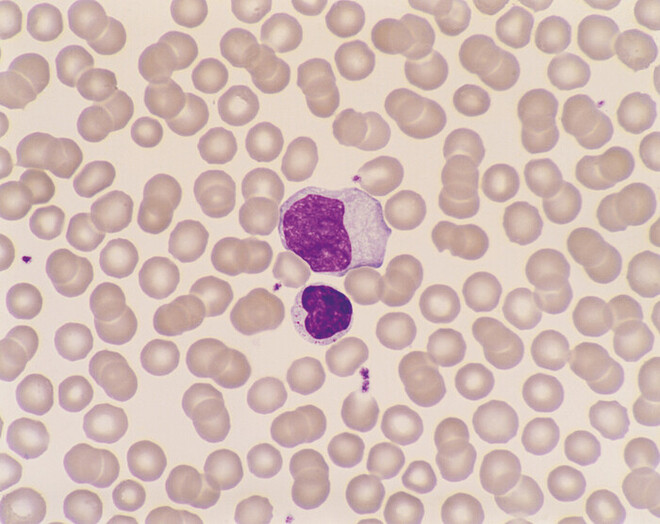
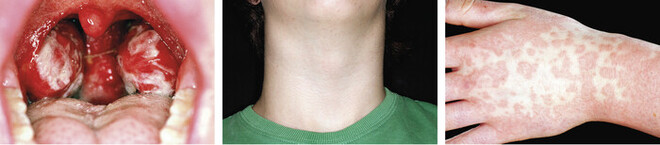
Im Gegensatz zur asymptomatisch verlaufenden Erstinfektion im Kindesalter kommt es bei Infektionen im Jugend- oder jungen Erwachsenenalter zumeist zum Erkrankungsbild der infektiösen Mononukleose. Aufgrund des eingangs beschriebenen Infektionsweges und der in diesem Alter zunehmend gelebten Sexualität wird die Erkrankung auch passenderweise als kissing disease oder Studentenfieber bezeichnet. Der Begriff der infektiösen Mononukleose leitet sich aus den mikroskopisch sichtbaren, pathognomonischen Blutbildveränderungen ab, wobei hierbei eine Leukozytose (Erhöhung der Leukozytenzahl auf 10.000 bis 30.000/µl) und T-Lymphozyten mit einem atypisch vergrößerten und ausgefransten Zellkern (virusspezifische reaktive T-Lymphoblasten) charakteristisch sind (Abb. 2). Nach einer Inkubationszeit von vier bis sieben Wochen treten als typische Symptome der Erkrankung Fieber, Müdigkeit, Halsschmerzen und Lymphknoten-Schwellung (bis auf Hühnereigröße, Abb. 3) auf, wodurch die synonyme Bezeichnung der Erkrankung als Pfeiffersches Drüsenfieber (benannt nach dem gleichnamigen Erstbeschreiber und Kinderarzt Emil Pfeiffer) gut nachvollziehbar wird. Des Weiteren können geschwollene Mandeln mit weißlichen Belägen (Angina tonsilliaris, Abb. 3 links), makulopapulöses Exanthem (knotig-fleckige Hauteffloreszenzen), Transaminasen-Anstieg und Hepatomegalie bei Leberbeteiligung auftreten. Obwohl die Dauer der Erkrankung mit vier bis sechs Wochen ausgesprochen lang und von starkem Krankheitsgefühl geprägt ist, heilt die Erkrankung in der Regel komplikationslos ab [1 – 3].
Schwere Verläufe, die sich zum Teil über Monate hinziehen und mit gravierenden Komplikationen wie Myokarditis, Meningitis oder Milzruptur einhergehen können, wurden bei immungeschwächten Patienten (z. B. AIDS-Patienten, Immunsuppression nach Organtransplantationen) beschrieben. Bei diesen Patienten versagt die eingangs beschriebene Immunreaktion und führt zu einer unkontrollierten Vermehrung von EBV-infizierten Zellen und massiver Freisetzung von Epstein-Barr-Viren einerseits und unkontrollierter Lymphozytenproliferation andererseits.
Zur näheren Erforschung der bisher nur unzureichend verstandenen individuellen Risikofaktoren (z. B. genetische Immunschwäche wie das Duncan-Syndrom) läuft derzeit am Deutschen Zentrum für Infektionsforschung (DZIF) unter Beteiligung von Forschergruppen der Technischen Universität München, der Ludwig-Maximilians Universität München, dem Helmholtz Zentrum München, dem Deutschen Krebsforschungszentrum (DKFZ) Heidelberg und der Medizinischen Hochschule Hannover die sogenannte IMMUC-Studie (infektiöse Mononukleose in München), deren Ergebnisse in 2020 erwartet werden [4].
Bisher steht zur Behandlung der infektiösen Mononukleose keine kausale Therapie zur Verfügung. Die gegen Herpesviren wirksamen Substanzen Aciclovir, Valaciclovir, Famciclovir oder Brivudin sind klinisch kaum effektiv (nur in vitro) [5]. Die symptomatische Therapie beschränkt sich daher insbesondere auf Fiebersenkung und die antibiotische Behandlung etwaiger bakterieller Begleitinfektionen.
Eine weitere, zweifelsfrei mit Epstein-Barr-Viren assoziierte Erkrankung ist das Burkitt-Lymphom, benannt nach dem Chirurgen und Tropenmediziner Denis Parsons Burkitt. Hierbei handelt es sich um ein Non-Hodgkin-B-Zell-Lymphom, welches insbesondere in Äquatorialafrika (z. B. Kongorepubliken, Gabun, der Zentralafrikanischen Republik, Äquatorialguinea und Kamerun) endemisch ist und zumeist bei Kindern im Alter von sechs bis zehn Jahren auftritt. Das Burkitt-Lymphom ist einer der am schnellsten wachsenden Tumore des Menschen. Die Tumorzellen stellen hierbei EBV-infizierte monoklonale, proliferierende B-Lymphozyten dar, die ein verdrängendes, aber nicht metastasierendes Wachstum aufweisen und zu entstellenden Tumoren insbesondere im Kiefer, Gesicht und Abdomen führen können. Eine mögliche Assoziation mit Malaria wird angenommen, konnte bisher aber noch nicht zweifelsfrei bewiesen werden [3, 6 – 7].
Das Burkitt-Lymphom spielte auch eine wesentliche Rolle bei der Entdeckung der Epstein-Barr-Viren, denn im Jahr 1964 konnten von den Virologen Michael Anthony Epstein und dessen Mitarbeiterin Yvonne Barr in Zellkulturen des Burkitt-Lymphoms erstmals die später nach ihnen benannten Viren nachgewiesen werden. Unter Berücksichtigung der Assoziation von Infektion und Erkrankung und des Befundes, dass das Epstein-Barr-Virus B-Lymphozyten in vitro zu unbegrenztem Wachstum anregt (Immortalisation), gilt das Epstein-Barr-Virus als onkogen, was auch der Einschätzung der WHO entspricht [8].
Vom endemischen Burkitt-Lymphom ist die sporadisch auftretende Variante der Erkrankung, die auch in gemäßigten Klimazonen von Europa und Nordamerika auftritt, abzugrenzen, denn hier liegt eine EBV-Infektion nur in etwa 20% der Fälle vor. Hier scheinen genetische Veränderungen (z. B. im sogenannten Myc-Gen) sowie angeborene Immunschwächen die Hauptursache darzustellen. Des Weiteren sind erworbene Immunschwächen, wie sie bei AIDS-Patienten vorliegen, oder pharmakologisch induzierte Immunsuppression nach Organtransplantationen Ursachen für die Entstehung von B-Zell-Lymphomen (PTLD, posttransplantation lymphoproliferative disease). In diesem Zusammenhang sind etwa 70% Prozent der HIV-assoziierten Lymphome sowie 70% der Lymphome nach Organtransplantation mit Epstein-Barr-Viren assoziiert [3, 6]. Bei immungeschwächten Patienten kann eine chronische EBV-Infektion auch zu einer oralen Haarleukoplakie (nicht maligne, schmerzlose weiße Beläge am Zungenrand oder der Wangen-Schleimhaut) führen [6 – 8].
Als möglichen Mechanismus der onkogenen Wirkung von Epstein-Barr-Viren wurde kürzlich von DKFZ-Forschern das Virusprotein BNRF1 diskutiert, welches die ordnungsgemäße Zellteilung stört und sich in der Folge häufig mehr als zwei Zentrosomen (Spindelpole) bilden. Dadurch verteilen sich die Chromosomen während einer Zellteilung nicht mehr gleichmäßig auf die gebildeten Tochterzellen, was als eine Ursache der Krebsentstehung anerkannt ist [9].
Welche anderen Erkrankungen werden mit dem Epstein-Barr-Virus in Verbindung gebracht?
Neben der infektiösen Mononukleose und dem Burkitt-Lymphom gibt es auch Hinweise für eine kausale Beteiligung von Epstein-Barr-Viren beim Nasopharynxkarzinom (Schminckesches Lymphoepitheliom), ein insbesondere in Südchina und Nordafrika auftretendes B-Zell-Lymphom. Neben spezifischen Ernährungsgewohnheiten (z. B. Zufuhr von Nitrosaminen und Phorbolester) scheint dem Epstein-Barr-Virus hierbei die Rolle eines zusätzlichen Risikofaktors zuzukommen. Gleiches gilt für Karzinome von Magen und Speicheldrüsen. Allerdings ist die Pathogenese für mit dem Epstein-Barr-Virus assoziierte Hals-Nasen-Rachen-Tumore sowie Magentumore weitgehend unverstanden [3].
Europäische und amerikanische Studien konnten zeigen, dass etwa 8 bis 10% der Magenkarzinome, 30% der Hodgkin-Lymphome, 10% der großzelligen B-Zell-Lymphome und nahezu alle altersassoziierten Lymphome einen Bezug zur EBV-Infektion aufweisen [3, 6 – 8]. Gerade der letztgenannte Befund spricht dafür, dass chronisch aktive EBV-Infektionen auch zu einer Transformation von anderen Lymphozyten wie T-Lymphozyten und natürlichen Killerzellen und dadurch letztlich zur Ausbildung eines Lymphoms führen können. Eine chronische Infektion mit Epstein-Barr-Viren scheint zudem das Risiko für das multiple Myelom im Alter merklich zu erhöhen [10].
Auf einen Blick
- Das Epstein-Barr-Virus gehört zu den humanen Herpes-Viren und wird als onkogen eingestuft.
- Das Virus wird über Tröpfcheninfektion durch Speichel oder beim Niesen übertragen.
- Typische Symptome des vom Epstein-Barr-Virus am häufigsten verursachten Pfeifferschen Drüsenfieber sind Müdigkeit, hohes Fieber, geschwollene Mandeln mit weiß-grauen Belägen, Lymphknotenschwellung, vor allem im Kopfbereich.
- Neben dem Pfeifferschen Drüsenfieber werden Infektionen mit dem Epstein-Barr-Virus mit zahlreichen malignen Erkrankungen und anderen nicht-malignen schwerwiegenden Erkrankungen assoziiert.
- Es gibt noch keine spezifische Pharmakotherapie bei bestehender Epstein-Barr-Virus-Infektion.
Nach Schätzungen der Bundesregierung können weltweit etwa 2% aller Krebstodesfälle auf eine Infektion mit Epstein-Barr-Viren zurückgeführt werden (jährlich etwa 200.000 Fälle) [3, 11]. Da bisher aber die meisten Tumorerkrankungen nicht systematisch auf einen Zusammenhang mit Epstein-Barr-Viren untersucht werden, ist davon auszugehen, dass zahlreiche weitere Assoziationen bestehen und die konkrete Zahl EBV-bedingter Erkrankungs- und Todesfälle möglicherweise deutlich höher ist [6].
Neben den beschriebenen malignen Tumorerkrankungen wird das Epstein-Barr-Virus auch als Auslöser des chronischen Erschöpfungssyndroms (Chronic-Fatigue-Syndrom, CFS) angesehen [12]. Die genaue Prävalenz eines chronischen Erschöpfungssyndroms im Zusammenhang mit EBV-Infektion in Deutschland wird derzeit in der bereits eingangs erwähnten IMMUC-Studie untersucht [4].
Des Weiteren ist eine Beteiligung des Epstein-Barr-Virus an der Entstehung von Autoimmunerkrankungen wie der multiplen Sklerose beschrieben worden. Patienten mit vorliegender EBV-Infektion haben ein 16-fach erhöhtes Risiko, an multipler Sklerose zu erkranken. Falls in der Vergangenheit bereits ein Pfeiffersches Drüsenfieber aufgetreten ist, so steigt das Risiko sogar um das 30-Fache [13]. Der zugrunde liegende Mechanismus der Pathogenese wurde erst kürzlich aufgeklärt. Demnach scheint der virale Transkriptionsfaktor EBNA 2 im Zusammenwirken mit menschlichen Transkriptionsfaktoren Risikogene von Autoimmunerkrankungen wie Lupus erythematodes, multipler Sklerose und chronisch-entzündlichen Darmerkrankungen zu aktivieren [14].
Möglichkeiten der Prävention und Therapie
Die beschriebenen Assoziationen zu Tumorerkrankungen legen eindeutig eine onkogene Wirkung von Epstein-Barr-Viren nahe [3, 8]. Da EBV-Infektionen mit schätzungsweise 2% aller Krebstodesfälle in kausalen Zusammenhang gebracht werden und zudem zahlreiche weitere schwerwiegende Erkrankungen von einer Epstein-Barr-Virus-Infektion initiiert werden, kommt der Prävention vor einer Infektion in Form einer effektiven Schutzimpfung eine große volksgesundheitliche Bedeutung zu. In diesem Zusammenhang stellte die Fraktion der FDP am 12. April 2019 eine Kleine Anfrage im Deutschen Bundestag an die Bundesregierung. Bezugnehmend auf die vom Bundesministerium für Bildung und Forschung (BMBF), dem Bundesministerium für Gesundheit (BMG) und weiteren zahlreichen Organisationen aus Wissenschaft, Medizin, Politik, Wirtschaft und Gesellschaft am 29. Januar dieses Jahres ausgerufene „Nationale Dekade gegen Krebs“ sollten die konkreten Schritte der Bundesregierung offengelegt werden, um EBV-assoziierten Tumorerkrankungen entgegenzuwirken [15, 16]. Da diese Anfrage und die Antworten der Bundesregierung einen aktuellen Überblick der gesellschaftlichen Relevanz sowie die derzeitige Perspektive und konkreten Bemühungen der politischen Entscheidungsträger gewährt, sind die relevanten Punkte in Tabelle 2 zusammengefasst [11, 15].
Frage |
Antwort der Bundesregierung |
|---|---|
Welche konkreten Maßnahmen plant die Bundesregierung zur Prävention von EBV-assoziierten Krebserkrankungen? |
Im Rahmen der Nationalen Dekade gegen Krebs wurden drei Experten-Arbeitsgruppen eingerichtet, die aktuell prioritäre Handlungsfelder und Zielsetzungen abstimmen. Basierend auf diesen Ergebnissen wird die Bundesregierung konkrete Maßnahmen der Krebsbekämpfung einleiten. |
Wie gelingt es der Bundesregierung, EBV-assoziierte Erkrankungen in größerem Maße in der Öffentlichkeit zu thematisieren? |
Gezielte Maßnahmen zur Aufklärung der Öffentlichkeit über (EBV)-assoziierte Erkrankungen sind seitens der Bundesregierung derzeit nicht geplant. |
Welche Maßnahmen plant die Bundesregierung zu ergreifen, um zur Verbesserung der Früherkennung von EBV und Krebs beizutragen? |
Die Bundesregierung plant derzeit keine Maßnahmen, die speziell auf die Früherkennung von EBV ausgerichtet sind. |
In welcher Form fließen bereits Fördermittel der Bundesregierung in die Forschung, um die onkogene Wirkung des EBV näher zu erforschen? |
Unter anderem werden über das BMBF, das DZIF und die Deutsche Forschungsgemeinschaft (DFG) Fördermittel bereitgestellt. |
In welchem Umfang wird die Forschung zum EBV in Deutschland nach Kenntnissen der Bundesregierung jährlich gefördert? |
Der Umfang der Förderung von Forschung zum EBV in Deutschland insbesondere für DKFZ, HMGU und DZIF beträgt jährlich etwa 4 Millionen Euro. |
Inwieweit plant die Bundesregierung, die EBV-Forschung im Rahmen der Nationalen Dekade gegen Krebs in Zukunft mit öffentlichen Mitteln zu unterstützen? |
Im Rahmen der Nationalen Dekade wurden Experten-Arbeitsgruppen eingerichtet, um Handlungsempfehlungen zu erarbeiten. Eine verstärkte Förderung der Krebsforschung durch das BMBF im Rahmen offener Ausschreibungen ist geplant. |
Welche Kenntnisse hat die Bundesregierung bezüglich der Entwicklung eines Impfstoffes gegen EBV? |
Die Zahl von EBV-Impfstoffkandidaten ist nach derzeitigem Stand sehr begrenzt. Die klinische Entwicklung eines EBV-Impfstoffs befindet sich noch in einem frühen Stadium. Bis ein wirksamer und sicherer Impfstoff zur Verfügung stehen wird, müssen zahlreiche weitere Studien durchgeführt werden. |
Welche Schätzungen liegen der Bundesregierung über die Kosten eines zu entwickelnden Impfstoffs vor? |
Im Allgemeinen kann die Entwicklung eines neuartigen, sicheren und wirksamen Impfstoffs nach Kenntnis der Bundesregierung bis zu 20 Jahre dauern und bis zu eine Milliarde Euro kosten. |
Das größte Problem bei der Entwicklung eines potenten Impfstoffes stellen die eingangs dargestellten Lebenszyklen der Epstein-Barr-Viren dar. Typischerweise richten sich Impfstoffe gegen Oberflächenantigene (z. B. Hüllproteine) freier Viren, die im Fall der Epstein-Barr-Viren nur in der lytischen Phase vorkommen. Da in der latenten Phase aber keine intakten Viruspartikel, sondern nur sehr wenige Virusproteine gebildet und freigesetzt werden, ist die Infektion mit dem Epstein-Barr-Virus für das Immunsystem quasi unsichtbar, und eine bestehende Immunisierung gegen Virusoberflächenproteine wie VCA (Virus capsid antigen) geht ins Leere [17]. Gerade die latente Phase wird aber für die onkogene Wirkung der Epstein-Barr-Viren verantwortlich gemacht, da in dieser Phase potenziell onkogene Wachstumsfaktoren exprimiert werden. Diese werden vom Immunsystem aufgrund der intrazellulären Lokalisierung und ihrer geringen Anzahl oft nicht entdeckt, sodass bösartige Lymphproliferationen entstehen können [3, 6 - 8]. Das dargestellte Dilemma lässt sich auch im serologischen Verlauf der im Zusammenhang mit einer EBV-Infektion auftretenden Antikörpertiter nachvollziehen. In der Phase einer akuten Infektion sind die Antikörper Anti-VCA-IgG/-IgM, Anti-EA (early antigen)-IgG/-IgM vorhanden, die sich jedoch ausschließlich gegen Proteine der lytischen Phase richten (Tab. 1, Abb. 1).
Daher entwickelten Forscher am DKFZ vor kurzer Zeit einen Impfstoff, der Proteine beider Phasen berücksichtigt. Konkret wurden dazu virusähnliche Partikel ohne genetische Information genutzt, die Virusproteine der lytischen und latenten Phase präsentieren. In immunologisch humanisierten Mäusen konnte der effektive Schutz dieser Impfung vor einer Infektion mit Epstein-Barr-Viren bereits nachgewiesen werden [18, 19]. Nach dieser erfolgreichen Proof-of-concept-Studie im Tiermodell soll im nächsten Schritt basierend auf den gewonnenen Erkenntnissen ein Humanimpfstoff entwickelt werden. Unter Berücksichtigung der komplexen und strengen Kriterien der Entwicklung, Prüfung und des Inverkehrbringens eines derartigen Impfstoffes ist allerdings davon auszugehen, dass dies noch einige Jahre in Anspruch nehmen wird.
Ein weiterer, innovativer Ansatz der Therapie bestehender EBV-Infektionen besteht möglicherweise in der Inhibition des bereits mehrfach erwähnten Proteins EBNA-1, eines durchgehend in EBV-Tumoren exprimierten viralen Transkriptionsfaktors. Dr. Troy Messick und Mitarbeitern vom Wistar-Institut in Philadelphia gelang es, für dieses für die Virusreplikation essenzielle DNA-bindende Protein einen kleinmolekularen Hemmstoff zu entwickeln. In immunsupprimierten und mit EBV-assoziierten Tumoren transplantierten Mäusen konnte das Tumorwachstum dadurch signifikant reduziert werden [20]. Selbst bei längerfristiger Anwendung konnten keine Resistenzen beobachtet werden. Trotz dieser sehr zuversichtlich stimmenden Daten gilt es jedoch, auch diese Befunde der Präklinik für die klinische Prüfung im Menschen weiterzuentwickeln.
Ein anderes small molecule gegen EBV-assoziierte Tumoren ist möglicherweise der Tyrosinkinase-Hemmstoff TAK-659 der Firma Takeda. Der Wirkstoff inhibiert das wachstumsfordernde EBV-Protein LMP2A und kann somit das unkontrollierte Wachstum von B-Lymphozyten unterbinden. Nach einer erfolgreichen tierexperimentellen Studie, die das selektive Absterben von Tumorzellen zeigen konnte [21], ist der Entwicklungsprozess dieses Wirkstoffkandidaten am weitesten fortgeschritten, denn derzeit läuft bereits eine Phase-II-Studie in über 100 Patienten mit großzelligem B-Zell-Lymphom [22]. Die Studie wird aller Voraussicht nach im August dieses Jahres abgeschlossen werden.
Abschließend und zusammenfassend bleibt festzuhalten, dass das Epstein-Barr-Virus als definitiv onkogen einzustufen ist. Neben dem Pfeifferschen Drüsenfieber werden Infektionen mit dem Epstein-Barr-Virus mit zahlreichen malignen Erkrankungen (insbesondere Lymphomen) und anderen nicht-malignen aber nicht minder schwerwiegenden Erkrankungen assoziiert. Eine spezifische Pharmakotherapie bei bestehender EBV-Infektion ist greifbar. Eine weitaus größere Bedeutung kommt möglicherweise aber einer präventiven EBV-Impfung zu. Hierzu liegen vielversprechende Ansätze vor, die in den nächsten Jahren einen potenten Humanimpfstoff erwarten lassen. Dieser wird dann möglicherweise zum Standardprozedere der aktiven Immunisierung gegen die onkogene Wirkung der Viren gehören, wie sie heute bereits erfolgreich in Form der HPV-Impfung umgesetzt wird. |
Literatur
[1] Sodeik B et al. Herpesviren. In: Suerbaum S, Burchard GD, Kaufmann S, Schulz T (eds). Medizinische Mikrobiologie und Infektiologie. Springer-Lehrbuch; 2016:565-570
[2] Herold G. Epstein-Barr-Virus-Infektion. In: Innere Medizin. Köln: Gerd Herold; 2014:856-857
[3] Young LS et al. Epstein-Barr virus: more than 50 years old and still providing surprises. Nat Rev Cancer 2016;16:789-802
[4] Epstein-Barr-Virus: Von harmlos bis folgenschwer. Informationen des Bundesministeriums für Bildung und Forschung, Newsletter 86, November 2017, www.gesundheitsforschung-bmbf.de/de/epstein-barr-virus-von-harmlos-bis-folgenschwer-7238.php
[5] De Paor M et al. Antiviral agents for infectious mononucleosis (glandular fever). Cochrane Database Syst Rev 2016;12:CD011487
[6] Farrell PJ. Epstein-Barr Virus and Cancer. Annu Rev Pathol 2019;14:29-53
[7] Thompson MP et al. Epstein-Barr virus and cancer. Clin Cancer Res 2004;10:803-821
[8] Epstein-Barr Virus. IARC-Monographs – 100B. International Agency Reasearch and Cancer. https://monographs.iarc.fr/wp-content/uploads/2019/04/mono100B-6_new.pdf
[9] Shumilov A et al. Epstein-Barr virus particles induce centrosome amplification and chromosomal instability. Nat Commun 2017;8:14257
[10] Bosseboeuf A et al. Monoclonal IgG in MGUS and multiple myeloma target infectious pathogens. J Clin Invest Insight 2017;2(19):e95367, doi.org/10.1172/jci.insight.95367
[11] Antwort der Bundesregierung auf die Kleine Anfrage der Abgeordneten Otto Fricke, Christian Dürr, Grigorios Aggelidis, weiterer Abgeordneter und der Fraktion der FDP – Drucksache 19/9367 vom 14. Mai 2019, dip21.bundestag.de/dip21/btd/19/101/1910123.pdf
[12] Mensah FKF et al. Chronic fatigue syndrome and the immune system: Where are we now? Neurophysiol Clin 2017;47:131-138
[13] Ascherio A et al. Curr Top Microbiol Immunol 2015;390:365-385
[14] Harley JB et al. Transcription factors operate across disease loci, with EBNA2 implicated in autoimmunity. Nat Genet 2018;50:699-707
[15] Kleine Anfrage an den Deutschen Bundestag der Abgeordneten Otto Fricke, Christian Dürr, Grigorios Aggelidis, Renata Alt, Nicole Bauer et al. Die ausgerufene Dekade gegen Krebs, deren Ansatzpunkte und die krebstreibende Wirkung des Epstein-Barr-Virus. Deutscher Bundestag Drucksache 19/9367 vom 12. April 2019 dipbt.bundestag.de/dip21/btd/19/093/1909367.pdf
[16] Nationale Dekade gegen Krebs. Informationen des Bundesministeriums für Bildung und Forschung, www.bmbf.de/de/nationale-dekade-gegen-krebs-7430.html
[17] van Zyl DG et al. Progress in EBV Vaccines. Front Oncol 2019;9:104
[18] Neue Impf-Strategie gegen Epstein-Barr-Viren. Informationen des Deutschen Krebsforschungszentrum Nr. 02 vom 8. Januar 2019, www.dkfz.de/de/presse/pressemitteilungen/2019/dkfz-pm-19-02-Neue-Impf-Strategie-gegen-Epstein-Barr-Viren.php
[19] van Zyl DG et al. Immunogenic particles with a broad antigenic spectrum stimulate cytolytic T cells and offer increased protection against EBV infection ex vivo and in mice. PLoS Pathog 2018;14:e1007464
[20] Messick TE et al. Structure-based design of small-molecule inhibitors of EBNA1 DNA binding blocks Epstein-Barr virus latent infection and tumor growth. Sci Transl Med 2019;11(482)
[21] Cen O et al., Spleen Tyrosine Kinase Inhibitor TAK-659 Prevents Splenomegaly and Tumor Development in a Murine Model of Epstein-Barr Virus-Associated Lymphoma. mSphere 2018;3(4):e00378-18, doi: 10.1128/mSphereDirect.00378-18
[22] TAK-659 in Participants With Relapsed or Refractory Diffuse Large B-Cell Lymphoma (DLBCL). ClinicalTrials.gov Identifier: NCT03123393
[23] Brandis H et al. Lehrbuch der Medizinischen Mikrobiologie, 7. Auflage 1994, Gustav Fischer Stuttgart, Jena, New York

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.