
- DAZ.online
- News
- Pharmazie
- EU-Beschluss umgesetzt: ...
Mangelhafte Arzneimittelstudien aus Indien
EU-Beschluss umgesetzt: Zulassungen ruhen ab heute
Stuttgart - 21.08.2015, 11:46 Uhr
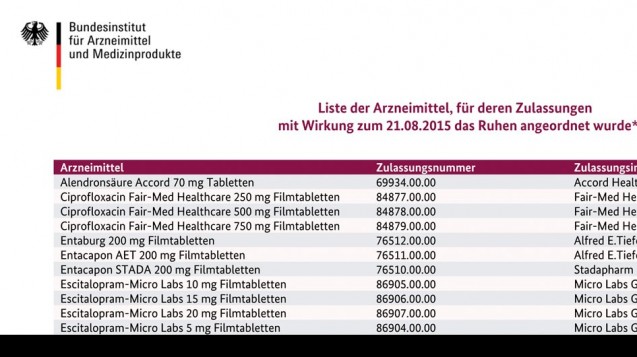
Die aktualisierte List des BfArM zu den ruhenden Zulassungen ist veröffentlicht. (Screen: BfArM)
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) hat den EU-Beschluss zu den generischen Arzneimitteln, deren Zulassungen aufgrund von zweifelhaften Studiendaten der indischen Firma GVK-Biosciences ab 21. August ruhen müssen, umgesetzt. Die aktualisierte Liste der in Deutschland betroffenen Präparate hat das BfArM jetzt veröffentlicht. Alle Präparate, die sich darauf befinden sind nicht mehr verkehrsfähig und dürfen nicht mehr abgegeben werden, bis die Hersteller entsprechende Studien nachgereicht haben.
Einen Sonderstatus hat das BfArM drei Arzneimitteln mit dem Wirkstoff Tracrolimus eingeräumt, da das Immunsuppressivum ein Wirkstoff der Substitutionsausschlussliste ist und nicht gegen ein wirkstoffgleiches Präparat ausgetauscht werden darf. Daher bleibt Tacpan in den Stärken 0,5 mg, 1 mg und 5 mg vorerst verkehrsfähig, obwohl es sich auf der Liste der Arzneimittel befindet, für die die Europäische Kommission ein Ruhen der Zulassung angeordnet hat. Hier hat der Hersteller jetzt zwölf Monate Zeit, die Bioäquivalenz der Produkte zu belegen.
17 Arzneimittel, die sich auf der Liste des BfArM befinden, sind in der Aufstellung der Europäischen Kommission nicht zu finden. Grund dafür ist, dass bei diesen Arzneimitteln die Zulassung zwar bereits erloschen ist, sie aber wegen besonderer nationaler Regelungen in Deutschland noch über einen begrenzten Zeitraum „abverkauft" werden dürfen, heißt es in einer Pressemeldung des BfArM. Um diesen Abverkauf zu stoppen, wurde aber auch für sie eine der Ruhensanordnung inhaltlich entsprechende Regelung ausgesprochen.
Das Ruhen der jeweiligen Zulassungen kann vom BfArM jederzeit aufgehoben werden, sobald die betroffenen pharmazeutischen Unternehmen durch Vorlage neuer Daten die Bioäquivalenz ihrer Arzneimittel neu nachweisen. Einige Hersteller haben von dieser Möglichkeit bereits Gebrauch gemacht. Daher wird bei diesen Präparaten die Ruhensanordnung der Europäischen Kommission nicht angewendet. Die jeweils aktuelle Version der Liste kann ausschließlich unter der Adresse www.bfarm.de/gvk bezogen werden und nicht aus anderen Quellen.
Zwei der betroffenen Hersteller (Mylan dura und Heumann) haben bereits vergangene Woche Präparate zurückgerufen. Die entsprechenden Formulare wurden gestern in der Fachpresse veröffentlicht.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.