
- DAZ.online
- DAZ / AZ
- DAZ 14/2009
- Diagnostik und Therapie ...
Schilddrüse
Diagnostik und Therapie des Schilddrüsenkarzinoms
Bei ungefähr 90% aller Schilddrüsenkarzinome handelt es sich um papilläre oder follikuläre Tumoren, die zusammenfassend als "differenzierte Schilddrüsenkarzinome" (DTC) bezeichnet werden. Die Altersverteilung der DTC zeigt keinen eigentlichen Gipfel, wohl aber gibt es Unterschiede bei den Typen. So tritt der papilläre Typ überwiegend zwischen dem 20. und 50. Lebensjahr auf, er kommt aber auch im Kindes- und Jugendalter vor (insbesondere nach Strahlenexposition).
In der WHO-Klassifikation werden insgesamt 15 Varianten des papillären Schilddrüsenkarzinoms aufgeführt [2]. Unter prognostischen Gesichtspunkten sind diese Varianten jedoch unbedeutend.
Iodmangelgebiet DeutschlandDeutschland gilt laut WHO-Bericht von 1998 weiterhin als Iodmangelgebiet. Bemühungen, die bisherige Iodaufnahme auf freiwilliger Basis zu verbessern, scheinen jedoch erste Erfolge zu zeigen. Aktuell erhobene Daten belegen eine langsam voranschreitende Verbesserung der Iodaufnahme, z. B. durch vermehrten Gebrauch von iodiertem Speisesalz sowohl in privaten Haushalten als auch in der Nahrungsmittelindustrie; die WHO-Empfehlung einer täglichen Iodaufnahme von 150 bis 300 µg ist derzeit aber noch nicht in vollem Umfang umgesetzt [15]. |
Thyreoidektomie
Die Behandlung eines DTC umfasst zumindest die chirurgische Entfernung des befallenen Schilddrüsenlappens. Außer bei unifokalen papillären Schilddrüsenkarzinomen mit einem Tumordurchmesser unter 1 cm sollte bei allen DTC eine totale Entfernung des Organs (Thyreoidektomie; Verfahrensanweisung der Deutschen Gesellschaft für Nuklearmedizin von 2007 [3]) erfolgen, gegebenenfalls mit Dissektion der zervikalen Lymphknoten. Langfristig sollen dadurch die Überlebensrate erhöht und die Rezidivrate vermindert werden.
Radioiodtherapie
DTC-Zellen zeigen noch viele Charakteristika gesunder Thyreozyten. Hinsichtlich der Behandlung und Nachsorge eines DTC ist vor allem wichtig, dass sie Iod aufnehmen und den Tumormarker Thyreoglobulin produzieren. Da das postoperativ verbliebene Schilddrüsengewebe Iod aufnimmt, ist seine Ablation (Entfernung) mit radioaktivem Iod (I-131 in Form von Natriumiodid) möglich; wenn nach erfolgreicher Behandlung wieder Thyreoglobulin gemessen wird, ist dies ein Hinweis auf ein Rezidiv.
Mehrere Untersuchungen haben den Stellenwert der Radioiodtherapie in der Behandlung von DTC klar dokumentiert. So zeigten Patienten in einer Studie von Mazzaferri und Jhiang nach I-131-Ablation ein signifikant besseres Überleben sowie eine niedrigere Rezidivrate [4]. Vor allem die geringere Rate von wieder auftretenden Tumoren ist in mehreren Studien von anderen Gruppen bestätigt und auch in einer aktuellen Metaanalyse belegt worden [5].
Das Ergebnis der initialen Radioiodtherapie ist ein wichtiger prognostischer Parameter, wie Verburg et al. zeigen konnten: Bei Patienten mit einer erfolgreichen Ablation sind die Rezidiv- und Mortalitätsraten deutlich niedriger als bei Patienten, bei denen keine komplette Ablation erreicht werden konnte [6]. Es bleibt jedoch festzuhalten, dass dieser günstige Einfluss der Radioiodtherapie nur langfristig dokumentierbar ist, weil Patienten mit differenzierten Schilddrüsenkarzinomen ohnehin eine überwiegend exzellente Prognose haben; die Überlegenheit des beschriebenen Vorgehens zeigt sich in Verlaufsbeobachtungen mit einem Beobachtungszeitraum von mindestens zehn Jahren [5].
Risiken und Nebenwirkungen
Die Radioiodtherapie ist ein relativ sicheres Verfahren. Jedoch ist – wie bei jeder Art ionisierender Strahlung – mit bestimmten Risiken zu rechnen. Das häufigste Problem nach einer Radioiodtherapie ist das Auftreten einer Sialadenitis (Speicheldrüsenentzündung), die bei einzelnen Patienten zu einer ausgeprägten Mundtrockenheit führen kann [7]. Ein potenzielles Risiko ist das von einigen Autoren beschriebene vermehrte Auftreten von Zweitmalignomen (Speicheldrüsen, Magen, Harnblase und Leukämie) [8 – 10]. Dies gilt jedoch, wenn überhaupt, nur für höhere Bestrahlungsdosen. Eine aktuelle Erhebung an einer sehr gut charakterisierten Patientengruppe konnte keinen Zusammenhang zwischen Radioiodtherapie und Zweitmalignomen nachweisen [11].
Vorbereitung der Radioiodtherapie
Die Radioiodtherapie nach der chirurgischen Entfernung eines Schilddrüsenkarzinoms erfordert hohe TSH-Spiegel (TSH = Thyreoidea-stimulierendes Hormon, Thyreotropin), wobei Werte über 30 mU/l als adäquat gelten [12]. TSH-Spiegel in dieser Höhe stellen sich durch den Mangel an dem Schilddrüsenhormon Thyroxin ein, und zwar typischerweise etwa drei Wochen nach der Thyreoidektomie oder vier Wochen nach Absetzen einer Levothyroxin-Substitution.
Da die Hypothyreose bei Patienten nicht nur Unannehmlichkeiten, sondern gravierende gesundheitliche Schäden verursachen kann, wird zur Vorbereitung auf die Radioiodtherapie die Gabe von rekombinantem humanem TSH (rhTSH, Thyreotropin alfa) empfohlen [13]. Ein weiterer Vorteil dieser TSH-Substitution besteht darin, dass die Nierenfunktion nicht beeinträchtigt wird, was eine höhere renale Ausscheidung des radioaktiven Iods und somit eine geringere Strahlenexposition des gesamten Körpers zur Folge hat [14].
Gabe von Levothyroxin
Ist die Radioiodtherapie durchgeführt worden, ist es von oftmals entscheidender Bedeutung für die Gesamtprognose, die TSH-Produktion durch die ausreichende Gabe von Levothyroxin zu unterdrücken, denn TSH regt das Wachstum der eventuell noch vorhandenen (malignen) Schilddrüsenzellen an. Der TSH-Spiegel soll höchstens 0,1 mU/l betragen und ist, insbesondere bei Patienten mit erhöhtem Rezidivrisiko, streng zu kontrollieren.
Typische Levothyroxindosen liegen bei diesen Patienten zwischen 125 und 250 μg täglich. Im Falle eines niedrigen Risikos (Tumorstadium T1 bis T2 ohne Vorliegen von Lymphknoten- und/oder Fernmetastasen) erscheint die Einstellung auf einen niedrignormalen bis erniedrigten TSH-Spiegel (0,2 bis 0,5 mU/l) ausreichend [12].
Die genaue Dosisfindung kann im Einzelfall mehrere Monate in Anspruch nehmen, da eine gewichtsorientierte Abschätzung (2 bis 2,5 × Körpergewicht = μg Levothyroxin) nur einen ersten Anhaltspunkt darstellt und die Balance zwischen optimalem TSH-Wert und körperlichem Wohlbefinden erst ermittelt werden muss. Nach jeder Korrektur bzw. Dosisanpassung sollten etwa sechs Wochen vergehen, bis der TSH-Spiegel erneut bestimmt wird, da sich zunächst ein neues Gleichgewicht einstellen soll.
Tipps zur Verordnung und Anwendung
Levothyroxin ist chemisch nicht sehr stabil; seine Stabilität hängt von verschiedenen Faktoren wie Temperatur, Luft, Licht und Feuchtigkeit und nicht zuletzt von der galenischen Zubereitung ab.
Die Resorption im Darm ist am besten, wenn die Einnahme 30 bis 60 Minuten vor einer Mahlzeit erfolgt; bei einer Einnahme mit der Mahlzeit sind eventuell nur 35% der aufgenommenen Menge bioverfügbar.
In jüngerer Vergangenheit häufen sich in großen Schilddrüsenambulanzen und Praxen Fälle von schlecht eingestellten Patienten, die zuvor über Jahre unkompliziert zu führen waren. Um den betroffenen Patienten diese unnötigen Arztbesuche und TSH-Kontrollen zu ersparen, sollte der behandelnde Arzt möglichst an der einmal gefundenen medikamentösen Einstellung festhalten und auf dem Rezept ein "aut idem" ausschließen.
Selbstverständlich ergeben sich in der Nachsorge auch weiterhin Situationen, in denen eine Neueinstellung erforderlich wird. Gerade in Zeiten hormoneller Umstellung wie Pubertät, Schwangerschaft und Klimakterium ist ein enges Zusammenspiel von Klinik, Patient und Hausarzt unabdingbar.
| Tab. 1: Kriterien für die Malignität von Schilddrüsenknoten [17] | |
| Eher verdächtige Knoten | Eher unverdächtige Knoten |
| Fehlen eines Halo | Halo (immer gut vaskularisiert) |
| Unregelmäßige Begrenzung, "Satelliten" | Gute Begrenzung |
| Mikroverkalkungen, verstärkte Vaskularisation im Knoten* | Geringe Vaskularisation im Knoten |
| Echoarmut | Echogleiche oder echoreiche Herde |
| * bei hypofunktionellen "kalten" Knoten | |
Schilddrüsenknoten – Diagnostik und ihre Konsequenzen
Knotenartige Veränderungen (Struma nodosa) sind ein häufiger Befund bei der Untersuchung der Schilddrüse, der meist Konsequenzen für die weitere Diagnostik, die Verlaufsbeobachtung oder für die Therapie hat.
Aufgrund der geringeren Sensitivität der Palpation beim Nachweis kleiner Schilddrüsenknoten hat diese in den letzten Jahren gegenüber der Sonographie eher an Bedeutung verloren. Dagegen zeigt sich bei größeren Strumen eine gute Korrelation zwischen ertastetem und sonographisch gemessenem Knotenvolumen.
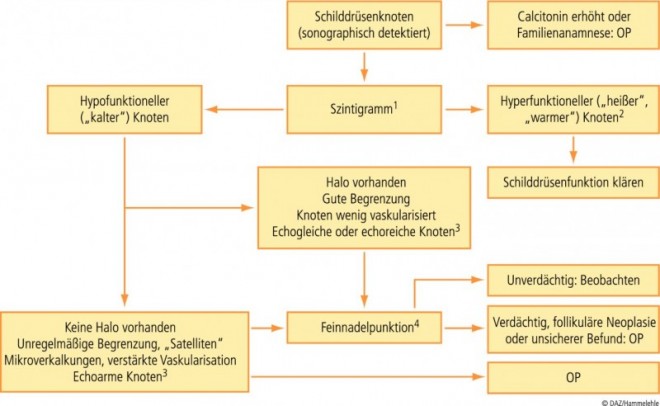
Nicht-tastbare Knoten haben meist einen Durchmesser unter 1 cm. Ob es sich um hyper- und hypofunktionelle Knoten handelt, kann nur durch die Szintigraphie sicher festgestellt werden. Allerdings weist ein niedriger TSH-Spiegel auf das Vorliegen von hyperfunktionellen Knoten hin.
Gemäß der Richtlinie der Deutschen Gesellschaft für Nuklearmedizin sollten hypofunktionelle, "kalte" Knoten mit einem Durchmesser über 10 mm feinnadelpunktiert werden. Hyperfunktionelle, "heiße" Knoten sollen in der Regel nicht punktiert werden, weil sie ein extrem geringes Malignitätsrisiko haben (siehe Flussdiagramm) [16].
Ein hochsensitiver und zugleich hochspezifischer Aspekt für das Vorliegen eines Malignoms existiert leider nicht. Die American Association of Clinical Endocrinologists empfiehlt die Kombination mehrerer Kriterien, welche die Spezifität der Aussage erhöht (Tab. 1) [17]; die Sensitivität bleibt hierbei jedoch unbefriedigend.
Literatur
[1] Robert Koch-Institut (RKI). Krebs in Deutschland 2003 –2004, Häufigkeiten und Trends. 6. Aufl., Saarbrücken 2008. [2] De Dellis RA, et al (eds), World Health Organization. Pathology and Genetics of Head and Neck Tumours, Third Edition, IARC Press, Lyon 2004. [3] Dietlein M, et al, Deutsche Gesellschaft für Nuklearmedizin. Procedure guidelines for radioiodine therapy of differentiated thyroid cancer (version 3). Nuklearmedizin 2007;46:213 – 219. [4] Mazzaferri EL, Jhiang SM. Long-term impact of initial surgical and medical therapy on papillary and follicular thyroid cancer. Am J Med 1994;97:418 – 428. [5] Sawka AM, et al. Clinical review 170: A systematic review and metaanalysis of the effectiveness of radioactive iodine remnant ablation for well-differentiated thyroid cancer. J Clin Endocrinol Metab 2004;89:3668 – 3676. [6] Verburg FA, et al. Prognostic significance of successful ablation with radioiodine of differentiated thyroid cancer patients. Eur J Endocrinol 2005;152:33 – 37. [7] Alexander C, et al. Intermediate and long-term side-effects of high-dose radioiodine therapy for thyroid carcinoma. J Nucl Med 1998;39:1551 – 1554. [8] Subramanian S, et al: Second primary malignancy risk in thyroid cancer survivors: a systematic review and meta-analysis. Thyroid 2007;17:1277 – 1288. [9] Brown AP, et al. The risk of second primary malignancies up to three decades after the treatment of differentiated thyroid cancer. J Clin Endocrinol Metab 2008;93:504 – 515. [10] Rubino C, et al: Second primary malignancies in thyroid cancer patients. Br J Cancer 2003;89:1638 – 1644. [11] Verkooijen RB, et al. The incidence of second primary tumors in thyroid cancer patients is increased, but not related to treatment of thyroid cancer. Eur J Endocrinol 2006;155: 801 – 806. [12] Pacini F, et al. European Thyroid Cancer Taskforce. European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium. Eur J Endocrinol 2006;154:787 – 803. [13] Luster M, et al., European Association of Nuclear Medicine. Guidelines for Radioiodine Treatment of Differentiated Thyroid Cancer 2008. Eur J Nucl Med Mol Imaging 2008;35:1941 – 59. [14] Hänscheid, H, Lassmann M, Luster M, Reiners C. Iodine biokinetics and dosimetry in radioiodine therapy of thyroid cancer: procedures and results of a prospective international controlled study of ablation after rhTSH or hormone withdrawal. J Nucl Med 2006;47:648 – 654. [15] Gärtner R, Manz F, Grossklaus R. Representative data of iodine intake and urinary excretion in Germany. Exp Clin Endocrinol Diabetes 2001;109:2 – 7. [16] Dietlein M, et al, Deutsche Gesellschaft für Nuklearmedizin, Deutsche Gesellschaft für Medizinische Physik. Verfahrensanweisung für die Schilddrüsenszintigraphie (Version 3). Nuklearmedizin 2007;46:203 – 205. [17] American Association of Clinical Endocrinologists and Associazione Medici Endocrinologi. Medical guidelines for clinical practice for the diagnosis and management of thyroid nodules. Endocr Pract 2006;12:63 – 102.
Prof. Dr. Markus Luster
Universitätsklinikum Ulm, Klinik für Nuklearmedizin
Albert-Einstein-Allee 23, 89081 Ulm
markus.luster@uniklinik-ulm.de



















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.