
- DAZ.online
- DAZ / AZ
- DAZ 50/2022
- Inebilizumab nur alle ...
Arzneimittel und Therapie
Inebilizumab nur alle sechs Monate
Neuromyelitis-optica-Antikörper punktet mit langem Applikationsintervall
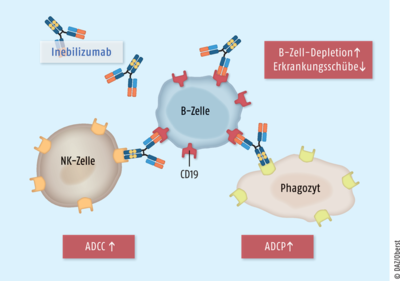
Neuromyelitis-optica-Spektrum-Erkrankungen (NMOSD) zählen mit einer Prävalenz von zwei bis vier Fällen pro 100.000 Personen zu den seltenen Autoimmunerkrankungen des zentralen Nervensystems. Sie treten normalerweise zwischen dem 30. und 40. Lebensjahr auf und betreffen überwiegend Frauen. Der Erkrankungsverlauf ist schubförmig, wobei am häufigsten Sehnerv, Rückenmark und Stammhirn betroffen sind. Neben einem Sehverlust treten Sensibilitätsstörungen und Lähmungen der Arme und Beine sowie ein Verlust der Darm- und Blasenkontrolle auf. Ohne effektive Therapie kommt es im Laufe der Zeit zu schweren, dauerhaften Behinderungen bis hin zum Tod. Bei den meisten Patienten sind gegen das durch Astrozyten im zentralen Nervensystem exprimierte Wasserkanalprotein Aquaporin 4 (AQP4) gerichtete Immunglobuline vorhanden. Diese führen im Rahmen einer Autoimmunreaktion die NMOSD-assoziierten entzündlichen Läsionen herbei. Bei der Pathogenese spielen offenbar B-Zellen eine zentrale Rolle. Der humanisierte monoklonale Antikörper Inebilizumab bindet hochspezifisch an das Oberflächenprotein CD19 auf Prä-B- und reifen B-Zell-Lymphozyten. Als Folge werden die Antikörper-abhängige zelluläre Zytolyse (antibody-dependent cellular cytolysis, ADCC) und die Antikörper-abhängige zelluläre Phagozytose (antibody-dependent cellular phagocytosis, ADCP) unterstützt, sodass eine B-Zell-Depletion resultiert. Man geht davon aus, dass eine reduzierte Antikörpersekretion, Antigenpräsentation, B-Zell-T-Zell-Interaktion sowie eine verminderte Produktion von Entzündungsmediatoren zur Besserung der Erkrankungssymptome beitragen (s. Abb.). In klinischen Untersuchungen blieb die B-Zell-Depletion bei 94% der Patienten mindestens über das sechsmonatige Applikationsintervall von Inebilizumab bestehen.
Der Antikörper Inebilizumab ist gegen das CD19-Antigen auf B-Zellen gerichtet. Nach derzeitigem Kenntnisstand wird vor allem über eine verstärkte Antikörper-abhängige zelluläre Zytotoxizität (ADCC), in erster Linie über natürliche Killerzellen (NK-Zellen), sowie über eine Antikörper-abhängige zelluläre Phagozytose (ADCP) eine über Monate anhaltende B-Zell-Depletion erreicht. Bei Patienten mit Neuromyelitis-optica-Spektrum-Erkrankungen kann die Inzidenz von Erkrankungsschüben hochsignifikant reduziert werden.
Schwere infusionsbedingte Reaktionen möglich
Inebilizumab wird initial im Abstand von zwei Wochen in einer Dosis von jeweils 300 mg intravenös appliziert. Im Rahmen der Langzeittherapie werden alle sechs Monate 300 mg eingesetzt. Insbesondere bei den ersten Applikationen muss mit infusionsbedingten Reaktionen und Überempfindlichkeitsreaktionen gerechnet werden, denen mit einer Prämedikation aus Corticosteroiden, Antihistaminika und Antipyretika begegnet werden sollte. Entsprechende Anzeichen sind Kopfschmerzen, Übelkeit, Somnolenz, Dyspnoe, Fieber, Myalgien und Hautausschläge. Bei schweren Reaktionen ist die Infusion vorübergehend zu unterbrechen oder die Infusionsgeschwindigkeit zu reduzieren. Bei lebensbedrohlichen Infusionsreaktionen muss die Inebilizumab-Therapie unverzüglich und dauerhaft beendet werden.
B-Zell-Depletion schwächt Immunabwehr
Aufgrund der Substanz-assoziierten Abnahme der B-Zell-Konzentration führt Inebilizumab zu einer Verringerung der Lymphozyten- und Neutrophilen-Zahl sowie der Immunglobulin(Ig)-Spiegel im peripheren Blut. Hieraus resultiert ein geschwächtes Immunsystem. Der CD19-Antikörper darf daher bei Vorliegen schwerer aktiver akuter oder chronischer Infektionen wie Hepatitis B, aktiver oder unbehandelter latenter Tuberkulose, progressiver multifokaler Leukoenzephalopathie, stark immunsupprimiertem Zustand sowie aktiven Malignomen nicht eingesetzt werden. Es besteht die Gefahr einer lebensbedrohlichen Verschlechterung dieser Erkrankungen. Aber auch das Auftreten zuvor noch nicht bestehender, schwerer Infektionserkrankungen wie Pneumonien oder Sepsis wird durch Inebilizumab begünstigt. In diesen Fällen muss die nächste Antikörper-Infusion so lange aufgeschoben werden, bis die Infektion abgeklungen ist. Bei schweren oder wiederkehrenden Infektionen kann ein endgültiger Abbruch der Inebilizumab-Therapie erforderlich sein.
Vorsicht bei Impfungen
Wirksamkeit und Sicherheit einer Immunisierung mit attenuierten und nicht-attenuierten Lebendimpfstoffen im Verlauf einer Inebilizumab-Behandlung sind nicht erwiesen. Daher wird empfohlen, alle erforderlichen Impfungen etwa vier Wochen vor Beginn der NMOSD-Therapie abzuschließen. Auch bei intrauterin gegen Inebilizumab exponierten Feten bzw. Neugeborenen besteht die Gefahr einer vorübergehenden B-Zell-Depletion und Lymphozytopenie, da IgG1-Antikörper bekanntlich die Plazentaschranke überwinden. Falls die Applikation von Inebilizumab bei schwangeren Frauen nicht vermieden werden kann, sollte die Anwendung von Lebendvirus-Impfstoffen nach der Geburt bei den betroffenen Kindern so lange verschoben werden, bis die B-Zellzahl wiederhergestellt ist.
Signifikant besser als Placebo
Sicherheit und Wirksamkeit des CD19-Antikörpers Inebilizumab wurden im Rahmen einer randomisierten, doppelblinden, placebokontrollierten Phase-II/III-Studie mit insgesamt 230 erwachsenen NMOSD-Patienten geprüft. Davon waren 213 Patienten Aquaporin-4-IgG-seropositiv. Immunsuppressive Hintergrundtherapien zur Vorbeugung von NMOSD-Schüben durften im Studienverlauf nicht weiterlaufen. In der therapierelevanten Subgruppe mit AQP4-IgG-seropositiven Personen erlitten innerhalb von maximal 197 Tagen 18 von 161 (11,2%) Teilnehmern des Verum-Arms eine NMOSD-Attacke, im Vergleich zu 22 von 52 (42,3%) Patienten des Placebo-Arms (p < 0,0001). Somit konnte eine hochsignifikante Überlegenheit von Inebilizumab gegenüber der Placebo-Gabe nachgewiesen werden, weswegen die Studie vorzeitig abgebrochen wurde.
Therapeutischer Fortschritt?
Aufgrund der meist schweren Symptomatik wird eine NMOSD bereits nach dem ersten Schub mit Immunsuppressiva wie Corticosteroiden, Azathioprin, Mycophenolatmofetil oder dem CD20-Antikörper Rituximab behandelt. Für Patienten mit Aquaporin-4-IgG-seropositiver schubförmiger NMOSD, wie sie bei etwa 80% der Erkrankten auftritt, sind mittlerweile der gegen den Komplementfaktor C5 gerichtete Antikörper Eculizumab (Soliris®) und der Interleukin-6-Rezeptor-Antikörper Satralizumab (Enspryng®)zugelassen. Inwiefern der nun neu auf dem Markt verfügbare CD19-Antikörper Inebilizumab für die Patienten eine Verbesserung darstellt, ist aktuell nicht eindeutig zu sagen. Genau wie bei Eculizumab und Satralizumab gelingt es auch durch Inebilizumab, das Erkrankungsschub-Risiko um nahezu 80% zu reduzieren. Ein gewisser Vorteil für Inebilizumab liegt in der Tatsache begründet, dass der Wirkstoff nur in sechsmonatigen Abständen appliziert werden muss. Ein großer Nachteil ist jedoch, dass die intravenöse Gabe mit schweren, teilweise lebensbedrohlichen (Überempfindlichkeits-)Reaktionen assoziiert ist. Eculizumab wird in zweiwöchigen Abständen ebenfalls intravenös verabreicht. Hier sind jedoch weniger die infusionsbedingten Reaktionen sondern eher die belastenden kurzen Applikationsabstände problematisch. Das bereits für Jugendliche ab zwölf Jahren einsetzbare Satralizumab wird mit einem Fertigpen in vierwöchigen Intervallen subkutan gegeben. Auf den ersten Blick ist man geneigt, diesem insgesamt besser verträglichen Interleukin-6-Rezeptor den Vorzug zu geben. Für eine belastbare Einschätzung sind allerdings längerfristige Head-to-Head-Vergleiche erforderlich, um den Einfluss von Inebilizumab, Eculizumab und Satralizumab auf den Behinderungsgrad und die Lebenserwartung von NMOSD-Patienten sowie die Langzeitsicherheit zu ermitteln. An dieser Stelle soll erwähnt werden, dass Inebilizumab derzeit für die Behandlung der systemischen Sklerose und des diffusen großzelligen B-Zell-Lymphoms untersucht wird. |
Literatur
[1] Fachinformation zu Uplizna®, Stand Juni 2022
[2] Cree BAC et al. Inebilizumab for the treatment of neuromyelitis optica spectrum disorder (N-MOmentum): a double-blind, randomised placebo-controlled phase 2/3 trial. Lancet 2019;394(10206):1352-1363
[3] Uplizna: EPAR – Medicine Overview. EMA/192406/2022. Europäische Arzneimittel-Agentur, Stand Mai 2022
[4] Neubeck M, Mutschler E. DAZ-Beilage Neue Arzneimittel, 69. Jahrgang, September 2022



















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.