
- DAZ.online
- News
- Politik
- Überschaubarer Nutzen zu...
TK-Innovationsreport 2017
Überschaubarer Nutzen zu hohen Preisen
Berlin - 20.09.2017, 16:35 Uhr
Die TK beschwert sich darüber, dass die Preise neuer Arzneimittel ansteigen, während nur wenige wirkliche Innovationen entstehen. (Foto: avarand/fotolia)
Die Preise für neue Arzneimittel steigen – doch von ihrer Innovationskraft lässt sich das nicht behaupten. Zu diesem Ergebnis kommt der Innovationsreport 2017 der Techniker Krankenkasse. Das AMNOG-Verfahren sei zwar grundsätzlich gut, meint TK-Chef Jens Baas. Doch es habe auch Lücken, die die Hersteller für sich nutzten. Baas forderte die Politik auf, den Herstellerrabatt gleich nach der Wahl wieder anzuheben.
Zum fünften Mal hat die Techniker Krankenkasse (TK) ihren Innovationsreport vorgelegt. Er erscheint, seit sich neue Arzneimittel der frühen Nutzenbewertung unterziehen müssen. Die TK wollte wissen: Wie innovativ sind diese neuen Präparate wirklich? Bewähren sie sich auch in der Versorgung? Solchen Fragen geht der Bremer Versorgungsforscher Professor Gerd Glaeske gerne nach, ebenso Professor Wolf-Dieter Ludwig, Onkologe und Vorsitzender der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ). Beide sind Herausgeber des Reports.
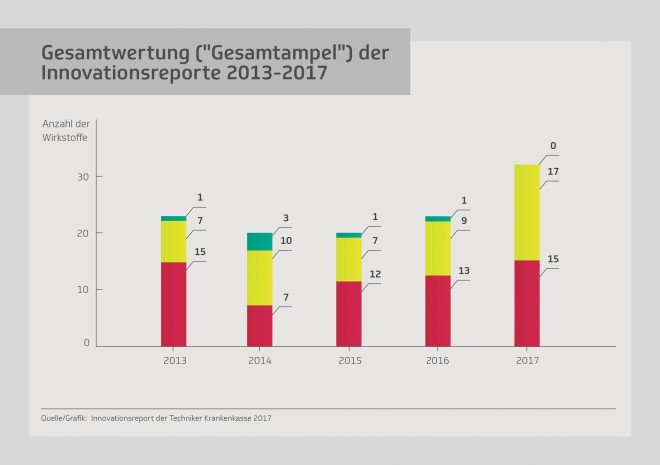
In diesem Jahr haben die Autoren des Reports 32 der 46 Neueinführungen des Jahres 2014 einer neuerlichen Bewertung im „Real Life“ unterzogen – darunter auch Sofosbuvir (Sovaldi®). Welche neuen Studien oder Beobachtungen wurden nach Einführung der Arzneimittel publiziert? Kam es in der Versorgung zu unerwünschten Wirkungen? Gab es Rote-Hand-Briefe – oder Blaue-Hand-Briefe? Wie haben sich die neuen Präparate überhaupt in den Markt eingefügt? Unter Berücksichtigung dieser neuen Erkenntnisse wurde untersucht, ob die Arzneimittel tatsächlich eine bestehende Therapie verbessern, einen Zusatznutzen für die Patienten haben und ob die Kosten im Rahmen bleiben. Diese drei Kriterien wurden einzeln per Ampelschema bewertet – und am Ende wurde ein Gesamt-Score, ebenfalls in Ampel-Darstellung – gebildet.
Erstmals keine „grüne Ampel”
TK-Chef Jens Baas ist ernüchtert über die Ergebnisse: Zum ersten Mal gab es keine einzige „grüne“ Gesamtampel. 17 der bewerteten Präparate wurden mit „gelb“ bewertet und 15 der neuen Arzneimittel – darunter vier Orphan Drugs – erhielten eine „rote“ Gesamtampel. Der Grund war in der Regel der hohe Preis. Aber auch die Therapiefortschritte ließen zu wünschen übrig: In der Einzel-Kategorie Zusatznutzen leuchtete die Ampel nicht ein einziges Mal grün. Und so gab es auch für Sovaldi® letztlich nur ein gelb. Obwohl TK-Chef Jens Baas das Hepatitis-C-Arzneimittel durchaus für einen beachtlichen Fortschritt hält. Allerdings sei bei ihm nicht nur der Preis kritisch, sondern auch der Umstand, dass es auch in Patientengruppen eingesetzt werde, für die es gar nicht bestimmt ist.
Wie sind die Preise in den Griff zu bekommen?
Angesichts der mageren Innovationskraft wurmen die hohen Preise natürlich besonders. Baas verwies darauf, dass er schon im vergangenen Jahr von einer Verdoppelung der durchschnittlichen Preise für neue Arzneimittel berichtet habe. Aktuell sei der durchschnittliche Preis pro Packung noch einmal um etwa 1000 Euro auf rund 2500 Euro gestiegen – ein Plus von 73 Prozent. Die Umsätze der neuen Arzneimittel im Jahr nach der Markteinführung hätten sich fast verfünffacht.
Baas: „Wir gehen davon aus, dass die Industrie in den kommenden Jahren die Preise noch weiter nach oben treiben wird. Daher muss die Politik gleich zu Beginn der neuen Legislaturperiode Nägel mit Köpfen machen und weitere kostendämpfende Maßnahmen ergreifen.“ Damit meint er eine Anhebung des Herstellerabschlags von sieben auf zehn Prozent. Das sei zwar ein „Knüppel“ – aber er sei gar nicht so dumm, da er jedenfalls sicher treffe. Andere Instrumente, insbesondere das Schließen von Lücken im AMNOG-Verfahren hält er zwar auch für nötig – aber sie wirken nicht so schnell.
Zu schnell in den Leitlinien?
Baas und Glaeske beklagten überdies, dass neue Arzneimittel sehr früh in Leitlinien übernommen werden. „Das wird oft missverstanden als Empfehlung“, so Glaeske. Dabei zeigten sich im wirklichen Leben, im Versorgungsalltag, dass noch so manche Tücken auftreten können. So wurden für sechs der aktuell bewerteten Arzneimittel Rote-Hand-Briefe ausgesendet; für zwei davon (Dimethylfumarat und Idelalisib) sogar zweimal innerhalb der ersten beiden Behandlungsjahre. Auch der Ende 2016 eingeführte Einsatz von Blaue Hand- Schulungsmaterialien traf vier Arzneimittel (Cholsäure, Delamanid, Elosulfase alfa und Macitentan).
Glaeske sieht zudem ein Problem in der zunehmenden Zahl
beschleunigter Zulassungen. Hier seien die unerwünschten Wirkungen ein noch
größeres Problem – was auch nicht weiter verwundert, da die
Zulassungsregelungen hier weniger Studien einfordern. 36 solcher Arzneimittel
gebe es schon auf dem deutschen Markt. Gerade sie bedürften einer besonderen
Beobachtung nach der Zulassung.
Problematische Orphan Drugs und hoffnungsvolle Biosimilars
Ein weiteres Problemfeld sind aus Sicht der TK-Herausgeber die Orphan Drugs – beziehungsweise der Umgang der Hersteller mit den bestehenden Regelungen. Orphan Drugs haben nicht nur bei der Zulassung besondere Anreize, auch bei der frühen Nutzenbewertung gibt es entschärfte Regeln. Ihr Zusatznutzen wird nämlich schon mit der Zulassung unterstellt. Und so ist in den vergangenen Jahren zu beobachten, dass sich der Anteil der Orphan Drugs an den Neuzulassungen beständig erhöht. Bei Arzneimitteln gegen seltene Erkrankungen liegt es in der Natur der Sache, dass Studien mit eine aussagekräftigen Teilnehmerzahl schwierig sind. Umso wichtiger ist es, sie weiter zu beobachten, wenn sie tatsächlich in der Versorgung sind. Doch Ludwig muss feststellen: „Fünf bis zehn Jahre nach der Zulassung wissen wir in der Regel nicht mehr als zum Zeitpunkt der Zulassung“.
Ein Hoffnungsschimmer sehen die Herausgeber des Reports und die TK in Biosimilars. Durch zahlreiche Patentabläufe werde sowohl ihre Bedeutung wachsen, als auch die Möglichkeit, mit ihnen zu sparen. Die TK hält Einsparungen von bis zu 500 Millionen Euro für die GKV in den nächsten Jahren für erreichbar. Darauf setzt auch Ludwig, der zugleich auf den jüngst erschienenen Leitfaden der AkdÄ zu Biosimilars hinweist. Dessen Credo: Biosimilars lassen sich genauso einsetzen wir ihre Originale. Hier seien leider viele Desinformationen gestreut worden, die Gefahren heraufbeschworen. Doch die kann Ludwig nicht erkennen. Selbst bei Original-Biologika sei jede Charge immer noch der vorangegangen ähnlich. Eine Einschränkung macht die AkdÄ jedoch für Biosimilars: Eine Substitution in der Apotheke lehnt sie ab. Allerdings handele es sich ohnehin zumeist um Arzneimittel und Darreichungsformen, die im Krankenhaus zum Einsatz kämen.
Industrie: Verzerrter Blick
Kritik am Report kam von den Industrieverbänden. Die TK habe einen verzerrten Blick auf die Patientenversorgung, meint man etwa beim Bundesverband der Pharmazeutischen Industrie (BPI). Norbert Gerbsch, stellvertretender BPI-Hauptgeschäftsführer betonte: „Arzneimittel werden nur zugelassen, wenn sie ein positives Risiko-Nutzen-Verhältnis haben, also Patienten von ihnen profitieren. Es kann nicht akzeptiert werden, diese Entscheidung mit Blick auf Kosten anzuzweifeln, um Versicherten zukünftig Therapieoptionen zu nehmen.“
Auch der Verband der forschenden Pharmaunternehmen (VfA) kritisiert, dass der TK-Report zu stark auf Kosten fokussiert und den Nutzen neuer Arzneimittel ignoriert. Die Ausgaben seien mit Blick auf den medizinischen Fortschritt gerechtfertigt und blieben unter Kontrolle, heißt es in einer Pressemitteilung des VfA. Hauptgeschäftsführerin Birgit Fischer: „Jedes Jahr hören wir von den Kassen, dass es angeblich nichts wirklich Neues in der Arzneimitteltherapie gibt. Doch wer über mehrere Jahre hinschaut, sieht sehr relevante Therapiefortschritte, die für Patienten längeres Überleben und oft eine Rückkehr in ihren gewohnten Alltag bedeuten. Dazu passt das Lamentieren der Kassen nicht. Das Missachten des medizinischen Fortschritts hat System“.
Wer tiefer in den Innovationsreport einsteigen möchte: Hier können Sie ihn als pdf herunterladen. Und wer noch mehr wissen will: Zum ersten Mal gibt es auch eine noch ausführlichere Version, die zudem aktualisiert wird, wenn es nötig wird. Diese finden Sie auf den Internetseiten des Socium der Uni Bremen.

















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.