
- DAZ.online
- News
- Pharmazie
- FDA lässt erstes Corona-...
Remdesivir auch für nicht hospitalisierte Kinder
FDA lässt erstes Corona-Arzneimittel für Säuglinge offiziell zu
Stuttgart - 28.04.2022, 16:45 Uhr
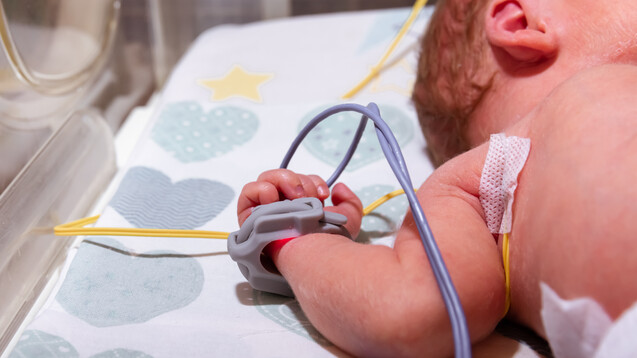
Die US-amerikanische Arzneimittelbehörde FDA genehmigte am 25. April Remdesivir als erstes Arzneimittel offiziell auch für die Corona-Behandlung von Säuglingen und Kindern. (s / Foto: July / AdobeStock)
Das erste Arzneimittel gegen COVID-19 für Kinder ist offiziell zugelassen – zumindest in den Vereinigten Staaten: Remdesivir in Veklury darf bereits bei Säuglingen ab 28 Tagen (mindestens 3 kg) angewendet werden – auch wenn sie nicht hospitalisiert sind. Zuvor bestand lediglich eine Notfallgenehmigung.
Remdesivir war das erste Arzneimittel gegen COVID-19, das auf den Markt kam. Erneut schafft Gilead mit Veklury® nun eine Premiere: Die US-amerikanische Arzneimittelbehörde FDA genehmigte am 25. April den RNA-Polymerase-Inhibitor als erstes Arzneimittel offiziell auch für die Corona-Behandlung von Säuglingen und Kindern. SARS-CoV-2-positive Säuglinge erhalten ab einem Alter von 28 Tagen und einem Mindestgewicht von 3 kg Remdesivir, wenn diese hospitalisiert sind oder leicht bis mittelschwer erkrankt, mit hohem Risiko für einen schweren COVID-19-Verlauf, der Krankenhauseinweisung und Tod einschließt.
Mehr zum Thema

Offizielle Zulassung nach Notfallgenehmigung
FDA lässt Remdesivir zu
Beschleunigte Zulassung bei der FDA?
Widersprüchliches zu Remdesivir – hilft es bei COVID-19?
Bislang war Remdesivir lediglich für Ab-Zwölfjährige offiziell zugelassen – die FDA hatte Remdesivir bereits im Oktober 2020 für aufgrund von COVID-19 hospitalisierte Zwölfjährige und einem Mindestgewicht von 40 kg die bis dahin gültige Notfallzulassung in eine reguläre Zulassung umgewandelt. Allerdings war sich die FDA damals bewusst, dass diese reguläre Zulassung sodann nicht die gesamte Population („adults and children“) abdeckte, für die Remdesivir seit der ersten Notfallzulassung im Mai 2020 gedacht war: Um auch hospitalisierte pädiatrische Patienten ab einem Mindestgewicht von 3,5 kg weiterhin mit Remdesivir behandeln zu können, hatte die FDA damals die Notfallzulassung für Säuglinge und Kleinkinder angepasst. Im Januar 2022 folgte dann die Indikationserweiterung, zunächst für nicht hospitalisierte, an Corona erkrankte Jugendliche ab zwölf Jahren – nun auch für nicht hospitalisierte Säuglinge.
Klinische Verbesserung unter Remdesivir
„Da COVID-19 bei Kindern, von denen einige derzeit keine Impfmöglichkeit haben, schwere Erkrankungen hervorrufen kann, besteht weiterhin ein Bedarf an sicheren und wirksamen COVID-19-Behandlungsmöglichkeiten für diese Bevölkerungsgruppe“, sagte Patrizia Cavazzoni, M.D., Direktorin der Center for Drug Evaluation and Research der FDA.
Die Zulassung stützt sich Gilead zufolge auf Ergebnisse der einarmigen, offenen Phase-2/3-Studie CARAVAN, an der auch 53 Kinder teilnahmen. Remdesivir erwies sich bei mit Corona hospitalisierten pädiatrischen Patienten als sicher, die meisten Kinder (85 Prozent) zeigten eine klinische Verbesserung, 60 Prozent der Kinder konnten an Tag 10 das Krankenhaus verlassen, an Tag 30 waren 83 Prozent entlassen. 72 Prozent der Kinder entwickelten unerwünschte Arzneimittelwirkungen (21 Prozent schwerwiegend, drei Todesfälle, die laut Gilead nicht mit Remdesivir zusammenhingen). Die Ergebnisse waren Anfang Februar auf der „Conference on Retroviruses and Opportunistic Infections“ (CROI) vorgestellt worden.
Neben den Daten aus CARAVAN zog die FDA auch Studiendaten von Erwachsenen für die Zulassung heran: „Angesichts des ähnlichen Verlaufs der COVID-19-Erkrankung bei Erwachsenen und pädiatrischen Patienten wird die heutige Zulassung von Veklury bei bestimmten pädiatrischen Patienten durch die Wirksamkeitsergebnisse aus klinischen Phase-3-Studien bei Erwachsenen unterstützt“, erklärt die FDA dazu.



















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.