
Thema
Committee for Medicinal Products for Human Use
Trastuzumab-Biosimilar von Celltrion erhält EU-Zulassung
Roches Brustkrebsblockbuster Herceptin® bekommt weitere Konkurrenz in Europa. Die EU-Kommission hat nämlich nach Ontruzant® das zweite Trastuzumab-Biosimilar zugelassen – Herzuma® von Celltrion... » Weiterlesen

Antimykotikum wird zum Orphan Drug
Von Christina Keksel und Niels Eckstein | Die Geschichte des Wirkstoffs Ketoconazol zeigt eindrucksvoll, wie sich der Zulassungsstatus eines Arzneimittels ändern kann: Als Breitspektrum-Antimykotikum... » Weiterlesen
Alternative zum Lebendimpfstoff gegen Gürtelrose
Der Humanarzneimittelauschuss der EMA CHMP hat sich für die Zulassung eines Impfstoffes gegen Herpes Zoster ausgesprochen. Im Gegensatz zum bisher verfügbaren – Zostavax® – handelt es sich ... » Weiterlesen

Weiteres Lantus-Biosimilar kurz vor der EU-Zulassung
Sanofis Basalinsulin Lantus® bekommt noch mehr Konkurrenz. Der Humanarzneimittelausschuss der EMA hat nämlich ein weiteres Biosimilar zur Zulassung empfohlen. Diesmal ist es die Firma Mylan, die ein... » Weiterlesen

Zulassungsempfehlung für weiteren SGLT-2-Inhibitor
Der Humanarzneimittelausschuss der EMA hat mit Ertugliflozin einen weiteren Wirkstoff aus der Gruppe der Gliflozine zur Behandlung des Typ-II-Diabetes zur Zulassung empfohlen – und zwar als ... » Weiterlesen
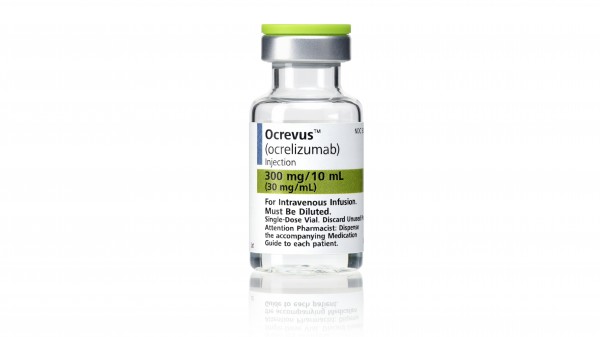
MS-Antikörper Ocrelizumab erhält EU-Zulassung
Die EU-Kommission hat Ocrelizumab die Zulassung erteilt. Damit steht mit dem Arzneimittel mit dem Handelsnamen Ocrevus® erstmalig eine zugelassene Therapieoption bei primär progredienter multipler ... » Weiterlesen

Diese Arzneimittel könnten 2018 auf den Markt kommen
Nach Schätzungen des Verbandes der forschenden Pharmaunternehmen (vfa) könnten in diesem Jahr mindestens 30 Arzneimittel mit neuem Wirkstoff beziehungsweise neuem Therapieprinzip zugelassen werden. ... » Weiterlesen
Vierfach-Impfstoffe in Österreich nicht mehr lieferbar
In Österreich gibt es aktuell einen Engpass bei der Versorgung mit Vierfach-Vakzinen für die Grippeschutzimpfung. Das deutsche Paul-Ehrlich-Institut meldet demgegenüber derzeit keine Lieferprobleme » Weiterlesen

Informationen über unerwünschte Wirkungen
AMK/ck | In der Rubrik „Wichtige Mitteilungen“ informiert die Arzneimittelkommission der Deutschen Apotheker über Fälle, in denen die Arzneimittelsicherheit infrage gestellt oder gefährdet ist... » Weiterlesen
Ixekizumab demnächst auch bei aktiver Psoriasis-Arthritis
Der Humanarzneimittelausschuss der EMA hat sich dafür ausgesprochen, die Zulassung des Interleukin-17A-Antikörper Ixekizumab um die Indikation „aktive Psoriasis-Arthritis bei erwachsenen ... » Weiterlesen

Kommt der erste Checkpoint-Inhibitor in die Pädiatrie?
Der Humanarzneimittel-Ausschuss der EMA (CHMP) hat den ersten Checkpoint-Inhibitor für Kinder zur Zulassung empfohlen. Erfolgt diese, könnten Onkologen den CTLA-4-Antikörper Ipilimumab (Yervoy®) ... » Weiterlesen

Hydrocortison bei Nebennieren-Insuffizienz speziell für Kinder
Kommt bald ein neues „Kinder-Arzneimittel“? Zumindest hat der Humanarzneimittel-Ausschuss der EMA (CHMP) Alkindi® als PUMA-Arzneimittel zur Zulassung empfohlen. Bei Erwachsenen bereits ... » Weiterlesen
Wirken Asthma-Antikörper auch nach dem Absetzen?
Viel Bewegung ist im Asthma-Antikörper-Markt. Nach Mepolizumab und Reslizumab hat die EMA mit Benralizumab (Fasenra®) den dritten Interleukin-5-Antikörper zur Zulassung empfohlen. Doch haben Asthma... » Weiterlesen
MS-Antikörper Ocrelizumab zur EU-Zulassung empfohlen
Der Humanarzneimittelausschuss der EMA, CHMP, hat sich für die Zulassung des MS-Antikörpers Ocrelizumab ausgesprochen. Vor allem Patienten mit primär progredienter Multipler Sklerose setzen ... » Weiterlesen

Depot-Exenatid auch mit Basalinsulin
Die Depotform des Inkretin-Mimetikums Exenatid (Bydureon®) soll in Zukunft auch in Kombination mit einem Basalinsulin angewendet werden können. Die EMA hat sich für diese Zulassungserweiterung ... » Weiterlesen

EU-Zulassung für neue HIV-Vierfach-Kombi
Die EU-Kommission hat eine neue Fix-Kombi zur Behandlung von HIV zugelassen – das erste Darunavir-basierte Single-Tablet-Regime. Das Präparat mit dem Handelsnamen Symtuza® kann bei Erwachsenen und... » Weiterlesen

Biosimilars in der Onkologie – ein No-Go?
Immer mehr Biologicals verlieren ihren Patentschutz, mit der Folge, dass zunehmend Nachahmerprodukte in den Markt drängen. So stehen inzwischen mit Truxima® und Rixathon® zwei Rituximab-Biosimilars... » Weiterlesen

Wie funktioniert ein OTC-Switch?
Racecadotril, Mometason-Nasenspray und Levonorgestrel zur Notfallkontrazeption – das sind einige der Arzneimittel, die in den vergangenen Jahren „geswitched“, also aus der Verschreibungspflicht ... » Weiterlesen
Cladribin erhält im zweiten Anlauf Zulassung bei MS
Die EU-Kommission hat Cladribin-Tabletten (Mavenclad®) die Zulassung bei multipler Sklerose (MS) erteilt – im zweiten Anlauf. Das teilt der Hersteller, die Darmstädter Merck KGaA, mit. Ein erster ... » Weiterlesen

EMA will minderjährige Patienten anhören
Zum ersten Mal will die Europäische Arzneimittelagentur (EMA) in London auch junge Menschen unter 18 Jahren an den Diskussionen in wichtigen wissenschaftlichen Gremien beteiligen. Die Prinzipien, wie... » Weiterlesen

Neuraxpharm ruft Bupropion 300 mg aus Apotheken zurück
Ab dem morgigen Mittwoch müssen erneut Zulassungen ruhen, die auf Bioäquivalenzstudien basieren, die von der indischen Firma Micro Therapeutic Research durchgeführt worden waren. In Deutschland ist... » Weiterlesen
Drei neue „mabs“ und eine Vierfach-Kombi gegen HIV
Die Familie der monoklonalen Antikörper wird wohl größer. Mit Avelumab, Dupilumab und Atezolizumab haben drei neue „mabs“ ein positives Votum des Humanarzneimittelauschusses der EMA erhalten. ... » Weiterlesen

Schalter auf rezeptfrei
Der Selbstmedikationsmarkt ist in den vergangenen Jahren beständig gewachsen. Regelmäßig werden zuvor verschreibungspflichtige Wirkstoffe in den OTC-Markt überführt. Teilweise erfordern diese ... » Weiterlesen




















Foto: dpa