
Thema
Committee for Medicinal Products for Human Use

Kurz gemeldet
Aliskiren: Neue Kontraindikationen | Boceprevir und HIV-Medikation | Exenatid: Zulassungserweiterung empfohlen | Adalimumab: EMA empfiehlt Zulassungserweiterung | Stufenplanverfahren für Excitalopram » Weiterlesen

Infliximab bald auch für Kinder mit Colitis ulcerosa
Das CHMP hat eine positive Opinion für Infliximab (Remicade®) zur Therapie der Colitis ulcerosa bei Kindern und Jugendlichen herausgegeben. In einer Phase-III-Studie sprachen drei Viertel der Kinder... » Weiterlesen

Escitalopram im Stufenplanverfahren
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) hat ein Stufenplanverfahren (Stufe II) für Escitalopram-haltige Arzneimittel eingeleitet. Nachdem der Ausschuss für Humanarzneimittel... » Weiterlesen
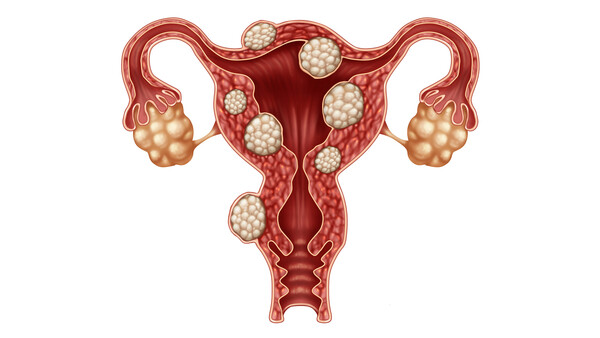
Ulipristal in der Therapie von Uterusmyomen wirksam
Als Esmya® wird Ulipristalacetat von der PregLem Holding SA zur präoperativen Behandlung von Myomen im Uterus bei Frauen im gebärfähigen Alter entwickelt. Es unterdrückt das Progesteron-abhä... » Weiterlesen

Kurz gemeldet
Signifor bei Morbus Cushing | Sitagliptin bei Nierenfunktionsstörung | Fingolimod auf Prüfstand | Infliximab - erweiterte Zulassung » Weiterlesen

Citalopram im Stufenplanverfahren
Erst kürzlich wurde in einem Rote-Hand-Brief darauf aufmerksam gemacht, dass das Antidepressivum Citalopram mit dosisabhängiger QT-Intervall-Verlängerung in Zusammenhang gebracht wird. Die ... » Weiterlesen

Tabakentzug mit Risiken
"Vareniclin nicht Mittel der 1. Wahl!"2007 wurde mit Vareniclin (Champix®) eine Alternative zu den bisherigen medikamentösen Raucherentwöhnungsmitteln in Deutschland auf den Markt gebracht. Sie ... » Weiterlesen

Insulin detemir jetzt auch für Kinder zwischen zwei und fünf Jahren
Die Europäische Kommission hat die Zulassung von Insulin detemir (Levemir®) auf Kinder im Alter zwischen zwei und fünf Jahren erweitert. Damit ist Insulin detemir das einzige Basalinsulin-Analogon... » Weiterlesen

EMA verweist auf Sicherheitsmaßnahmen zu Pradaxa®
Nun hat sich auch die Europäische Arzneimittelagentur (EMA) in die Diskussion um das Risiko tödlicher Blutungen unter Dabigatranetexilat (Pradaxa®) eingeschaltet. Sie bestätigt zwar, dass bis zum ... » Weiterlesen

EMA hält neue Pradaxa-Sicherheitsmaßnahmen für ausreichend
Nun hat sich auch die Europäische Arzneimittelagentur (EMA) in die Diskussion um das Risiko tödlicher Blutungen unter Dabigatranetexilat (Pradaxa®) eingeschaltet. Sie bestätigt zwar » Weiterlesen

Aus für Buflomedil-haltige Injektabilia
Ende Mai hatte das BfArM den Rückruf aller oraler Darreichungsformen des Vasodilatators Buflomedil veranlasst. Hintergrund war eine Empfehlung des Ausschusses für Humanarzneimittel (CHMP) der Europ... » Weiterlesen

Selbstmordgefahr unter Vareniclin besonders hoch?
Eine Raucherentwöhnung mit Vareniclin (Champix®) und Bupropion (Zyban®) kann mit einem erhöhten Risiko für neuropsychiatrische Nebenwirkungen bis hin zu suizidalem Verhalten verbunden sein. Schon... » Weiterlesen

Geriatrische Arzneimitteltherapie
Gesellschaftliche Herausforderung und pharmazeutische Lösungsansätze Von Sven Stegemann, Norbert Rasenack, Felix Ecker und Andreas ZimmerDer Bevölkerungsanteil der älteren und hochbetagten ... » Weiterlesen

EMA bewertet Pioglitazon weiter positiv
Die Diskussion um ein erhöhtes Blasenkrebsrisiko unter dem Antidiabetikum Pioglitazon hatte zu der Empfehlung des BfArM geführt, auf Neueinstellungen mit Pioglitazon zu verzichten. Der Ausschuss fü... » Weiterlesen

Vareniclin-Nutzen größer als kardiovaskuläres Risiko
Das Raucherentwöhnungsmittel Vareniclin (Champix®) erhöht möglicherweise das kardiovaskuläre Risiko. Das hatte zumindest eine Anfang Juli publizierte Metaanalyse nahegelegt. Nun hat der Ausschuss... » Weiterlesen

EMA bewertet Raucherentwöhnungsmittel weiterhin positiv
Das Raucherentwöhnungsmittel Vareniclin (Champix®) erhöht möglicherweise das kardiovaskuläre Risiko. Das hatte zumindest eine Anfang Juli publizierte Metaanalyse nahegelegt. Nun hat der Ausschuss... » Weiterlesen

Dronedaron: EMA prüft kardiovaskuläres Risiko
Die europäische Arzneimittelagentur EMA hat angekündigt, im Rahmen einer laufenden Nutzen-Risiko-Bewertung auch das kardiovaskuläre Risiko des Antiarrhythmikums Dronedaron (Multaq®) zu überprü... » Weiterlesen

Bisphosphonate und atypische Femurfrakturen
Aufgrund von epidemiologischen Hinweisen hat die Europäische Arzneimittelagentur einen möglichen Zusammenhang von atypischen Femurfrakturen mit der Gabe von Bisphosphonaten umfassend bewertet: Das ... » Weiterlesen

Negatives Nutzen-Risiko-Verhältnis von Pioglitazon
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) sieht derzeit den begründeten Verdacht eines ungünstigen Nutzen-Risiko-Verhältnisses für den PPARγ-Agonist und rät von ... » Weiterlesen

BfArM: Nutzen-Risiko-Verhältnis für Pioglitazon negativ
Grund für die negative Einschätzung sind die seit kurzem verfügbaren Ergebnisse einer französischen Kohortenstudie. Darin wurde die Häufigkeit des Auftretens von Blasenkrebs bei Diabetikern, die ... » Weiterlesen

Protease-Inhibitor Boceprevir in den USA zugelassen
Erwartungsgemäß ist Boceprevir (Victrelis®) nach Abschluss erfolgreicher Studien von der amerikanischen Zulassungsbehörde FDA zur Behandlung der chronischen Hepatitis C jetzt zugelassen worden. ... » Weiterlesen

Rückruf für orale Buflomedil-Präparate steht bevor
Ende letzter Woche hatte die Europäische Arzneimittelagentur (EMA) im Rahmen einer Bewertung des Vasodilatators Buflomedil den Mitgliedsstaaten empfohlen, alle Präparate zur oralen Anwendung vom ... » Weiterlesen

Positive Opinion für langwirksamen GLP-1-Rezeptor-Agonisten
Das Committee for Medicinal Products for Human Use (CHMP) der europäischen Arzneimittelbehörde EMA hat für den langwirksamen GLP-1-Rezeptor-Agonisten Exenatide 1 x wöchentlich (Bydureon®) die ... » Weiterlesen




















Foto: dpa