
Thema
Committee for Medicinal Products for Human Use

Rückruf: N-Nitroso-Vareniclin in allen Champix-Chargen nachgewiesen
Es waren zunächst nur Medienberichte über eine weltweite Vertriebspause, dann Chargenrückrufe durch Importfirmen in Deutschland. Dennoch ist seit Juni klar: Auch das Raucherentwöhnungsmittel ... » Weiterlesen

Corona-Ticker
mab | Erkranken Schwangere an COVID-19, so tragen sie ein erhöhtes Risiko für einen schweren Verlauf. Aufgrund der limitierten Datenlage haben viele zuständigen Behörden bisher gezögert, eine ... » Weiterlesen

Rotes Licht für Parkinson-Arzneimittel
Aufgrund von inkonsistenten Studienergebnissen hat der Ausschuss für Humanarzneimittel CHMP der europäischen Arzneimittelbehörde kürzlich von der Zulassungsempfehlung des Parkinson-Medikaments ... » Weiterlesen

Corona-Ticker
mab | Impfstoffe gelten als wichtigstes Instrument, um der Pandemie Herr zu werden. Neben NVX-CoV2373 und Verocell befindet sich nun die dritte Protein-basierte Vakzine von Sanofi Pasteur im Rolling-... » Weiterlesen
EMA empfiehlt Moderna-Impfstoff für ab 12-Jährige
Mit Spikevax von Moderna steht bald der zweite COVID-19-Impfstoff für Kinder und Jugendliche zur Verfügung. Die EMA hat am heutigen Freitag die Zulassungserweiterung für 12- bis 17-Jährige ... » Weiterlesen
Ethinylestradiol und Co.: Diese Wirkstoffe werden heute verwendet
Heute vor 60 Jahren, am 1. Juni 1961, brachte das Berliner Pharmaunternehmen Schering mit „Anovlar“ die erste Pille auf den westdeutschen Markt. Sie war nur für verheiratete Frauen mit Erlaubnis ... » Weiterlesen

Auf der Suche nach dem idealen Kontrazeptivum
In Europa ist vor wenigen Wochen ein neues orales hormonelles Kontrazeptivum bestehend aus Estetrol und Drospirenon zur Zulassung empfohlen worden. Das auch während der Schwangerschaft natürlich ... » Weiterlesen

Grippeimpfstoffe auf mRNA-Basis?
Bei COVID-19 bewähren sich mRNA- Vakzine derzeit: schnelle Entwicklung und Herstellung, sehr gute Wirksamkeit und Verträglichkeit und die Möglichkeit eines raschen Anpassens an Varianten. Wäre das... » Weiterlesen

Tofacitinib erneut unter Verdacht
mab | Der Januskinase-Inhibitor Tofacitinib steht nicht zum ersten Mal im Fokus der Ermittlungen: Bereits 2019 und 2020 schränkten drei Rote-Hand-Briefe die Anwendung des antientzündlichen ... » Weiterlesen

Das Dilemma der SARS-CoV-2-Impfstoffbeurteilung
Impfen gilt als die beste Strategie, um die COVID-19-Pandemie zu überwinden ‒ vorausgesetzt es stehen wirksame und sehr sichere Impfstoffe zur Verfügung. Denn da Gesunde geimpft werden, hat das ... » Weiterlesen

Können orale hormonelle Kontrazeptiva sicherer werden?
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur (EMA) hat eine positive Stellungnahme für ein neues, kombiniertes orales Kontrazeptivum mit 15 mg Estetrol (E4) und 3... » Weiterlesen
Ofatumumab: erster B-Zell-Antikörper zur Eigenapplikation bei Multipler Sklerose
Ofatumumab ist der erste B-Zell-Antikörper, den sich Patienten mit schubförmiger Multipler Sklerose monatlich auch selbst subkutan verabreichen können. Die EU-Kommission hat Ofatumumab in Kesimpta ... » Weiterlesen

Neue Herstellungsvorschriften in Kraft
2018 wurden Nitrosamine wie NDEA und NDMA in Angiotensin-II-Rezeptorantagonisten und verwandten Arzneimitteln als wahrscheinliche Humankarzinogene nachgewiesen. Eine Resolution des Europarats setzte ... » Weiterlesen
Impfstoff Nummer vier
Das Impfstoffportfolio gegen COVID-19 in Europa hat Zuwachs bekommen. Am Donnerstag letzter Woche hat die EU-Kommission die zweite COVID-19-Vektorvakzine genehmigt. Damit stehen in Europa nun vier ... » Weiterlesen
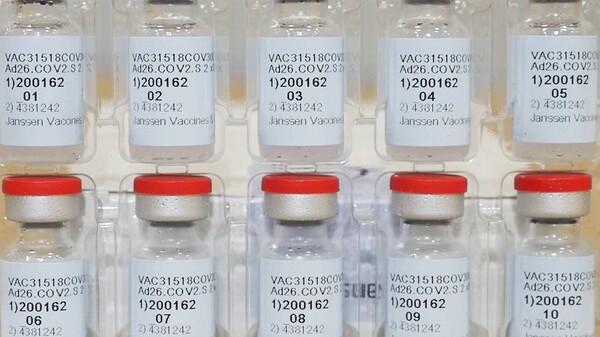
Einmalimpfstoff von Janssen erhält EU-Zulassung
Die EU-Kommission hat mit dem COVID-19-Impfstoff Janssen den vierten Corona-Impfstoff in der EU zugelassen. Der Vorteil des adenovektorbasierten Impfstoffs (Ad26.COV2.S) ist die einmalige Gabe sowie ... » Weiterlesen
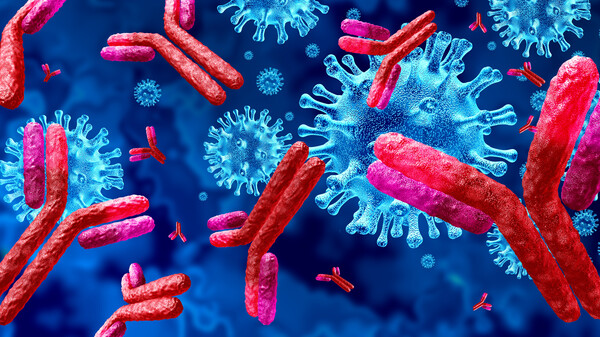
EMA startet Rolling Review für Bamlanivimab und Etesevimab
Die EMA hat ein Rolling Review für die beiden Antikörper Bamlanivimab und Etesevimab eingeleitet. Die Antikörper richten sich gegen unterschiedliche Bereiche des SARS-CoV-2-Spikeproteins, sollen ... » Weiterlesen

Weg frei für Antikörpercocktail
Die ansteckenderen Varianten des Coronavirus SARS-CoV-2 breiten sich in Deutschland rasant aus. Neben der Sorge um die Wirksamkeit der Impfstoffe treibt die Wissenschaft auch die Frage um, wie sich ... » Weiterlesen

Krebs durch Ranitidin?
Erst am 7. Januar 2021 hat das Bundesinstitut für Arzneimittel und Medizinprodukte das vorläufige Ruhen aller Zulassungen von ranitidinhaltigen Arzneimitteln bis zum 2. Januar 2023 angeordnet. ... » Weiterlesen






















Foto: dpa