
Thema: EU
Europäische Kommission

Xarelto- und Eliquis-Antidot zugelassen
Am 1. März 2019 hatte die europäische Arzneimittelbehörde EMA die Zulassung für das Apixaban- und Rivaroxaban-Antidot Andexanet alfa empfohlen. Dieser Empfehlung ist die Europäische Kommission ... » Weiterlesen
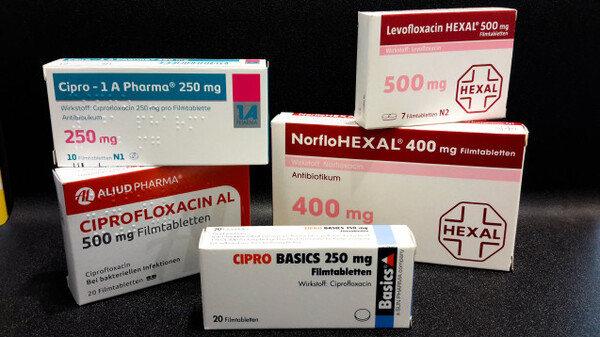
Soll man Fluorchinolone noch verordnen – und wenn ja, wann?
Mit Fluorchinolonen wurde in der Vergangenheit in der Versorgungspraxis zu leichtfertig umgegangen. Nicht für jede bislang zugelassene Indikation ist vor dem Hintergrund potenzieller Nebenwirkungen ... » Weiterlesen
Opioid-Sucht: EU-Zulassungsempfehlung für Buprenorphin-Implantat
Für stabil eingestellte Opioidabhängige könnte sich die Substitutionsbehandlung demnächst vereinfachen: Der EMA-Ausschuss für Humanarzneimittel hat die Zulassung des Buprenorphin-Implantats Sixmo... » Weiterlesen

Seqirus liefert Grippeimpfstoffe im Pandemiefall
Der Grippeimpfstoffhersteller Seqirus hat mit der Europäischen Kommission die ersten europäischen Rahmenverträge zur Bereitstellung von Influenza-Impfstoffen im Pandemiefall geschlossen. Seqirus ... » Weiterlesen
Roches Rituximab erhält EU-Zulassung bei Pemphigus Vulgaris
Die Europäische Kommission hat Mabthera® bei Pemphigus Vulgaris zugelassen. Roches Biologikum Rituximab erhält damit auch in der EU eine Zulassungserweiterung für die seltene, blasenbildende und ... » Weiterlesen

Risankizumab bei Plaque-Psoriasis
Für mittelschwere bis schwere Plaque-Psoriasis könnte bald ein neues Arzneimittel die Therapie erwachsener Schuppenflechtepatienten erweitern. Der CHMP, der Humanarzneimittelausschus der EMA, hat im... » Weiterlesen

Strengere Regeln und klare Verhältnisse für bilanzierte Diäten
Ab dem 22. Februar 2019 gilt eine spezielle europäische delegierte Verordnung, mit der die Vorgaben für Lebensmittel für besondere medizinische Zwecke (bilanzierte Diäten) verschärft werden. ... » Weiterlesen

Was sich jetzt ändert
Zum Randsortiment in Apotheken gehören auch diätetische Lebensmittel. Der Sektor wurde auf europäischer Ebene in den letzten Jahren neu geordnet. Ab dem 22. Februar 2019 gilt eine spezielle ... » Weiterlesen

Zirabev erhält EU-Zulassung
Roches Avastin® bekommt Konkurrenz: Pfizer hat die EU-Zulassung für das Bevacizumab-Biosimilar Zirabev® erhalten. Bevacizumab hemmt den VEGF (vascular epidermal growth factor) und wird unter ... » Weiterlesen

Licht und Schatten von Dapagliflozin
Mit Dapagliflozin könnte das erste orale Antidiabetikum zur Add-on-Therapie bei Diabetes mellitus Typ 1 zugelassen werden. Die entsprechende Empfehlung des Ausschusses für Humanarzneimittel (CHMP) ... » Weiterlesen

Sartane: Risikobewertungsverfahren ist abgeschlossen
Pharmazeutische Unternehmer müssen zukünftig das Vorhandensein von NDMA- oder NDEA-Verunreinigungen in Sartanen ausschließen können. Allerdings erst nach einer Übergangsfrist von zwei Jahren. So ... » Weiterlesen

Fremanezumab: Migräne-Antikörper Nummer drei
Der Humanarzneimittelausschuss der EMA empfiehlt einen weiteren Antikörper zur Migräneprophylaxe zur Zulassung. Fremanezumab – Handelsname Ajovy® – ist nach Erenumab (Aimovig®) und ... » Weiterlesen

Harmloser Hanf?
Nicht jedes Produkt aus der Hanfpflanze (Cannabis sativa L.) ist für medizinische Zwecke bestimmt. Es gibt auch Erzeugnisse auf Hanfbasis, ohne Arzneimittelstatus, die als Lebensmittel, Nahrungsergä... » Weiterlesen
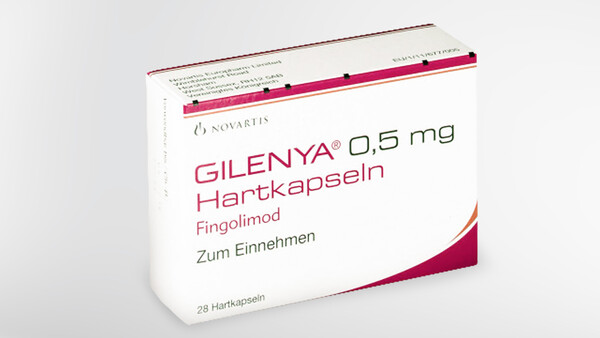
Gilenya erhält Zulassung für schubförmige MS bei Kindern
Der Markt therapeutisch zugelassener Arzneimittel bei pädiatrischen MS-Patienten ist überschaubar, vor allem bei hochaktiven Formen der multiplen Sklerose gibt es nichts. Das hat Novartis geändert... » Weiterlesen

Impfen gegen Migräne
Mit Erenumab (Aimovig®) ist ein neues Wirkprinzip zur vorbeugenden Behandlung der Migräne in den Behandlungsalltag eingezogen. Der monoklonale Antikörper bekämpft die Ursachen des Migrä... » Weiterlesen
Erste orale Therapie der Schlafkrankheit
Der Humanarzneimittelausschuss der EMA (CHMP) empfiehlt Fexinidazol zur Zulassung. Das Besondere: Fexinidazol von Sanofi ist das erste Arzneimittel, das oral und in beiden Stadien der durch ... » Weiterlesen
Galcanezumab: neuer Antikörper bei Migräne
Der Humanarzneimittelausschuss der EMA hat einen weiteren Antikörper bei episodischer und chronischer Migräne zur Zulassung empfohlen. Galcanezumab ist bereits der zweite CGRP-Antikörper, der zur ... » Weiterlesen
Wie findet der G-BA Ocrelizumab?
Mit Ocrelizumab, Ocrevus®, will Roche die Therapie der multiplen Sklerose revolutionieren. Es ist das erste Arzneimittel, das sowohl für die schubförmige multiple Sklerose (RMS), als auch für die ... » Weiterlesen

Präzisionswaffen zugelassen
cst | Mit der Zulassung von Tisagenlecleucel (Kymriah®) und Axicabtagen Ciloleucel (Yescarta®) durch die Europäische Kommission könnte eine Behandlung mit den Gentherapien bei bestimmten hä... » Weiterlesen

Gentherapie bei Leukämie: Novartis erhält EU-Zulassung für Kymriah
Am heutigen Montag hat die Europäische Kommission Kymriah® zur Behandlung der Leukämieformen ALL und DLBCL zugelassen. Bei der Gentherapie von Novartis handelt es sich um die erste CAR-T-Zell-... » Weiterlesen

EU genehmigt Phoenix Übernahme von Farmexim und Help Net
Die Übernahme der rumänischen Unternehmen Farmexim und Help Net Farma durch den Mannheimer Pharmahändler Phoenix Group ist endgültig in trockenen Tüchern: Die EU-Kommission hat ihre Zustimmung zu... » Weiterlesen
Tildrakizumab in der EU zur Zulassung empfohlen
16 Monate hat es gedauert, bis der CHMP Tildrakizumab von Almirall zur Zulassung empfohlen hat. Der Interleukin-23-Antikörper in Ilumetri® soll bei erwachsenen Patienten zur Behandlung ... » Weiterlesen

Orale Retinoide erhalten Warnbox
Das Risikobewertungsverfahren zu Retinoiden ist abgeschlossen, das BfArM setzt nun den Bescheid der Europäischen Kommission mit hoffentlich effektiveren Maßnahmen zur Schwangerschaftsverhütung um. ... » Weiterlesen






















Foto: finecki / Fotolia