
Thema
Zulassungsbehörde
USA: Tamiflu soll rezeptfrei werden
Das Grippemittel Tamiflu von Roche mit dem Neuraminidasehemmer Oseltamivir soll in den USA zukünftig von dem französischen Pharmaunternehmen Sanofi als OTC-Arzneimittel vertrieben werden. Hierzu ... » Weiterlesen

Genitale Taubheit nach SSRI und SNRI
rr | Die Gebrauchsinformationen von Serotonin-Noradrenalin-Wiederaufnahmehemmern (SNRI) und selektiven Serotonin-Wiederaufnahmehemmern (SSRI) warnen schon lange vor sexuellen Störungen während der ... » Weiterlesen

Makulopathie unter Pentosanpolysulfat
cel | Unter Pentosanpolysulfat-Natrium (Elmiron®) wurde in seltenen Fällen die potenziell irreversible Nebenwirkung einer pigmentären Makulopathie beobachtet. Davor warnt jetzt ein Rote-Hand-Brief » Weiterlesen
Isotretinoin: Hunderte Schwangerschaften trotz Verhütungsprogramm
Isotretinoin ist teratogen. Deshalb gelten nicht nur in Deutschland besondere Auflagen bei der Verordnung für Frauen im gebärfähigen Alter. Erst vor etwa einem Jahr hatte die Europäische ... » Weiterlesen

Postpartale Depression: Wenn trotz Baby die Freude ausbleibt
Pharmakotherapie in Schwangerschaft und Stillzeit: Welche Antidepressiva eignen sich bei einer postpartalen Depression, welche Tipps zum Stillabstand können Apotheker stillenden Müttern unter ... » Weiterlesen
Pigmentäre Makulopathie unter Elmiron
Unter Pentosanpolysulfat-Natrium wurde in seltenen Fällen die potenziell irreversible Nebenwirkung einer pigmentären Makulopathie beobachtet. Elmiron erhalten Patienten mit interstitieller Zystitis ... » Weiterlesen

Tetrazepam: Zulassung ruht weiter
Das Bundesinstitut für Arzneimittel und Medizinprodukte informiert, dass die Zulassung tetrazepamhaltiger Arzneimittel für weitere zwei Jahre ruht. Seit 2013 gibt es das Benzodiazepin nicht mehr zur... » Weiterlesen

Wöchentliche MTX-Tabletten nur noch im Blister
Der Pharmakovigilanzausschuss (PRAC) der EMA hat seit einiger Zeit ein Auge auf Methotrexat. Der Grund: Schwere Überdosierungen, da manche Patienten MTX fälschlicherweise täglich, statt nur wö... » Weiterlesen

EU und USA setzen auf Zusammenarbeit im Arzneimittelsektor
Die EU und die USA haben ihr Abkommen über die gegenseitige Anerkennung von Inspektionen im Arzneimittelsektor seit vergangenem Freitag vollständig umgesetzt. Wie die EU-Kommission mitteilt, können... » Weiterlesen
England droht ein neuer Arzneimittelimport-Skandal
Erneut deutet sich in Europa ein Skandal mit importierten Arzneimitteln an. Die britische Arzneimittelbehörde MHRA ruft derzeit drei Arzneimittel zurück, die von einem Händler aus Italien ... » Weiterlesen

(Un-)Gesunde Industriepolitik – der nächste Arzneimittelskandal?
Es gibt durchaus gesundes Gewinnstreben – doch in manchen Fällen kann es einseitig werden und zulasten von Patienten gehen. Bei den Haltbarkeitsangaben applikationsfertiger parenteraler ... » Weiterlesen
Vorerst kein Romosozumab in der EU
Der Humanarzneimittelausschuss der EMA, CHMP, spricht sich gegen die EU-Zulassung von Romosozumab aus. Der Sclerostin-Antikörper zur Behandlung von Osteoporose senkte in den Studien FRAME und ARCH ... » Weiterlesen

FDA lässt Bremelanotid bei sexueller Unlust zu
Frauen mit geringer Libido soll Bremelanotid zu einem befriedigenden Sexualleben verhelfen. Die FDA hat Vyleesi, einen Melanocortinrezeptor-Agonisten, für prämenopausale Frauen mit geringer Libido ... » Weiterlesen

Phagro: Gleiche Bedingungen für alle!
ks | Im Referentenentwurf für das Gesetz zur Stärkung der Vor-Ort-Apotheken ist vorgesehen, dass künftig für Arzneimittel, die im Botendienst und im Versandhandel ausgeliefert werden, eine Pflicht... » Weiterlesen

Febuxostat nicht bei kardiovaskulärem Risiko
Gichtpatienten mit schweren kardiovaskulären Erkrankungen wie Myokardinfarkt, Schlaganfall oder Angina pectoris sollten nicht mit Febuxostat (Adenuric und Generika) behandelt werden. Laut der CARES-... » Weiterlesen

Sind 75 Prozent der rezeptfreien Arzneimittel geeignet?
„Nie mehr unvorbereitet in die Apotheke“ wirbt Stiftung Warentest für ihre Datenbank „Medikamente im Test“. Neu ist die Medikamentenberatung der Verbraucherschützer nicht, von Zeit zu Zeit ... » Weiterlesen
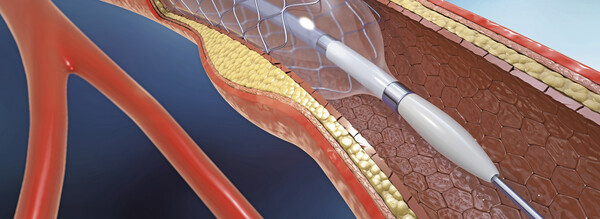
Reumütig zurück zum reinen Metallstent?
Sobald die periphere arterielle Verschlusskrankheit (PAVK) das Stadium der kritischen Extremitätenischämie erreicht, sollte so rasch wie möglich eine arterielle Revaskularisation erfolgen. Dies ist... » Weiterlesen

FDA warnt vor Infektionsrisiko durch Stuhltransplantation
Laut einem Bericht der US-Aufsichtsbehörde FDA sind durch Stuhltransplantationen multiresistente Bakterien übertragen worden. Zwei Empfänger haben demnach invasive bakterielle Infektionen ... » Weiterlesen





















Foto: Imago