
Thema
Zulassungsbehörde
Loperamid-Missbrauch hält an
Die FDA warnt erneut vor schweren Nebenwirkungen unter Loperamid. Bereits 2016 wies die Arzneimittelbehörde auf teils tödliche Herzprobleme unter dem Antidiarrhoikum hin. Doch: Nach wie vor nehmen ... » Weiterlesen

Antimykotikum wird zum Orphan Drug
Von Christina Keksel und Niels Eckstein | Die Geschichte des Wirkstoffs Ketoconazol zeigt eindrucksvoll, wie sich der Zulassungsstatus eines Arzneimittels ändern kann: Als Breitspektrum-Antimykotikum... » Weiterlesen

Roche erhält Breakthrough-Status für Balovaptan
Der Pharmakonzern Roche hat von der US-Gesundheitsbehörde FDA den „Breakthrough“-Status für das orale Arzneimittel Balovaptan erhalten. Balovaptan habe das Potenzial, die erste Pharmakotherapie ... » Weiterlesen
Alternative zum Lebendimpfstoff gegen Gürtelrose
Der Humanarzneimittelauschuss der EMA CHMP hat sich für die Zulassung eines Impfstoffes gegen Herpes Zoster ausgesprochen. Im Gegensatz zum bisher verfügbaren – Zostavax® – handelt es sich ... » Weiterlesen

Weiteres Lantus-Biosimilar kurz vor der EU-Zulassung
Sanofis Basalinsulin Lantus® bekommt noch mehr Konkurrenz. Der Humanarzneimittelausschuss der EMA hat nämlich ein weiteres Biosimilar zur Zulassung empfohlen. Diesmal ist es die Firma Mylan, die ein... » Weiterlesen

Zulassungsempfehlung für weiteren SGLT-2-Inhibitor
Der Humanarzneimittelausschuss der EMA hat mit Ertugliflozin einen weiteren Wirkstoff aus der Gruppe der Gliflozine zur Behandlung des Typ-II-Diabetes zur Zulassung empfohlen – und zwar als ... » Weiterlesen
Werbender Facebook-Post für Rx-Arznei kann zulässig sein
Für verschreibungspflichtige Arzneimittel darf in Deutschland nur in den Fachkreisen geworben werden, nicht aber in der allgemeinen Öffentlichkeit. Doch wie sieht es aus, wenn ein Hersteller auf ... » Weiterlesen

Die „Gefloxten“
Von Rika Rausch | Das sollte man Patienten bei der Abgabe von Fluorchinolonen mindestens mit auf den Weg geben: die Tabletten immer zur gleichen Zeit einnehmen, Abstand halten zu Eisen- und ... » Weiterlesen

Stimmt die Nutzen-Risiko-Bilanz noch?
rr | Fluorchinolone bilden unter Antibiotika die viertstärkste Verordnungsgruppe nach Betalactamen, Makroliden und Tetracyclinen. Nicht zuletzt haben sie diese Spitzenposition ihrem breiten ... » Weiterlesen

Onkologika ohne Nutzen?
Ende letzten Jahres erschien im British Medical Journal eine vielbeachtete Studie, die sich mit dem klinischen und Patienten-bezogenen Nutzen neuer Onkologika befasste. Ihr Fazit: Bei knapp der Hä... » Weiterlesen

Die Wahl: Rheumaklinik oder Psychiatrie
rr | Die Indikationen der Fluorchinolone wurden in den vergangenen Jahren gehörig gestutzt. Die US-amerikanische Arzneimittelbehörde FDA hält Ärzte dazu an, Ciprofloxacin und Co. restriktiver zu ... » Weiterlesen

EMA befragt Pharmafirmen zu Brexit-Vorbereitungen
Für die Europäische Arzneimittelagentur EMA stellt der Ausstieg Großbritanniens aus der EU einen erheblichen Einschnitt dar: Sie muss nicht nur umziehen, sondern womöglich werden hunderte ... » Weiterlesen

Welche Arzneimittel 2018 aus dem Patent laufen
In diesem Jahr laufen nach Information der Arbeitsgemeinschaft Pro Biosimilars mehrere Arzneimittel-Patente aus, hinter denen in Deutschland ein Umsatzpotenzial von insgesamt 1.324 Millionen Euro ... » Weiterlesen

Bei ADHS geht es nicht nur um Symptomlinderung
ADHS-Symptome, also Hyperaktivität, Impulsivität und leichte Ablenkbarkeit, lassen sich heutzutage mit Arzneimitteln gut in den Griff bekommen. Mit Guanfacin gibt es seit kurzem auch noch eine ... » Weiterlesen

Ausweglos erkrankt?
Schmerz verfolgt Patienten mit Fibromyalgiesyndrom Tag und Nacht. Gerade nachts, wenn sich Betroffene Schlaf und Erholung wünschen, kommen sie nicht zur Ruhe und erfahren mit großer Regelmäßigkeit... » Weiterlesen
Beschleunigtes Zulassungsverfahren für Novartis-Gentherapie
Die US-Arzneimittelbehörde FDA will die Zulassungserweiterung für die Gentherapie Kymriah® vom Schweizer Pharmakonzern Novartis beschleunigen. Kymriah® soll auch zur Behandlung des diffusen groß... » Weiterlesen

Janssen Cilag ergänzt Rote-Hand-Brief zu Haldol
Die geänderten Produktinformationen zu den Haldol®-Präparaten haben für Redebedarf gesorgt. Deshalb hat Janssen Cilag nun ein ergänzendes Informationenschreiben zum jüngst erschienen Rote-Hand-... » Weiterlesen

850.000 Dollar für Luxturna
ts | Nachdem die US-amerikanische Food and Drug Administration (FDA) im Dezember die Gentherapie Luxturna von Spark Therapeutics zur Behandlung einer seltenen Augenerkrankung zugelassen hatte, wurde ... » Weiterlesen
HES-Zulassungen sollen ausgesetzt werden
Der Pharmakovigilanzausschuss der EMA (PRAC) hat empfohlen, die Zulassungen aller Arzneimittel, die Hydroxyethylstärke enthalten, ruhen zu lassen. Die im Jahr 2013 eingeführten Anwendungsbeschrä... » Weiterlesen
Neue Empfehlungen für Gadoliniumhaltige Kontrastmittel
Nach neuen Erkenntnissen der europäischen Arzneimittel Agentur (EMA) können sich nach Anwendung Gadolinium-haltiger Kontrastmittel geringe Mengen des Elements im Gehirn ablagern. Auch wenn bisher ... » Weiterlesen
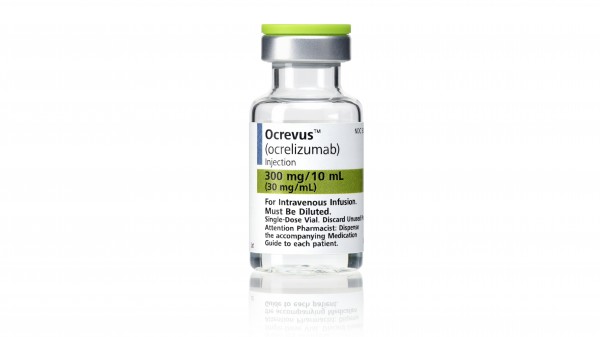
MS-Antikörper Ocrelizumab erhält EU-Zulassung
Die EU-Kommission hat Ocrelizumab die Zulassung erteilt. Damit steht mit dem Arzneimittel mit dem Handelsnamen Ocrevus® erstmalig eine zugelassene Therapieoption bei primär progredienter multipler ... » Weiterlesen


















Foto: Imago