
- DAZ.online
- DAZ / AZ
- DAZ 45/2011dsetd
- Innovationen in der ...
Gentherapie
Innovationen in der Gentherapie
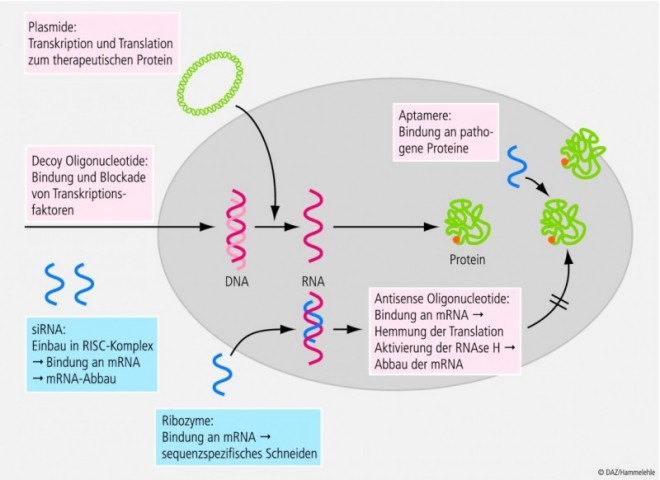
Die ursprüngliche Intention eines genetisch orientierten Therapieansatzes war der Transfer einer intakten Kopie eines Gens zur Substitution eines genetischen Defekts ("gene replacement"), z. B. bei der Mukoviszidose oder Morbus Gaucher. Während für diese Therapieoptionen hochmolekulare Plasmid-DNA Anwendung findet, werden für den gegenläufigen Ansatz der gezielten Hemmung von Transkription und Translation unerwünschter Gene ("gene knockdown") bevorzugt kurzkettige DNA-Oligonucleotide (Antisense, Decoys, Aptamere) und RNA-basierte Verbindungen (Ribozyme, siRNA, mRNA, microRNA) eingesetzt. Weitere DNA- und RNA-basierte Wirkprinzipien sind hinzugekommen (Abb. 1).
Nucleinsäuren als Wirkstoffe – eine technologische Herausforderung
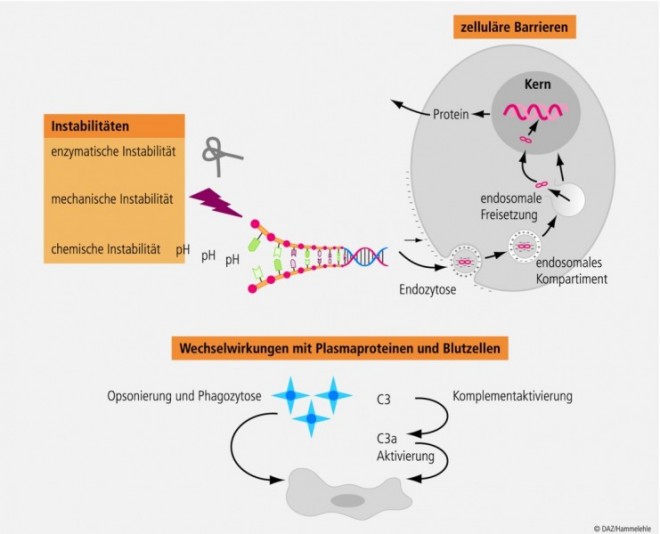
Allen Nucleinsäuren gemeinsam sind zum einen physikalische und chemische Instabilitäten, die bei der Lagerung, Verpackung in Trägersysteme sowie beim Transport im Organismus eine Rolle spielen. Zum anderen müssen sie verschiedene biologische Barrieren überwinden, um erfolgreich die Transkription oder Translation von Proteinen beeinflussen zu können. Generell lassen sich die Probleme bei der Anwendung von DNA/RNA in drei Punkten zusammenfassen (Abb. 2):
eine unzureichende Stabilität und damit schnelle Metabolisierung und Ausscheidung,
eine geringe Permeabilität über biologische Membranen sowie
eine geringe Effizienz, die teilweise hohe Dosen notwendig macht.
Die Effizienz der Nucleinsäuren hängt von einer intakten Sequenz ab. Physikalische Einflüsse wie mechanische Belastung, Ultraschallbehandlung, Scherkräfte durch Schütteln oder Rühren z. B. bei der Herstellung von Zubereitungen können zu Strangbrüchen führen, die die Wirksamkeit der Nucleinsäuren beeinträchtigen. Nach einem Strangbruch besitzen Plasmide mit offener zirkulärer Form nur noch 90%, lineare Plasmide sogar nur noch 10% der Transfektionseffizienz des Supercoiled-Plasmids. Eine Ultraschallbehandlung zerstört ungeschützte DNA innerhalb von etwa 10 bis 30 Sekunden. Chemische Abbaureaktionen wie Hydrolyse, Oxidationen, Photodegradation sowie Spaltung durch körpereigene Nucleasen bzw. Ribonucleasen sind häufige Ursachen der Destabilisierung von Nucleinsäuren. Zwar können diese Prozesse durch Lagerung bei niedrigen Temperaturen oder durch Einfrieren reduziert werden, aber das Einfrieren (z. B. bei Lyophilisation) kann per se zu Strangbrüchen und Aggregation führen.
Nach systemischer Applikation werden Nucleinsäuren rasch aus der Blutbahn entfernt (Halbwertszeiten für DNA ca. 5 min, für RNA < 6 s). Dies geschieht durch
die Degradation durch Nucleasen,
die Opsonierung mit Plasmaproteinen,
Phagozytose und
rasche hepatische oder renale Elimination.
Hat die Nucleinsäure "ihre" Zielzelle gefunden, so muss sie die Zellmembran durchdringen, um in die Zelle aufgenommen zu werden. Dies wird durch die teilweise hohe Molekularmasse (z. B. Plasmide), die Hydrophilie der Nucleinsäuren sowie ihre negative Ladung und die daraus resultierende Abstoßung von der ebenfalls negativ geladenen Zellmembran erschwert. Erfolgt eine endozytotische Aufnahme in die Zellen, so werden DNA und RNA durch Nucleasen im endosomalen Kompartiment degradiert und kaum in das Zytoplasma freigesetzt. Die Rate, mit der freie Plasmid-DNA in den Zellkern aufgenommen wird, ist ebenfalls gering und liegt bei 1:1000.
Geeignete Transportsysteme müssen daher eine Vielzahl von Aufgaben auf dem Weg der DNA/RNA in die Zelle erfüllen. Dazu gehören
der Schutz der Nucleinsäuren in der Blutbahn,
die effiziente Aufnahme in die Zielzellen,
die Freisetzung aus dem endosomalen Kompartiment und
der zielgerichteter Transport zum Wirkort (in der Regel der Zellkern).
Lösungsansatz: Verpackung in nichtviralen Vektoren
Zur Übertragung der Nucleinsäuren sind daher Systeme notwendig, die die Nucleinsäuren zielgerichtet, sicher und effizient in Zellen einschleusen können. Da Viren von Natur aus in der Lage sind, genetisches Material in Wirtszellen einzubringen und zu vermehren, sind sie derzeit die am intensivsten untersuchten und auch in klinischen Studien am häufigsten genutzten Vehikel zum Gentransfer (sog. Transduktion). Obwohl sie die höchsten Transferraten erzielen, weisen sie eine Reihe von Nachteilen auf wie aufwendige Herstellung, inflammatorische und immunogene Eigenschaften (insbesondere bei wiederholter Anwendung), Gefahr der Mutagenese und Rekombination mit dem Wildtyp-Virus sowie die Aktivierung von Onkogenen oder die Inaktivierung von Tumor-Suppressorgenen, die eine In-vivo-Anwendung limitieren können.
Diese Nachteile stimulierten die Suche nach nichtviralen Vektoren, bei denen Nucleinsäuren mittels verschiedener natürlicher und synthetischer Trägermaterialien in Zellen eingeschleust werden (sog. Transfektion). Die sogenannten chemischen Transfersysteme lassen sich einteilen in polymerbasierte und lipidbasierte Systeme (Polyplexe bzw. Lipoplexe) sowie anorganische und organische Nanopartikel oder Kombinationen von beiden (s. Textkasten). Sie basieren in der Regel auf polykationischen Verbindungen und Partikeln, die spontan über elektrostatische Wechselwirkungen die negativ geladenen Nucleinsäuren binden, zu nanopartikulären und damit gut zellgängigen Einheiten kondensieren und positivieren können. Ihre Vorteile sind die vielfältigen und gezielt steuerbaren Möglichkeiten zur Strukturvariation, die steuerbare Herstellung, vergleichweise einfache Charakterisierung, kontrollierte Wirkstofffreigabe und bessere Verträglichkeit und geringere Immunogenität im Vergleich zu viralen Vektoren. Allerdings erreichen bisher nur wenige Vertreter die Effizienz der viralen Systeme.
Chemische Transfersysteme für DNA und RNAPolymere Polyethylenimin Poly-L -Lysin Polymethacrylate Polyamidoamine Polyaminoester Chitosan Cyclodextrine Dextrane Schizophyllan Polyglycoamidoamine Protamin Spermin Spermidin Dendrimere Nanopartikel Kohlenstoffröhren Quantum Dots Goldnanopartikel Silicatnanopartikel Eisenoxidnanopartikel Feste Lipidnanopartikel (SLN) Lipide DOTMA: (N-[1-(2,3-dioleyloxy)propyl]-N,N,N-trimethylammoniumchlorid DOTAP: 1,2-dioleoyl-3-trimethylammoniumpropan DOGS: Dioctadecylamidoglycylspermin DC-Chol: 3β-[N-(N‘,N‘-dimethylaminoethan)-carbamoyl]cholesterol |
Lipide zur Transfektion bestehen aus einer einfach oder mehrfach positiv geladenen Kopfgruppe (meist Polyamine oder quartäre Ammoniumsalze), die über einen Linker mit Fettsäureresten, Alkylresten oder Cholesterolderivaten kovalent verknüpft sind. Der Linker trägt je nach chemischer Struktur (Ether, Ester, Carbamate, Amide) zur In-vivo- und Lagerstabilität sowie zur Bioabbaubarkeit bei.
Die Strukturen der kationischen Polymere können sehr unterschiedlich sein. Neben natürlichen Vertretern wie Protamin, Chitosan, Spermin und Spermidin, Histonen und kationisierten Derivaten wie Albumin, Dextranen und Polyaminosäuren werden vor allem synthetische Verbindungen (z. B. Polyethylenimin, Polymethacrylate, Polyaminoester) mit systematisch modifizierten Strukturen verwendet.
Anorganische Nanopartikel aus Silicaten, Eisenoxiden, Gold oder Kohlenstoff werden nach Kationisierung durch Oberflächenmodifikation als nichtvirale Vektoren eingesetzt.
Obwohl die Art und Architektur dieser Systeme sehr unterschiedlich sein kann, wurden seit den 1990er Jahren in zahlreichen Studien zu Struktur-Aktivitäts-Beziehungen einige Strukturmerkmale identifiziert, die für einen effizienten Transport von Nucleinsäuren mit guter Verträglichkeit für alle Vektoren entscheidend sind. Hochmolekulare Verbindungen mit einer großen Zahl von Ladungen und hoher Ladungsdichte erwiesen sich als besonders effizient bei der elektrostatischen Wechselwirkung mit DNA/RNA und bildeten nanopartikuläre, kompakte, nucleasestabile Komplexe. Je flexibler die dreidimensionale Struktur dieser Moleküle ist, umso effizienter können sie sich an die Polyanionen anlagern und mit ihnen interagieren. Allerdings ist zu berücksichtigen, dass zu intensive Wechselwirkungen die Freisetzung der Nucleinsäuren aus den Komplexen auch behindern können, d. h. dass eine exakte Steuerung dieser Wechselwirkung notwendig ist.
Da auch viele biologische Systeme wie Zellmembranen, Plasmaproteine und Blutzellen negativ geladen sind, gilt für die Interaktionen der Polykationen mit diesen Strukturen genau das Gleiche. Schädigung der Zellmembranen, Hemmung der metabolischen Aktivität, Hämolyse und Erythrozytenaggregation, Komplementaktivierung sowie im Extremfall nekrotischer oder apoptotischer Zelltod können die unerwünschten Folgen sein. Als "Ladungs-Dilemma" lässt sich dieser Effekt bezeichnen, bei dem die vorteilhaften Effekte der Wechselwirkung mit DNA/RNA gleichzeitig zu unerwünschten Effekten im biologischen System führen. Auswege aus diesem Dilemma liefert auch hier wieder der Blick in die Natur.
Funktionalisierung nichtviraler Vektoren: Ein Blick in die Natur
Nichtionische, hydrophile Polymere wie z. B. Polyethylenglykol, Polyoxazoline, Polyglycerol oder Polyhydroxypropylmethacrylate funktionieren als sogenannte Stealth- oder Tarnkappen-Polymere, wenn sie auf die Oberfläche von nichtviralen Vektoren aufgebracht werden. Sie schirmen die kationische Ladung ab und verhindern damit die Opsonierung durch Plasmaproteine und rasche Clearance, sie verlängern die Zirkulationshalbwertszeit und reduzieren die Immunogenität, Hämotoxizität und Zytotoxizität. Zusätzliche Effekte sind eine bessere Wasserlöslichkeit und höhere Lagerungsstabilität der Partikel. Nachteilig ist allerdings, dass auch die Interaktionen mit den Zielzellen reduziert werden können. Abhilfe kann hier eine zusätzliche Funktionalisierung schaffen: das zell- oder gewebespezifisches Targeting, d. h. eine Zielsteuerung. Antikörper gegen Rezeptoren [z. B. epidermal growth factor receptor (EGFR) oder human epidermal growth factor receptor 2 (HER-2)], Wachstumsfaktoren [z. B. EGF, fibroblast growth factor (FGF)], Vitamine (Folsäure), Kohlenhydrate (Galaktose, Mannose), Transferrin, Lektine und Integrine steuern selektiv die Erkennung von Zielzellen sowie eine selektive und effiziente Aufnahme, meist mittels rezeptorvermittelter Endozytose in die Zellen.
Zellpenetrierende Peptide (cell penetrating peptides, protein transduction domains), basierend auf Lysin-reichen Peptiden (z. B. Transportan) oder Arginin-reichen Peptiden [z. B. HIV-1 transaktivierender transkriptioneller Aktivator (TAT)], sind in der Lage, Partikel mit dem Vielfachen ihrer eigenen Größe und Molmasse in Zellen direkt in das Zytoplasma unter Umgehung einer endosomalen Aufnahme einzuschleppen. Alternativ können hydrophobe Reste (z. B. Alkylketten, steroidale Reste, hydrophobe Aminosäuren) kovalent an die Komplexe gebunden werden, eine erhöhte Wechselwirkung mit den lipophilen Zellmembranbestandteilen möglich machen und durch Erhöhung der zellunspezifischen Aufnahme die Transfektionsrate steigern.
Die größte Barriere stellt die Freisetzung der nichtviralen Vektoren aus den Endosomen dar. Für Lipoplexe wurde die Membranfusion beschrieben. Helferlipide (v. a. Phosphatidylethanolamin) in den Lipidlayern induzieren nach Wechselwirkung der kationischen Lipoplexe mit den negativen Endosomenmembranen hexagonale Strukturen, die auch bei physiologischen Membranfusionsprozessen auftreten und zur Fusion zwischen Lipoplex und Endosom führen (fusogene Agenzien). Durch Fusionsporen kann die DNA/RNA, eingehüllt von Lipiden, in das Zytosol freigesetzt werden. Polyplexe nutzen oftmals den sogenannten Protonenschwammeffekt aus (lysosomotrope Agenzien). Aufgrund der verschiedenen Aminofunktionen weisen einige Polykationen wie z. B. Polyethylenimin eine Pufferkapazität auf, die zu einer Anreicherung von Protonen im Endosom führt. Aufgrund der Elektroneutralität und osmotischer Effekte folgen ein passiver Einstrom von Chloridionen und Wasser sowie eine Erhöhung des osmotischen Drucks; daraus resultiert das Platzen der Endosomen und die Freisetzung der Polyplexe in das Zytoplasma. Fusogene Peptide wie GALA, KALA oder der N-Terminus der Hämagglutinin-Untereinheit HA-2 des Influenzavirus erfahren, kovalent an Komplexe gebunden, aufgrund der pH-Wert-Änderung in den Endosomen eine Veränderung ihrer dreidimensionalen Struktur, was eine Wechselwirkung mit den Endosomenmembranen möglich macht und zu Membranporen, zur Fusion oder zur Membranlyse führt. Photosensitizer, die selektiv in Endosomen akkumulieren, können nach Photoaktivierung die Freisetzung von Komplexen aus Endosomen bewerkstelligen.
Der Einbau hydrolytisch oder enzymatisch spaltbarer Gruppen wie Disulfide, Ester, Amide, Imine oder Diacrylate garantiert, dass die Vektoren zu niedermolekularen Verbindungen abgebaut werden, die rasch ausgeschieden werden können; dies vermeidet eine unerwünschte, gegebenenfalls toxikologisch bedenkliche Anreicherung im Organismus.
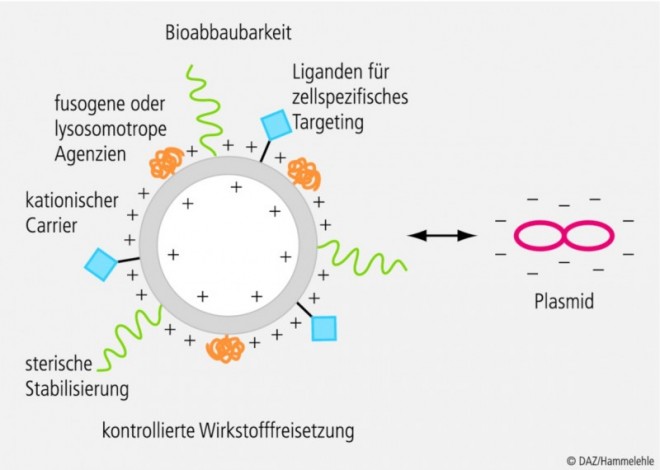
Um die Vielzahl an blut- und zellbasierten Hindernisse zu überwinden, werden oftmals verschiedene Strategien gleichzeitig in einem Vektor kombiniert (sog. multifunktionale Vektoren; siehe Abb. 3), was die Herstellung und Charakterisierung aufwendig macht. Fassen wir zusammen:
Das gewählte Trägermaterial mit all seinen Modifikationen sollte die Formulierung der DNA/RNA in eine stabile, lagerbare, einfach und sicher applizierbare Arzneiform ermöglichen.
Es sollte großtechnisch herstellbar sein, und
es sollte im Organismus mit einer geeigneten Pharmakokinetik die Nucleinsäuren geschützt und gezielt an ihren Wirkort transportieren.
Individuelle und großtechnische Herstellung nichtviraler Vektoren
Die Herstellung von Poly- und Lipoplexen wird bisher meist individuell im Labormaßstab (µg bis mg) durchgeführt. Dazu werden DNA/RNA und Polymer, Nanopartikel bzw. Lipid jeweils separat in einem geeigneten, physiologisch verträglichen Medium (z. B. 5% Glucoselösung, 0,9% Natriumchloridlösung) verdünnt und anschließend durch mehrmaliges Auf- und Abpipettieren oder mit Hochgeschwindigkeitstechniken (z. B. Schüttler, Vortexer) miteinander gemischt. Nach einer Inkubationszeit von 10 bis 30 Minuten, in denen die Komponenten elektrostatisch miteinander wechselwirken und sich die endgültigen Komplexstrukturen ausbilden, können die Komplexe zur Transfektion der Zellen verwendet werden. Gesteuert werden können die Eigenschaften der resultierenden Nanopartikel über die Auswahl des Mischungsmediums (Ionenstärke und pH-Wert), das Ansatzverhältnis (N/P-Verhältnis) sowie die DNA/RNA-Konzentration.
Der pH-Wert determiniert die Zahl der reaktionsfähigen Ladungen bei Trägermaterialien mit primären, sekundären oder tertiären Aminogruppen. So liegt beispielsweise verzweigtes Polyethylenimin bei pH 7,4 zu ca. 20%, bei pH 5 zu ca. 45% protoniert vor. Je höher die Ionenstärke des Herstellungsmediums, umso größer sind in der Regel die resultierenden Komplexe.
Das N/P-Verhältnis ist definiert als das Verhältnis der kationischen Ladung (Stickstoff des Trägermaterials) zur anionischen Ladung (Phosphat der Nucleinsäuren) und repräsentiert die Komplexzusammensetzung. Das N/P-Verhältnis für optimale Transfektionseigenschaften variiert bei den einzelnen Trägermaterialien. Komplexe mit N/P = 1 sind meist neutral, wenig kompakt und kaum stabil gegen enzymatische Angriffe. Erst bei einem deutlichen Überschuss kationischer Ladungen (N/P >1) entstehen kondensierte, stabile Partikel. Mit dem N/P-Verhältnis wächst allerdings die Gefahr, dass freies, nicht im Komplex gebundenes Trägermaterial vorliegt, welches meist größere toxikologische Effekte zeigt als die Partikel selbst.
Schwachpunkt der eigentlich auf den ersten Blick sehr einfach anmutenden Herstellung sind jedoch die Limitierung des Verfahrens auf relativ kleine Volumina und die ungenügende Reproduzierbarkeit und Kontrolle der Komplexeigenschaften. Daher wurden verschiedene Ansätze entwickelt, die eine reproduzierbare und automatisierbare Herstellung auch im Großmaßstab ermöglichen sollen. Dazu werden Nucleinsäure und Trägermaterial getrennt im geeigneten Medium in einem Vorratsbehälter, z. B. in einer Spritze, gelöst oder dispergiert und mittels einer Pumpe mit kontinuierlicher Flussrate über ein Y- oder T-Stück bei konstanten und steuerbaren Druckverhältnissen gemischt und automatisiert in Abgabebehältnisse abgefüllt. Bei Verwendung des kationischen Polymers Polyethylenimin führte eine Erhöhung der Mischgeschwindigkeit, die über die Größe der Spritze und die Flussrate der Pumpe gesteuert werden kann, dabei zu einer Verringerung der Partikelgröße und der Polydispersität. Umgekehrt konnten mit einer Erhöhung der DNA-Konzentration Komplexgröße und Breite der Verteilung gesteigert werden. Eine Herstellung unter aseptischen Bedingungen ist mit dieser Technik möglich.
Die Anwendung eines solchen Verfahrens setzt voraus, dass die hergestellten Komplexe während der Lagerung bis zur Anwendung am Patienten stabil sind, was für viele Trägersysteme bisher noch nicht realisiert werden konnte. Viele Komplexe werden aufgrund ihrer Aggregationsneigung in wässrigen Medien immer noch unmittelbar vor der Applikation frisch hergestellt, was im Hinblick auf eine klinische Anwendung und der möglichen Chargenvariabilität Risiken für die Sicherheit des Patienten birgt. Eine Qualitätskontrolle des Endproduktes ist in einem solchen Fall kaum möglich. Neben der oben genannten PEGylierung von Komplexen, die zu einer Stabilisierung während der Lagerung durch sterische Abschirmung der Partikeloberflächen führt, kann die Lyophilisation von Komplexen Abhilfe schaffen. Um die Bildung irreversibler Aggregate und durch den Einfrier- und Trocknungsstress bedingte Veränderungen der Nucleinsäuren zu vermeiden und die Transfektionsfähigkeit aufrecht zu erhalten, werden dabei Kryoprotektoren wie Monosaccharide (Glucose), Disaccharide (Sucrose, Trehalose), Oligosaccharide (Inulin, Isomaltrotriose) oder Polysaccharide und Polymere (Polyvinylpyrrolidon, hochmolekulare Dextrane, Hydroxyethylstärke) den Komplexen zugesetzt. Welcher Zusatz in welchem Ansatzverhältnis von Protektor zu Komplex verwendet wird, muss im jeweiligen Einzelfall experimentell geprüft werden.
Charakterisierung der Komplexe zur Qualitätssicherung
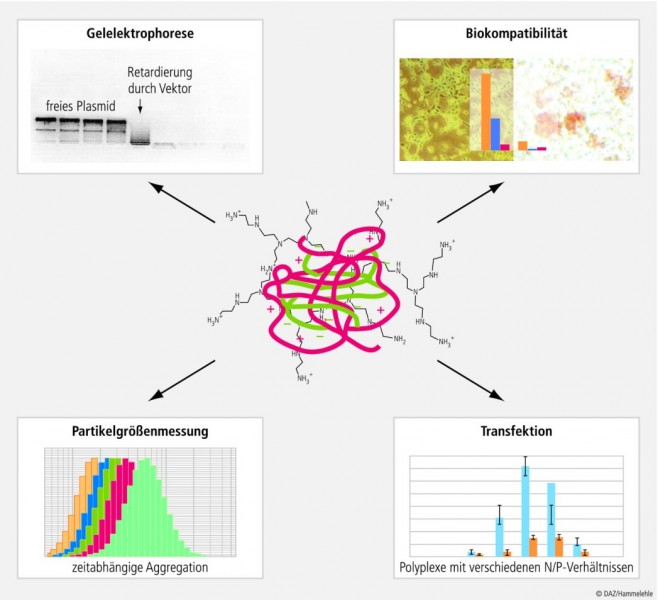
Die in vitro-Charakterisierung der hergestellten Endprodukte erfolgt über verschiedene physikochemische und biologische Parameter (Abb. 4), die auch als In-Prozess- und Endkontrollen für die Qualitätssicherung bei einer Produktion im Großmaßstab herangezogen werden können. Die Komplexgröße und Polydispersität der Komplexe spielt vor allem eine entscheidende Rolle bei ihrer Zirkulation in der Blutbahn zur Vermeidung von Embolien, bei der Verteilung im Organismus und bei der Aufnahme in die Zelle. Kompakte Partikel in der Größenordnung < 200 nm haben sich als besonders günstig für die endozytotische Aufnahme erwiesen. Die Partikelgrößen hängen sowohl von den Herstellungsbedingungen als auch von den strukturellen Eigenschaften des Trägermaterials ab.
Partikelgrößen der Komplexe im Nanobereich werden meist mit Laserlichtstreumethoden wie der Photonenkorrelationspektroskopie oder bildgebenden Verfahren wie AFM, Cryo-TEM und REM bestimmt. Letztere liefern gleichzeitig Informationen über die Morphologie der Komplexe. Viele Polymere bilden z. B. Polyplexe mit toroidalen Strukturen. Für Lipoplexe wurde die "Fleischklößchen- und Spaghetti-Struktur" (spaghetti-and-meatball structure) beschrieben; dabei ist die DNA fädig von Lipidmolekülen umhüllt (Spaghetti), und daneben gibt es Lipidtropfen mit umhüllter DNA (Fleischklößchen).
Ergebnisse zu Komplexen mit hochmolekularer DNA lassen sich nicht ohne Weiteres auf solche mit Oligonucleotiden und kurzkettigen RNA-Molekülen übertragen. Unterschiede in Komplexgrößen und Morphologie, verschiedene optimale N/P-Verhältnisse und unterschiedliche Komplexstabilitäten sind bedingt durch die schwächeren Wechselwirkungen mit den kurzkettigen Nucleinsäuren.
Zeitabhängige Partikelgrößenmessungen liefern Informationen über die Lagerungsstabilität der Komplexe, sie können also gegebenenfalls eine Aggregation der Systeme nachweisen. Häufig ist die Ursache in einer zu geringen Oberflächenladung und damit unzureichenden Abstoßung der Teilchen untereinander zu suchen. Dies wird mittels Laser-Doppler-Anemometrie durch Messung des Zetapotenzials bestimmt, das bei stabilen Systemen erfahrungsgemäß > 30 mV ist.
Ob die Nucleinsäuren vollständig gebunden sind, lässt sich einfach mittels Gelelektrophorese visualisieren, bei der die Nucleinsäuren durch interkalierende Farbstoffe wie z. B. Ethidiumbromid oder durch radioaktive Markierung sichtbar gemacht werden. Während freie DNA/RNA im Gel wandern kann, werden die Komplexe am Auftragsort zurückgehalten. Diese Retardierung ist zum einen durch die Größe der Komplexe, zum anderen durch die Neutralisation der anionischen Ladung der DNA/RNA bedingt. Bei Testung verschiedener N/P-Verhältnisse kann dasjenige Verhältnis ermittelt werden, bei dem die DNA/RNA vollständig am Auftragsort zurückgehalten werden kann und somit vollständig komplexiert ist. Zusätzlich lässt sich über eine Fluoreszenzlöschung, bedingt durch einen Ausschluss des Farbstoffs aus der DNA, auf eine sogenannte Kondensation und damit eine starke Kompaktierung und Schutz der DNA durch den Träger schließen.
Die Unversehrtheit des Nucleinsäurematerials nach enzymatischer (Nuclease) oder mechanischer Behandlung kann ebenfalls elektrophoretisch nachgewiesen werden. Quantitativ kann die gleiche Information durch fluoreszenzspektroskopische Messung ermittelt werden, bei der die Fluoreszenz des interkalierten Farbstoffs quantitativ erfasst wird.
Experimentelle und klinische Prüfungen
Um schädigende Einflüsse bei der Anwendung am Patienten ausschließen zu können, werden in Kurzzeit- und Langzeittests in vitro erste präklinische Untersuchungen zur Zyto- und Hämotoxizität der Komplexe durchgeführt, bevor In-vivo-Untersuchungen am Tier (zur Pharmakokinetik, Transfektionseffizienz, Toxikologie) oder an Probanden und Patienten folgen. Schädigung von Zellmembranen, Proliferationshemmung und Viabilität, Hemmung der metabolischen Zellaktivität, apoptotische oder nekrotische Effekte, Hämolyse oder Aggregation von Erythrozyten, Komplementaktivierung, Thrombozytenaggregation usw. sind dabei häufig Gegenstand spezifischer Tests, die in vielen Veröffentlichungen als Standardmethoden zu finden sind.
Nicht zuletzt ist der Goldstandard für die Entwicklung eines Transfektionssystems die Bestimmung der biologischen Effizienz. Je nach Target, Funktion und Art der verwendeten Nucleinsäure können verschiedenste Techniken dabei zur Anwendung kommen, um die therapeutische Wirkung und das Funktionieren des Mechanismus nachzuweisen.
Statistik der klinischen Studien
Seit 1989 wurden ca. 1600 klinische Studien mit mehr als 10.000 Patienten im Bereich der Gentherapie zugelassen, allerdings zunächst nur mit viralen Vektoren. Der erste nichtvirale Vektor wurde 1992 an Melanompatienten getestet. Allein im Jahr 2010 waren weltweit insgesamt 84 klinische Studien gemeldet. 60,7% dieser Studien sind in der Phase I, nur 3,5% in der Phase III. Deutschland liegt mit 4,6% der Studien auf Platz 3 hinter den USA und Großbritannien. Hauptsächlich werden Krebs, kardiovaskuläre, monogenetische und infektiöse Erkrankungen behandelt. Bevorzugt werden als Gentypen Antigene, Zytokine, Tumorsuppressoren und Suizidgene.
Betrachtet man diese Zahlen genauer, so fällt auf, dass weit mehr als die Hälfte der Studien mit nackter DNA und viralen Systemen durchgeführt wurde. Auch die beiden ersten in China zugelassenen Gentherapeutika Gendicine® (SiBiono GeneTech, Shenzen) und Oncorine® (Shanghai Sunway Biotech) basieren auf einem adenoviralen System bzw. fungieren als onkolytischer Virus. Da die klinischen Studien nicht nach internationalen Standards durchgeführt wurden, ist die Anwendung dieser Systeme bisher jedoch umstritten.
Die Lipofektion belegt mit 6,4% der Studien immerhin Platz 5, während die Polyfektion (Transfektion mit Polymeren) unter "andere Kategorien" verschwindet. Grund dafür sind die meistens immer noch geringeren Transfektionseffizienzen im Vergleich zu den viralen Vektoren.
Großes Potenzial scheint vor allem der Einsatz von nichtviralen Vektoren für die RNAi-Technologie zu bieten. Etwa ein Dutzend klinische Studien der Phase I wurden bzw. werden mit RNAi durchgeführt, wobei die Indikation Krebs dominiert. PEGylierte und mit Transferrin modifizierte Cyclodextrine, verschiedene Liposomen und stabile Nucleinsäure-Lipid-Partikel (SNALPs) sind dabei häufig genutzte nichtvirale Trägersysteme. Von den Ergebnissen der zahlreichen Studien konnte man lernen, dass Zellspezifität, Biokompatibilität, lange Zirkulationszeiten in der Blutbahn, Komplexstabilität und geeignete ökonomische Herstellungsmethoden wesentliche Faktoren sind, die es immer noch weiter zu verbessern gilt.
Resümee
Obwohl unser Wissen um die biologischen Barrieren zum Gentransfer stetig zunimmt und obwohl wir in zahlreichen präklinischen und klinischen Untersuchungen unser Verständnis zu den Struktur-Aktivitäts-Beziehungen von nichtviralen Vektoren immens erweitern konnten, haben die nichtviralen Systeme im Vergleich zu den viralen Vektoren immer noch Nachholbedarf, was klinische Studien betrifft. Die Grundlagen dafür sind jedoch gelegt. Derzeit ist eine Vielzahl von vielversprechenden Studien auf dem Weg.
Universelle Lösungen sind von diesen Studien jedoch nicht zu erwarten. Vielmehr gilt es, für jede Applikationsform und jede neue Anwendung ein Trägersystem speziell auszuwählen, anzupassen, zu optimieren und für die Großherstellung vorzubereiten.
Eine immer wieder neue Herausforderung für die pharmazeutischen Technologen!
Literatur [1] Breunig M, Bauer S, Goepferich A. Polymers and nanoparticles: Intelligent tools for intracellular targeting? Eur J Pharm Biopharm 2008;68:112-128. [2] Fischer D, Fahr A. Nichtvirale Gentransfer-Arzneimittel. Pharm Unserer Zeit 2011;40(3):212-219. [3] Mintzner MA, Simanek EE. Nonviral vectors for gene delivery. Chem Rev 2009;109:259-302. [4] Neu M, Fischer D, Kissel T. Recent advances in rational gene transfer vector design based on poly(ethylene imine) and its derivatives. J Gene Med 2005:7:992-1009. [5] Petrocca F, Lieberman J. Promise and challenge of RNA interference-based therapy for cancer. J Clin Oncol 2011;29(6):747-754. [6] Sokolova V, Epple M. Anorganische Nanopartikel zum Transport von Nukleinsäuren in Zellen. Angew Chemie 2008;120:1402-1416. [7] Kasper JC, et al. The establishment of an up-scaled micro-mixer method allows the standardized and reproducible preparation of well-defined plasmid/LPEI polyplexes. Eur J Pharm Biopharm 2011;77(1):182-185.[8] Kasper JC, et al. Development of a lyophilized plasmid/LPEI polyplex formulation with long-term stability – A step closer from promising technology to application. J Control Release 2011;151(3):246-255.
Autorin
Prof. Dr. Dagmar Fischer, Friedrich-Schiller-Universität Jena, Institut für Pharmazie Professur für Pharmazeutische Technologie, Otto-Schott-Strasse 41, 07745 Jena, Dagmar.Fischer@uni-jena.de
InternetDeutsche Gesellschaft für Gentherapie: www.dg-gt.de Für klinische Studien zugelassene virale Vektoren: www.wiley.co.uk/genmed/clinical |





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.