
- DAZ.online
- DAZ / AZ
- DAZ 29/2014
- Kampf gegen die ...
Kampf gegen die chronische Entzündung
Pharmakotherapie des Morbus Crohn
Von Damaris Mertens-Keller, Matthias Hoffmann, Olaf Rose und Hartmut Derendorf
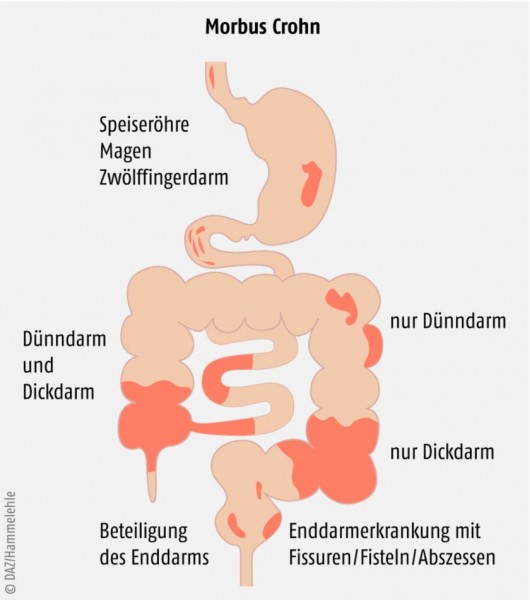
Morbus Crohn ist eine chronische, aber schubweise verlaufende Erkrankung. Die Bezeichnung „Crohn“ geht auf den US-amerikanischen Gastroenterologen Burrill Bernard Crohn zurück, der 1932 als Erster bei mehreren Patienten eine Entzündung des terminalen Ileums beschrieben hat. Es handelt sich hierbei um eine chronisch-granulomatöse Entzündung. Diese kann im Unterschied zur Colitis ulcerosa (s. Tab. 1) im gesamten Verdauungstrakt – von der Mundhöhle bis zum After – auftreten und umfasst in der Regel alle Schichten der Darmwand.
Am häufigsten ist der Bereich des „terminalen Ileums“ und des proximalen Colons betroffen. Typischerweise tritt die Entzündung segmental auf; neben erkrankten Abschnitten des Darms finden sich in direkter Nachbarschaft gesunde Bereiche (skip lesions; siehe Abb. 1). Eine Heilung ist bisher weder medikamentös noch operativ möglich. Die Entzündungsaktivität kann jedoch durch entsprechende Therapien deutlich verringert und Rückfälle vermieden werden [1].
Epidemiologie und Pathophysiologie
Die jährliche Anzahl der Neuerkrankungen beträgt in den westlichen Industriestaaten sieben bis acht pro 100.000, die Prävalenz liegt bei 150 pro 100.000 Einwohner [2]. Derzeit sind aktuellen Schätzungen zufolge in Deutschland etwa 320.000 Menschen an einer chronischen Darmentzündung erkrankt [3].
Am häufigsten erkranken junge Erwachsene im Alter zwischen 15 und 34 Jahren, wobei 15 bis 25% der Patienten die ersten Symptome vor dem 20. Lebensjahr entwickeln [4].
Zu den eigentlichen Ursachen des Morbus Crohn gibt es noch keine gesicherten Aussagen. Diskutiert werden unter anderem Umweltfaktoren, Ernährung, Viren bzw. Bakterien und familiäre Disposition. Insbesondere dem NOD2-Gen wird für die Entstehung von Morbus Crohn eine zentrale Bedeutung zugeschrieben, denn dessen Mutation führt zu einer verminderten zellulären und mukosalen Abwehr gegen Bakterien der Darmschleimhaut. Ebenso diskutiert wird eine genetische Prädisposition, die durch Umwelteinflüsse zum Ausbruch der Krankheit führt. Auffällig ist in diesem Zusammenhang das ethnisch unterschiedlich gehäufte Auftreten und die Häufung innerhalb von Familien und bei Zwillingen [5, 6]. Ein wesentlicher ätiologischer Faktor in der Entstehung und bezüglich des Schweregrades der Erkrankung ist der Nicotinabusus.
Klinik: Symptome und Verlauf
Zu den typischen Beschwerden gehören Durchfälle die mindestens sechs Wochen anhalten und 5 bis 20mal pro Tag teilweise blutig auftreten. Bauchschmerzen, Fieber, Gewichtsverlust, Stenosen, Fisteln und erhöhte Entzündungsparameter sind weitere typische Anzeichen. Auch „extraintestinale Manifestationen“ wie Entzündungen der Augen, der Haut oder der Gelenke sind möglich, da Morbus Crohn eine systemische Erkrankung ist. Der Verlauf ist geprägt durch akute Schübe mit individuell höchst unterschiedlicher Krankheitsaktivität und symptomfreien Phasen, die als Remission bezeichnet werden.
Die Diagnose und Differentialdiagnose wird anhand der Anamnese, des klinischen Erscheinungsbildes und einer Kombination aus biochemischen, sonografischen, endoskopischen, histologischen und/oder radiologischen Befunden gestellt.
Für die Differenzierung und Beurteilung der Krankheitsaktivität kann der sogenannte „Crohn´s Disease Activity Index“ (CDAI) herangezogen werden. Ein Wert ≤ 150 Punkten deutet auf eine Remission hin, Werte darüber lassen auf einen akuten behandlungsbedürftigen Schub schließen, wobei Werte > 300 auf einen schweren akuten Schub hinweisen.
Therapie des akuten Schubs
Die S3-Leitlinie der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten zur Diagnose und Therapie des Morbus Crohn [7] wird derzeit aktualisiert und voraussichtlich noch in diesem Jahr publiziert. Die Auswahl der medikamentösen Therapie sollte grundsätzlich in Abstimmung mit dem Patienten getroffen werden. Die Krankheitsaktivität, das Befallsmuster, das Vorhandensein extraintestinaler Manifestationen, potenzielle Nebenwirkungen der Medikamente und das Ansprechen auf Vorbehandlungen sollten hierbei berücksichtigt werden. Auch der Ernährungszustand sowie Mangelzustände dürfen nicht außer Acht gelassen werden. Insbesondere im Kindesalter und in der Pubertät spielen die Patientenzuverlässigkeit und die Auswirkungen der Krankheit bzw. der Therapie auf das Wachstum und die psychosoziale Entwicklung eine bedeutsame Rolle. Aus diesem Grund empfiehlt sich eine Betreuung durch einen Kinder- und Jugendarzt mit Expertise in Gastroenterologie. Grundsätzlich sollte bei Rauchern darauf hingewiesen werden, dass Nicotinabusus den Krankheitsverlauf bei M. Crohn erheblich verschlechtert.
Bei leichten Beschwerden ohne extraintestinale Manifestationen ist oft eine symptomatische Therapie mit Analgetika, Spasmolytika und Antidiarrhoika oder eine Ernährungstherapie ausreichend. Budesonid (9 mg/Tag) wird als erste Wahl bei Patienten mit milder Entzündungsaktivität eingesetzt und weist aufgrund der geringen systemischen Bioverfügbarkeit von 10% ein sehr viel geringeres Potenzial für systemische Nebenwirkungen im Vergleich zu konventionellen Glucocorticoiden auf. Budesonid ist mit einer Remissionsrate von bis zu 69% nach acht Wochen Therapie Mesalazin signifikant überlegen [8, 9]. Mesalazin wird daher in der neuen Leitlinie nur als Alternative bei ileozökalem Befall und leichter Aktivität angesehen, wenn ein steroidfreies Regime gewünscht wird. Die richtige Formulierung und Dosis ist entscheidend und in Abhängigkeit vom Schweregrad auszuwählen. Klistiere und Zäpfchen, die im Allgemeinen effektiver wirken als Präparate zur oralen Applikation werden möglicherweise, insbesondere von jungen Patienten, abgelehnt. Ebenso sollte trotz höherer Kosten eine einmal tägliche Gabe ermöglicht werden, wenn es Anzeichen gibt, dass eine mehrfach tägliche Gabe die Adhärenz negativ beeinflusst. Antibiotika spielen keine gesicherte Rolle bei der Therapie, sollten aber bei Verdacht auf infektiöse Komplikationen zusätzlich gegeben werden.
Bei Ileozäkalbefall und mäßiger Entzündungsaktivität wird vorzugsweise mit Budesonid oder systemisch wirkenden Glucocorticoiden behandelt. In Einzelfällen, insbesondere bei deutlich erniedrigtem Körpergewicht, ist eine enterale Ernährungstherapie anzuraten [10]. Dauert die Therapie länger als zwölf Wochen, ist eine osteoprotektive Zusatztherapie mit Calcium und Vitamin D für alle Patienten sinnvoll, um einer Glucocorticoid-induzierten Osteoporose vorzubeugen [11]. Ein Eisen-Defizit sollte während der Krankheitsaktivität parenteral korrigiert werden [12].
Bei Patienten mit hoher Entzündungsaktivität ist eine rasche Unterdrückung der Entzündung anzustreben, um eine frühzeitige Symptomverbesserung zu erreichen und Komplikationen zu vermeiden. Orale Glucocorticosteroide wie Prednison (1 mg/kg KG/Tag) werden hier als Mittel der ersten Wahl eingesetzt und führen bei bis zu 70% der Patienten zu einer Remissionseinleitung [13]. Die Nebenwirkungsrate ist allerdings erhöht. Bei hospitalisierten Patienten, die eine perorale Therapie nicht vertragen, ist eine parenterale Gabe mit Methylprednisolon oder Hydrocortison zu empfehlen. Wenn nach einer vierwöchigen Therapie mit ausreichend dosiertem Cortison-Präparat (mind. 0,75 mg Prednisolonäquivalent/kg KG/Tag) keine Besserung der Beschwerden eintritt, spricht man von einem steroidrefraktären Verlauf.
Bei Kindern und Jugendlichen gilt aufgrund der negativen Effekte der Glucocorticoide auf das Wachstum und die Knochendichte eine Ernährungstherapie als Mittel der ersten Wahl.
Immunmodulatoren wie Azathioprin und dessen eigentlich wirksames Stoffwechselprodukt 6-Mercaptopurin werden bei inkomplettem Ansprechen zusätzlich zu systemisch wirkenden Glucocorticoiden, bei Steroid-Abhängigkeit oder bei steroidrefraktärem Verlauf gegeben [15]. Die übliche Dosis beträgt 2–3 mg/kg KG/Tag Azathioprin und 1–1,5 mg/kg KG/Tag 6-Mercaptopurin.
Bei Unverträglichkeit oder Nebenwirkungen gegenüber Azathioprin bzw. 6-Mercaptopurin stellt Methotrexat eine weitere Option zur Remissionseinleitung und -erhaltung dar. Eine wöchentliche intramuskuläre oder subkutane Injektion von 15 bis 25 mg hat sich als effektiv erwiesen. Darüberhinaus ist auch hier ein Cortison-sparender Effekt zu beobachten [16]. Um Nebenwirkungen wie Übelkeit, Erbrechen, Durchfall und Mundschleimhautentzündung zu minimieren, sollte 24 Stunden nach der Injektion 5 mg Folsäure verabreicht werden.
TNF-α-Inhibitoren sind ebenfalls effektiv für die Akuttherapie des Morbus Crohn. Infliximab stellt eine gut untersuchte Behandlungsoption für den moderaten bis schweren Verlauf dar, wenn eine steroidale und immunsuppressive Therapie nicht anschlägt. In großen Studien führte intravenös verabreichtes Infliximab zu einer Remission bei 46% der Patienten nach zehn bis zwölf Wochen Behandlung [17]. Adalimumab ist eine weitere Option bei moderatem bis schwerem Verlauf. Die subkutane Applikation ist von Vorteil und stellt eine Alternative zu Infliximab dar, inbesondere wenn eine Besserung unter Infliximab rückläufig ist. In Studien konnte in 25% der Fälle nach vier Wochen eine Remission erreicht werden [18]. Bei Patienten, die nicht mehr auf Infliximab ansprechen, konnte bei 21% mit Adalimumab eine Remission nach vier Wochen gezeigt werden [19]. Seit Kurzem steht eine weitere Therapieoption zur Verfügung. Für Vedolizumab wurde in zwei klinischen Studien eine gute Wirksamkeit bei Morbus Crohn festgestellt. Im Unterschied zu den oben genannten TNF-α-Inhibitoren soll Vedolizumab seine Wirkung durch Bindung an α4β7-Integrin jedoch selektiv in der Darmregion entfalten [20].
Bei steroidabhängigem Verlauf zeigte Infliximab in Kombination mit Azathioprin eine signifikant höhere Remissionsrate von 57% im Vergleich zu Infliximab alleine (44%) oder Azathioprin alleine (30%) [21]. Die Kombinationstherapie birgt allerdings das Risiko hepatosplenischer T-Zell-Lymphome [22].
Da eine Anti-TNF-α-Therapie eine hohe Erfolgsquote aufweist und vielfach zur Normalisierung der Mukosa („mucosal healing“) führt, wird diskutiert, diese Biologika bei neu diagnostiziertem Morbus Crohn mit mittlerer oder schwerer Ausprägung gleich zu Beginn einzusetzen [23]. Demgegenüber steht die Sorge über die Entwicklung schwerwiegender Nebenwirkungen wie bestimmter Infektionen und Lymphome [24, 25]. Um langfristig den Nutzen der „hit hard and early“-Strategie zu beurteilen, sind also weitere Studien erforderlich.
Eine frühzeitige enterale Ernährung sollte bei Patienten mit Dünndarmbefall aufgrund drohender Mangelernährung in Betracht gezogen werden. Darüberhinaus sind grundsätzlich chirurgische Optionen vor der Einleitung einer immunsuppressiven Therapie zu bedenken.
Erhaltungstherapie
Systemische Glucocorticoide stellen prinzipiell keine Option in der Erhaltungstherapie dar, da sie langfristig keinen Einfluss auf den Krankheitsverlauf haben, jedoch ein hohes Risiko für schwerwiegende Nebenwirkungen [26]. Allerdings kann Budesonid als Erhaltungstherapie bis zu einem Jahr bei Patienten in Betracht gezogen werden, die steroidabhängig sind und für die Budesonid infrage kommt [27].
Mesalazin scheint eine gewisse präventive Wirksamkeit in der Erhaltungstherapie zu haben und kann für Patienten, die keine Immunsuppressiva erhalten können, aufgrund des günstigen Nebenwirkungsprofils und der geringeren Kosten in Betracht gezogen werden [28].
Azathioprin und 6-Mercaptopurin sind in 70% der Fälle effektiv, um eine Remission zu erhalten und sind für eine Therapie von mindestens vier Jahren geeignet. Insbesondere bei steroidabhängigem Verlauf und nach Infliximab- oder Steroid-induzierter Remission gelten sie als Therapie der ersten Wahl [28]. Patienten, die initial auf Methotrexat angesprochen haben, können diese Therapie mit 15–25 mg intramuskulär einmal wöchentlich fortführen. Die Remissionsrate beträgt mit Methotrexat 66% [29, 30].
In den neuen Leitlinien gelten TNF-α-Inhibitoren bei steroidrefraktärem Verlauf als Therapie der ersten Wahl. Weitere Indikationen sind ein steroidabhängiger Verlauf, ein Versagen von Immunsuppressiva und ein hochaktives Fistelleiden [30]. Eine Dosissteigerung auf 10 mg/kg KG Infliximab oder eine Verkürzung des Dosierintervalls kann bei nachlassender Wirksamkeit in Betracht gezogen werden. Alternativ kann Adalimumab eingesetzt werden.
Prinzipiell gelten für Kinder und Jugendliche die gleichen Therapieprinzipien wie für Erwachsene. Es ist allerdings zu beachten, dass zusätzlich Wachstumsretardierung und verzögerte Pubertät als besondere Zeichen der Krankheitsaktivität für die Therapieentscheidung bedeutsam sind.
Nebenwirkungen
Da Unverträglichkeiten oft die Therapie beeinträchtigen oder einen vorzeitigen Abbruch erfordern, ist es essenziell, über die wichtigsten Nebenwirkungen (siehe auch Tab. 2) informiert zu sein, um das Auftreten zu vermeiden bzw. zu minimieren.
Im Vergleich zu Mesalazin treten unerwünschte Wirkungen unter Sulfasalazin häufiger auf. Diese sind entweder dosisabhängig oder idiosynkratischer Natur [33, 33]. Vermutlich ist hierfür der Sulfapyridin-Teil verantwortlich. Neben dosisabhängigen Nebenwirkungen, wie Übelkeit, Erbrechen, Durchfälle und Anorexie, können auch Kopfschmerzen und Arthralgie auftreten. Insbesondere zu Beginn der Therapie ist mit Nebenwirkungen zu rechnen, die im Laufeder Therapie abklingen. Optional kann das Arzneimittel kurzzeitig abgesetzt werden und dann mit einer geringeren Dosis und einer langsameren Dosistitration wieder angesetzt werden. Auch die Einnahme mit einer Mahlzeit oder der Austausch gegen ein anderes magensaftresistentes Präparat kann Abhilfe schaffen. Die Folsäureabsorption ist mit Sulfasalazin vermindert, so dass Folsäure zusätzlich supplementiert werden sollte. Die idiosynkratischen Reaktionen umfassen üblicherweise Ausschlag, Fieber, Hepatotoxizität, sehr selten auch Knochenmarkssuppression, Thrombozytopenie, Pankreatitis, interstitielle Nephritis und Hepatitis. In den meisten Fällen muss Sulfasalazin abgesetzt werden. Bei manchen Patienten mit allergischen Reaktionen auf Sulfasalazin kann eine Desensibilisierung mit langsamer Steigerung der Dosis über Wochen und Monate versucht werden. Bei bis zu 80% der Patienten, die Sulfasalazin nicht tolerieren können, sind Mesalazin-Präparate gut verträglich [33]. Am häufigsten treten Übelkeit, Erbrechen und Kopfschmerzen auf. Schwerwiegende Nebenwirkungen wie Pankreatitis und interstitielle Nephritis sind selten.
Die Wahrscheinlichkeit für Nebenwirkungen ist bei Glucocorticoiden größer, da häufig hohe Dosen über einen längeren Zeitraum nötig sind. Gerechnet werden muss mit Hyperglykämie, Hypertonie, Osteoporose, Akne, Ödemen, Elektrolytveränderungen, Myopathien, Muskelschwund, verstärktem Appetit, Psychosen, Infekten und Nebennierenrindeninsuffizienz [35]. Um steroidbedingte Nebenwirkungen zu minimieren, ist eine tägliche Einmalgabe der Aufteilung der Tagesdosis auf mehrere Einzeldosen vorzuziehen. Bei einer Anwendung von mehr als zwei bis drei Wochen sollten Glucocorticoide ausgeschlichen werden, um einer Nebennierenrindeninsuffizienz vorzubeugen. Aufgrund der niedrigeren Bioverfügbarkeit kann Budesonid bei Beteiligung des Ileums oder des rechten Kolons und bei steroidabhängigem Verlauf oder längerfristiger Therapie bevorzugt werden [36]. Während der Dosistitration sollte das Blutbild alle zwei Wochen kontrolliert werden.
Azathioprin und 6-Mercaptopurin können zu Lymphomen, Pankreatitis oder Nephrotoxizität führen. Dosisabhängige Reaktionen umfassen Unwohlsein, Übelkeit, Infektionskomplikationen, Hepatitis und Myelosuppression. Zu den spezifischen Reaktionen gehören Fieber, Ausschlag, Arthralgie und Pankreatitis. 3 bis 15% der Patienten sind hiervon betroffen [37]. Ursache für diese unerwünschten Wirkungen ist wahrscheinlich ein Polymorphismus des Enzyms Thiopurin-Methyltransferase (TPMT), welches für die Aktivierung und den Metabolismus verantwortlich ist.
Die Kombination von Azathioprin mit Infliximab birgt das Risiko von hepatosplenischen T-Zell-Lymphomen (HSTLC). Insbesondere junge männliche Patienten scheinen ein erhöhtes Risiko zu haben [38].
Methotrexat ist assoziiert mit Übelkeit, Erbrechen, Lungenfibrose, Pneumonitis, Hepatoxizität, Anämie und eingeschränkter Nierenfunktion. Darüberhinaus hat es eine abortive Wirkung. Vor Beginn einer Therapie sollten Leberwerte, Nierenfunktion und Blutbild überprüft werden. Bei Frauen muss darüber hinaus eine Schwangerschaft ausgeschlossen werden.
TNF-α-Inhibitoren können ebenfalls schwerwiegende Nebenwirkungen verursachen. Infliximab führt oft zur Entwicklung von Antikörpern, die zu schweren Infusionsreaktionen und Wirkungslosigkeit führen können. Davon sind bis zu 10% der Patienten betroffen [39]. Zur Vermeidung der Antikörperentwicklung sollte die zweite Dosis innerhalb von acht Wochen nach der ersten Dosis gegeben werden. Auch durch die Gabe von Hydrocortison 200 mg i.v. am Infusionstag bzw. perorales Prednison am Vortag der Infusion und durch die zeitgleiche Gabe von immunsuppressiven Wirkstoffen kann einer Antikörperentwicklung vorgebeugt werden. Hypersensibilitätsreaktionen können bis zu 14 Tage nach der Applikation auftreten und werden am häufigsten zwischen dem fünften und siebten Tag beobachtet. Die subkutane Applikation von Adalimumab führt oft zu lokalen Injektionsreaktionen, das Risiko für die Bildung von Antikörpern ist hier minimal. Eine bestehende Tuberkuloseerkrankung kann während der Therapie wieder aktiviert werden und muss ausgeschlossen werden.
Impfstrategie
Die Standardimpfungen sollten nach den Empfehlungen der STIKO überprüft und gegebenenfalls aufgefrischt werden. Beim Einsatz von Immunsuppressiva werden zusätzliche Impfungen gegen Grippe, Pneumokokken und Hepatitis-B empfohlen. Impfungen mit Lebendimpfstoffen dürfen nicht während einer immunsuppressiven Therapie oder kurz davor bzw. danach durchgeführt werden.
Literatur
[1] Podolsky, D. K. Inflammatory bowel disease. N. Engl. J. Med. 347 (2002) 417-429
[2] Jacobsen BA, et al. Increase in incidence and prevalence of inflammatory bowel disease in northern Denmark: a population-based study, 1978–2002. Eur J Gastroenterol Hepatol. 2006 Jun;18(6),601–606
[3] Brokemeyer B: CED-Behandlung in Deutschland. Gastroenterologe 2007;2:447-455
[4] Shivananda S, Lennard-Jones J, Logan R et al. Incidence of inflammatory bowel disease across Europe: is there a difference between north and south? Results oft he European Collaborative Study on Inflammatory Bowel Disease (EC-IBD). Gut 1996;39:690-697
[5] Sonnenberg, A., et al. Geographic variation of inflammatory bowel disease within the United States. Gastroenterology 100 (1991) 143-149
[6] Orholm, M., et al. Familial occurance of inflammatory bowel disease. N. Engl. J. Med. 324 (1991) 84-88
[7] Hoffmann JC, Autschbach F, Bokemeyer B, et al. Short version of the updated German S3 (level 3) guideline on diagnosis and treatment of Crohn‘s disease. Dtsch Med Wochenschr. 2008 Sep;133(38):1924-9
[8] Talley NJ, Abreu MT, Achkar JP, et al. An evidenced-based systematic review in medical therapies for inflammatory bowel disease: Am J Gastroenterol 2011;106:S2-S25
[9] Blonski W, Buchner AM, Lichtenstein GR. Inflammatory bowel disease therapy: Current state-of-the-art. Curr Opin Gastroenterol 2011;27:346-357
[10] Lochs H, Dejong C, Hammarqvist F et al. ESPEN Guidelines on Enteral Nutrition: Gastroenterology. Clin Nutr 2006;25:260–274
[11] Travis, S. P. L., et al. European evidence based consensus on the diagnosis and management of Crohn´s disease: current management. Gut 2006;55:16-35
[12] Gasche C, Berstad A, Befrits R et al. Guidelines on the diagnosis and management of iron deficiency and anemia in inflammatory bowel diseases. Inflamm Bowel Dis 2007;13:1545–1553
[13] Ford AC, Bernstein CN, Kahn KJ, et al. Glucocorticosteroid therapy in inflammatory bowel disease: Systematic review and meta-analysis. Am J Gastroenterol 2011;106:590-599
[14] Bitton A, Buie D, Enns R, et al. Treatment of hospitalized adult patients with severe ulcerative colitis: Toronto consensus statements. Am J Gastroenterol 2012;107:179-194
[15] Khan KJ, Dubinsky MC, Ford AC, et al. Efficacy of immunosuppressive therapy for inflammatory bowel disease: A systemic review and meta-analysis. Am J Gastroenterol 2011;106:630-642
[16] Cottone M, Renna S, Orlando A, Mocciaro F. Medical management of Crohn´s Disease. Expert Opin Pharmacother 2011;12(16):2505-2525
[17] Danese S, Colombel JF, Reinisch W, Rutgeerts PJ. Review article: Infliximab for Crohn´s Disease treatment shifting therapeutic strategies after 10 years of clinical experience. Aliment Pharmacol Ther 2011;33:857-869
[18] Ford AC, Sandborn WJ, Khan KJ, et al. Efficacy of biological therapies in inflammatory bowel disease: Systemic review and meta-analysis. Am J Gastroenterol 2011;106:644-659
[19] Yanai H, Hanauer SB.Assessing response and loss of response to biologic therapies in IBD.Am J Gastroenterol 2011;106:685-698
[20] Sandborn WJ, Feagan BG, Rutgeerts P, et al. Vedolizumab as Induction and Maintenance Therapy for Crohn´s Disease. N Engl. J Med 2013;369:711–721
[21] Colombel JF, Sandborn WJ, Reinisch W, et al. SONIC Study Group: Infliximab, azathioprine, or combination therapy for Crohn´s disease. N Engl J Med 2010;362:1383-1395
[22] Mackey AC, Green L, et al. Hepatosplenic T cell lymphoma associated with infliximab use in young patients treated for inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2007; 44:265-267
[23] S3-Leitlinie „Diagnostik und Therapie des Morbus Crohn“ Ergebnisse einer evidenzbasierten Konsensuskonferenz der Deutschen Gesellschaft für Verdauungs- und Stoffwechselkrankheiten zusammen mit dem Kompetenznetz Chronische Entzündliche Darmerkrankungen
[24] Van Assche G, Vermeire S, Rutgeerts P. Immunosuppression in inflammatory bowel disease: Traditional, biological or both? Curr Opin Gastroenterol 2009;25:323-328
[25] Van Assche G, Lewis JD, Lichtenstein GR, Loft EV, Ouyang Q, Panes J. The London Position Statement of the World Congress of Gastroenterology on Biological Therapy for IBD with the European Crohn´s and Colitis Organisation: Safety. Am J Gastroenterol 2011;106:1594-1602
[26] Buchner AM, Blonski W, Lichtenstein GR. Update on the management of Crohn´s Disease. Curr Gastroenterol Rep 2011;3:465-474
[27] Talley NJ, Abreu MT, Achkar JP, et al. An evidenced-based systematic review in medical therapies for inflammatory bowel disease: Am J Gastroenterol 2011;106:2-25
[28] Ford AC, Khan KK, Talley NJ, Moayyedi P. 5-Aminosalicylates prevent relapse of Crohn´s Disease after surgically induced remission: Systematic review and metaanalysis. Am J Gastroenterol 2011;106:413-420
[29] Peyrin-Biroulet L, Lémann M. Review article: Remission rates achievable by current therapies for inflammatory bowel disease. Aliment Pharmacol Ther 2011;33:870-879
[30] Khan KJ, Dubinsky MC, Ford AC, et al. Efficacy of immunosuppressive therapy for inflammatory bowel disease: A systemic review and meta-analysis. Am J Gastroenterol 2011;106:630-642
[31] Ärzte Zeitung, 19.11.2013
[32] Biondi A, Zoccali M, Costa S, et al. Surgical treatment of ulcerative colitis in the biologic therapy era. World J Gastroenterol 2012;18(16):1861-1870
[33] Ford AC, Ackhar AC, Khan KJ, et al. Efficacy of 5-aminosalicylates in ulcerative colitis: Systemic review and meta-analysis. Am J Gastroenterol 2011;106:601-616
[34] Kornbluth A, Sachar DB. Ulcerative practice guidelines in adults: American College of Gastroenterology, Practice Parameters Committee. Am J Gastroenterol 2010;105:501-523
[35] Ford AC, Bernstein CN, Kahn KJ, et al. Glucocorticosteroid therapy in inflammatory bowel disease: Systematic review and meta-analysis. Am J Gastroenterol 2011; 106:590-599
[36] siehe Fußnote 6
[37] Pascal Juillerat P, Pittet V, Felley C, et al. Drug safety in Crohn´s Disease.Digestion 2007;76:161-168
[38] Kotlayr DS, Osterman MT, Diamond RH, et al. A systematic review of factors that contribute to hepatosplenic T-cell Lymphoma in patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2011;9:36-41.e.1
[39] Connor V. Anti-TNF-therapies: A comprehensive analysis of adverse effects associated with immunosuppression. Rheumatol Int 2011;31:327-337






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.