
- DAZ.online
- DAZ / AZ
- DAZ 29/2015
- Frühe Diagnosen durch
Radiopharmazie
Frühe Diagnosen durch PET
Molekulare Bildgebung ebnet den Weg für die personalisierte Medizin
Die altbewährten Verfahren der Röntgendiagnostik – die Computertomografie (CT) und die Magnetresonanztomografie (MRT) – sind ideal für die Visualisierung krankheitsbedingter Veränderungen; sie benötigen allerdings hohe Kontrastmitteldosen, was der Entwicklung hochspezifischer Kontrastmittel entgegensteht.
Mit der Positronen-Emissions-Tomografie (PET) steht heute ein bildgebendes Verfahren zur Verfügung, mit dem Stoffwechselprozesse auf molekularer Ebene verfolgt werden können. Die PET-Bildgebung basiert auf der Injektion einer radioaktiven, Positronen-emittierenden Substanz (Radiopharmakon), welche sich selektiv im Zielgewebe anreichert. Die emittierten Positronen kollidieren mit Elektronen in ihrer unmittelbaren Umgebung, wodurch beide Teilchen in Gammastrahlung umgewandelt werden, die vom PET-Scanner detektiert wird. Die computergestützte Bildrekonstruktion ermöglicht dann eine dreidimensionale Darstellung der Verteilung des Radiopharmakons im Körper.
Radiopharmaka für die PET
Die bei der PET-Bildgebung eingesetzten Radiopharmaka bestehen jeweils aus einem Trägermolekül (Carrier) und einem Radionuklid. Da hierbei nur eine minimale Stoffmenge benötigt wird, bezeichnet man sie auch als Radiotracer (engl. trace = Spur). Sie werden entweder diagnostisch oder therapeutisch eingesetzt.
Als Trägermoleküle dienen teils natürlich vorkommende Stoffe wie Saccharide, Aminosäuren oder Nucleoside, teils synthetische Liganden von bestimmten Antigenen oder Rezeptoren. In den natürlichen Trägermolekülen werden funktionelle Gruppen oder natürliche Isotope durch vorzugsweise kurzlebige Radionuklide ersetzt, z. B. OH durch 18Fluor oder 127Iod durch 123Iod oder 131Iod. Das Radionuklid kann auch an einen Chelator gekoppelt sein, der Bestandteil eines komplexen Trägermoleküls ist.
Diagnostik mit FDG
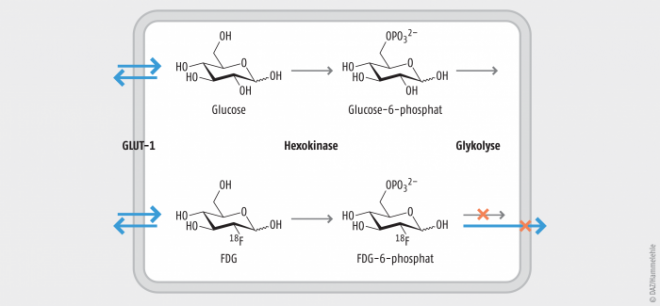
[18F]Fludesoxyglucose (2-[18F]Fluor-2-desoxy-D-glucose, FDG) ist das bekannteste Radiopharmakon für die PET-Bildgebung. In ihm ist eine Hydroxylgruppe der Glucose durch das Radionuklid 18F ersetzt, sodass Glucose als Carrier für 18F fungiert (Abb. 1). FDG dient der Sichtbarmachung des Glucoseverbrauchs und hat in der Onkologie einen sehr hohen Stellenwert, da viele Tumorarten einen stark erhöhten Glucoseverbrauch aufweisen [1]. Nach der Injektion wird FDG durch den gleichen Mechanismus wie Glucose in die Zellen transportiert (durch den Glucosetransporter GLUT-1) und anschließend durch das Enzym Hexokinase zu FDG-6-phosphat phosphoryliert. Dieses kann im Gegensatz zu Glucose-6-phosphat nicht weiter verstoffwechselt werden, und es kann die Zelle auch nicht verlassen, sodass es akkumuliert, und zwar in Krebszellen viel stärker als in gesunden Zellen [2]. Die Anreicherung des radioaktiven FDG-6-phosphats kann mittels PET visualisiert werden.
Ein großer Vorteil dieses Verfahrens liegt in der sehr kurzen Halbwertszeit des Radionuklids 18F (110 min) [3], sodass die benötigte Dosis sehr gering ist. Daraus ergibt sich bei PET-Untersuchungen eine Strahlenbelastung des Patienten, die mit der Strahlenbelastung bei einer Ganzkörper-CT-Untersuchung vergleichbar ist oder sogar deutlich darunter liegt.
Abb. 1: Anreicherung des Radiopharmakons FDG in Tumorgewebe. FDG (unten) wird ebenso wie Glucose (oben) durch den Glucosetransporter GLUT-1 in die Zelle aufgenommen und durch das Enzym Hexokinase phosphoryliert. Das nächste Enzym der Glykolyse prozessiert zwar das Glucose-6-phosphat, aber nicht das FDG-6-phosphat. Weil das FDG-6-phosphat die Zelle auch nicht verlassen kann, akkumuliert es – und mit ihm das Radionuklid 18F. Mittels PET kann es detektiert werden, was wegen der kurzen Halbwertszeit (110 min) unmittelbar nach der Injektion geschehen muss.
Aminosäure- und Nucleosidanaloga: FET und FLT
Während der Einsatz von FDG bei hoch-malignen Tumoren sehr gute Ergebnisse liefert, stößt dieses Verfahren bei der Visualisierung von niedrig-malignen Tumoren an seine Grenzen. Bei niedrig-malignen Hirntumoren beispielsweise kann die FDG-Anreicherung in Tumorzellen maskiert sein, weil das Gehirn einen physiologisch hohen Glucoseverbrauch aufweist und FDG sich auch in gesunden Zellen anreichert. Deshalb werden bei niedrig-malignen Tumoren andere Radiotracer bevorzugt. Bei Hirntumoren kommt z. B. das Aminosäureanalogon [18F]Fluorethyltyrosin ([18F]FET) zum Einsatz, welches die Messung des Aminosäurestoffwechsels im Gewebe ermöglicht [4] (in Tumoren werden aufgrund des erhöhten Aminosäureumsatzes Aminosäuretransporter verstärkt exprimiert).
Eine weitere Alternative zur Detektion sowie zum Monitoring von Krebs stellt der Radiotracer 3‘-Desoxy-3‘-[18F]fluorthymidin ([18F]FLT) dar [5]. Hier macht man sich zunutze, dass schnell proliferierende Zellen im Gegensatz zu ruhenden Zellen DNA synthetisieren. Das Funktionsprinzip ist ähnlich wie bei FDG: Das Nucleosidanalogon [18F]FLT gelangt mittels passiver Diffusion in die Zelle und wird durch die Thymidinkinase 1 (TK1) phosphoryliert, wonach es die Zelle nicht mehr verlassen kann. Da die Aktivität der TK1 in Tumorzellen deutlich höher als in normalen Zellen ist, kann hierdurch eine selektive Anreicherung im Krebsgewebe erreicht werden [6].
PET-Diagnostik des Prostatakarzinoms
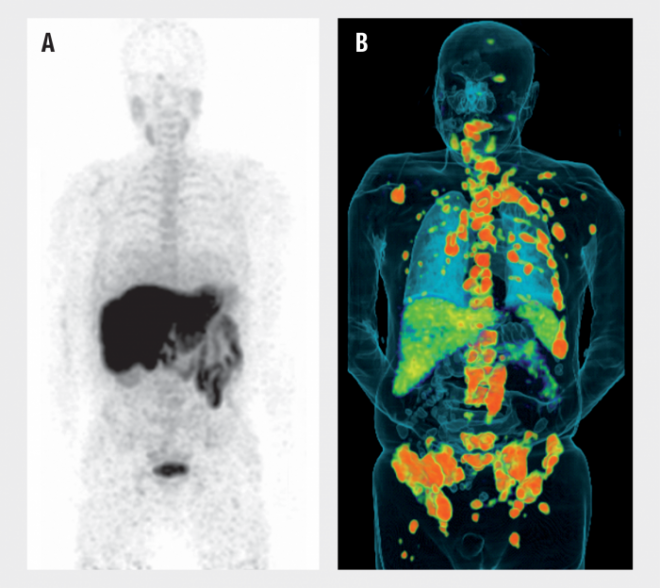
Auch Proteine, die in Tumoren hochreguliert sind, werden als Zielstrukturen von Radiotracern genutzt. Ein Beispiel dafür ist das Prostata-spezifische Membranantigen (PSMA), welches Prostatakarzinomzellen als Erkennungsmerkmal auf ihrer Oberfläche tragen. Durch rationales Molecular Design ist es gelungen, radioaktive Substanzen zu entwickeln, welche selektiv an PSMA binden und somit die Möglichkeit bieten, den Primärtumor und die Metastasen mittels PET zu detektieren. Ein Beispiel für einen etablierten, hochselektiven PSMA-bindenden Tracer ist das Glu-NH-CO-NH-Lys-(Ahx)-[68Ga(HBED-CC)] (kurz als 68Ga-PSMA bezeichnet, s. Abb. 2) [7]. Das Radionuklid 68Gallium hat eine Halbwertszeit von nur 68 Minuten, wodurch eine übermäßige radioaktive Exposition des Patienten verhindert wird.
B: Im Gegensatz dazu ist der Radiotracer 68Ga-PSMA selektiv im Tumorgewebe angereichert (orange). Der Patient leidet an einem Prostatakarzinom mit Metastasen, vor allem in den Beckenknochen, Rippen und der Wirbelsäule.
Frühzeitiges Therapiemonitoring
Der Fokus der PET liegt heute insbesondere auf der nicht-invasiven Bildgebung früher Krebsstadien sowie auf der „behandlungsbegleitenden“ Verlaufskontrolle. Durch ein solches Therapiemonitoring ist es möglich, bereits in einem sehr frühen Therapiestadium zu erkennen, ob der Patient auf die Behandlung anspricht oder nicht, und bei Nichtansprechen eine Behandlung frühzeitig umzustellen oder abzubrechen. Zudem können durch die Vermeidung von nicht-zielführenden Therapien Nebenwirkungen vermieden und Kosten eingespart werden.
From bench to bedside
Generell ist eine sehr kurze Halbwertszeit des Radionuklids im Radiotracer von größter Bedeutung, um die Strahlenexposition für den Patienten so gering wie möglich zu halten. Eine sehr kurze Halbwertszeit bedeutet allerdings, dass die Radiotracer unmittelbar vor der Injektion hergestellt werden müssen („from bench to bedside“). Diesen immensen Anforderungen (apparativ und personell) können nur wenige große Kliniken wie das Universitätsklinikum Heidelberg sowie große Forschungszentren genügen.
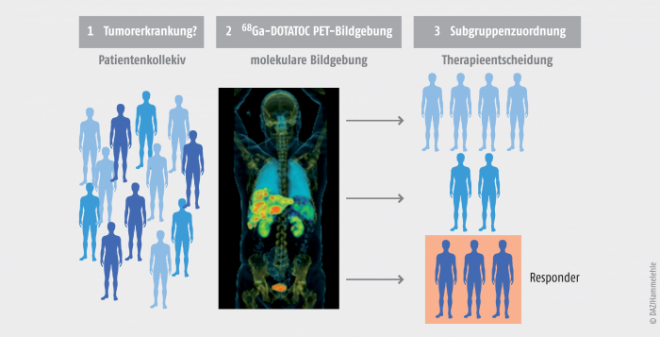
In einigen Fällen kann der Arzt aufgrund der PET-Diagnostik sogar vorhersagen, ob ein Tumorpatient auf eine spezielle Therapieoption anspricht oder nicht. Beispielsweise können neuroendokrine Tumoren nach Injektion von [68Ga]Galliumedotreotid mithilfe der PET diagnostiziert werden (Abb. 3). Als Therapie kann im Anschluss ein Octreotidderivat zum Einsatz kommen, das mit dem β‑Strahler 90Yttrium gekoppelt ist.
Die durch die molekulare Bildgebung gewonnenen Informationen ermöglichen eine individuelle Behandlung, die häufig auch als personalisierte Medizin bezeichnet wird.
Neurotracer in Pharmakologie und Diagnostik
Neben der Diagnostik und Behandlung verschiedenster Krebsarten gibt es weitere Einsatzmöglichkeiten von Radiotracern wie z. B. die Bildgebung neurologischer Fehlfunktionen in der experimentellen Pharmakologie. Selektive Neurotracer können durch die Radiomarkierung von Psychopharmaka erhalten werden, deren hohe Spezifität auf der Imitation von Neurotransmittern beruht. Dies ermöglicht die Lokalisation ihrer Targets (in der Regel Rezeptoren, Transporter oder Enzyme). Typische Beispiele für Neurotracer sind ([11C]Methoxy)Racloprid und [18F]Fallyprid. Sie binden spezifisch an die Dopaminrezeptorsubtypen D2 und D3 [9], was eine Abschätzung der Rezeptorbindung von Neuroleptika in der Schizophreniebehandlung ermöglicht.
Mehrere Neurotracer werden bereits in der klinischen Diagnostik eingesetzt: 2012 hat die EMA [18F]-Florbetapir (Amyvid™) zur PET-Bildgebung neuritischer β-Amyloid-Plaques im Gehirn von Patienten, bei denen der Verdacht auf die Alzheimer-Krankheit besteht, zugelassen. Bis 2014 folgten [18F]-Florbetaben (Neuraceq™) sowie [18F]Flutemetamol (Vizamyl™) mit denselben Indikationen [10].
Ein noch in der Entwicklung befindlicher Neurotracer ist 18F-MNI-444, welches selektiv an Adenosin-2A-Rezeptoren bindet [11]. A2A -Rezeptoren gelten als potenzielles Target zur Pharmakotherapie neurodegenerativer und neuropsychiatrischer Erkrankungen wie Morbus Parkinson [12].
Auch in der Kardiologie, bei Patienten mit Epilepsie sowie in der Erforschung der Gehirntätigkeiten von Drogenabhängigen kommt die molekulare Bildgebung zum Einsatz.
Erstattung durch die GKV?
Derzeit werden die Kosten für die molekulare Bildgebung nur von den privaten Krankenkassen übernommen.
Bei GKV-Versicherten besteht bislang noch keine einheitliche Regelung zur Kostenübernahme. Beim Prostatakarzinom gibt es in Einzelfällen nach schriftlicher Begründung eine Kostenerstattung [16].
Optimierte Pharmakotherapie durch Konjugate
Zur Therapieoptimierung benötigt man Medikamente, die jeweils auf spezielle Subgruppen eines Patientenkollektivs perfekt zugeschnitten sind. Die klassischen Chemotherapeutika adressieren hauptsächlich die in Tumorzellen veränderte Stoffwechsel- oder Zellteilungsregulation. Aufgrund ihrer geringen Selektivität treffen ihre zytotoxischen Effekte jedoch auch zu einem gewissen Anteil das gesunde Gewebe. Dagegen reichern sich zielgerichtete Medikamente selektiv im Tumor an.
Als besonders vielversprechend gelten die Antikörper-Wirkstoff-Konjugate (antibody-drug conjugates, ADCs), bei denen Zytostatika an monoklonale Antikörper gekoppelt sind, die nur an bestimmte Krebszelltypen binden und dort die Wirkstoffe freisetzen. Ein Beispiel ist Trastuzumab Emtansin (Kadcyla®), das 2013 von der FDA und der EMA für die Behandlung von Patientinnen mit fortgeschrittenem HER2-positivem Brustkrebs zugelassen wurde. Bei Kadcyla® wird die HER-2-Hemmung durch Trastuzumab (Herceptin®) mit der zytotoxischen Wirkung des Mikrotubuli-inhibierenden Maytansinoids DM-1 kombiniert [13]. Eine große Anzahl weiterer Antikörper-Wirkstoff-Konjugate befindet sich in der Pipeline der Pharmaindustrie [14].
Auch in der Radiopharmazie werden ADCs entwickelt. Der prominenteste Vertreter ist hier das bereits 2004 in den Markt eingeführte Ibritumomabtiuxetan (Zevalin®), das sich aus dem spezifisch gegen das B-Zell-Antigen CD20 gerichteten monoklonalen Antikörper Ibritumomab und dem Chelator Tiuxetan zusammensetzt, an den vor der Injektion der β‑Strahler 90Yttrium gekoppelt wird [15]. Nach der Bindung von Ibritumomab an seine Zielstruktur CD20 vernichtet 90Y die betroffenen Zellen, während umliegende, gesunde Zellen von der zytotoxischen Strahlung verschont bleiben.
Schlussfolgerung
Das Zusammenspiel von molekularer Bildgebung, Radiotracern und neuen Wirkstoffklassen wie den Antikörper-Wirkstoff-Konjugaten ermöglicht eine personalisierte Medizin, mit der schon heute individuelle Therapien durchgeführt werden können. Durch ein besseres Verständnis der Pathomechanismen, durch verfeinerte diagnostische Tests sowie eine größere Anzahl spezifischer Therapeutika soll es in Zukunft möglich sein, derzeit noch schwer heilbare Krankheiten, vor allem viele Krebsarten, effektiv zu behandeln. |
Literatur
[1] Warburg O. On the origin of cancer cells. Science 1956;123:309-314
[2] Smith TAD. FDG uptake, tumour characteristics and response to therapy: a review. Nucl Med Comm 1998;19:97-106
[3] Uhl P, et al. Radionuclides in drug development. Drug Discovery Today 2015;20:198-208
[4] Piroth MD, et al. Prognostic value of early [18F]fluoroethyltyrosine positron emission tomography after radiochemotherapy in glioblastoma multiforme. Int J Radiat Oncol Biol Phys 2011;80:176-184
[5] Mier W, et al. [18F]FLT; portrait of a proliferation marker. Eur J Nucl Med 2002;29:165-169
[6] Been LB, et al. [18F]FLT-PET in oncology: current status and opportunities. Eur J Nucl Med Mol Imaging 2004;31:1659-1672
[7] Afshar-Oromieh A, et al. PET imaging with a [68Ga]gallium-labelled PSMA ligand for the diagnosis of prostate cancer: biodistribution in humans and first evaluation of tumour lesions. Eur J Nucl Med Mol Imaging 2013;40:486-495
[8] van der Veldt A, et al. Biodistribution and radiation dosimetry of 11C-labelled docetaxel in cancer patients. Eur J Nucl Med Mol Imaging 2010;37:1950-1958
[9] Siessmeier T, et al. Parametric mapping of binding in human brain of D2 receptor ligands of different affinities. J Nucl Med 2005;32:964-972
[10] Amivyd EPAR – Product Information; Neuraceq EPAR – Product Information; Vizamyl EPAR – Product Information. www.ema.europa.eu
[11] Barret O, et al. Characterization in humans of 18F-MNI-444, a PET radiotracer for brain adenosine 2A receptors. J Nucl Med 2015;56:586-591
[12] Fuxe K, et al. Receptor heteromerization in adenosine A2A receptor signaling: Relevance for striatal function and Parkinson’s disease. Neurology 2003;61:S19-S23
[13] Verma S, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer. New Engl J Med 2012;367:1783-1791
[14] Zolot RS, et al. Antibody-drug conjugates. Nature Rev Drug Discovery 2013;12:259-260
[15] Wiseman GA, et al. Radioimmunotherapy of relapsed non-Hodgkin‘s lymphoma with zevalin, a 90Y-labeled anti-CD20 monoclonal antibody. Clin Cancer Res 1999;5:3281s-3286s
[16] Röthke MC, et al. Potenziale der PET/MRT in der Diagnostik des Prostatakarzinoms. Radiologe 2013;53:676-681
Autoren
Prof. Dr. Walter Mier,
Laborleiter Radiopharmazeutische Chemie
Radiologische Klinik und Poliklinik im Universitätsklinikum Heidelberg
Im Neuenheimer Feld 400
69120 Heidelberg
Philipp Uhl, Apotheker und Doktorand bei Prof. Mier
Prof. Dr. med. Uwe Haberkorn,
Direktor der Abteilung Nuklearmedizin
Radiologische Klinik und Poliklinik im Universitätsklinikum Heidelberg





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.