
- DAZ.online
- DAZ / AZ
- DAZ 38/2015
- Eine neue Option nicht ...
Arzneimittel und Therapie
Eine neue Option nicht nur bei Statin-Intoleranz
Evolocumab als erster PCSK9-Inhibitor nun europaweit zugelassen
Die Proproteinkonvertase Subtilisin / Kexin Typ 9 (PCSK9) reguliert das Recycling von LDL-Rezeptoren auf der Oberfläche von Leberzellen. Die Hemmung des PCSK9-Signalwegs in der Regulation des Cholesterolstoffwechsels wird daher seit einiger Zeit als Therapieoption zur Senkung des Cholesterolspiegels betrachtet.
LDL-Rezeptoren auf Hepatozyten vermitteln die Aufnahme von Cholesterol aus dem Blut in die Zellen. Nach Bindung des Apo-B-100-Proteins wird der Komplex aus LDL und Rezeptor durch Endozytose internalisiert, wobei die Vesikel im Anschluss mit Lysosomen verschmelzen. Saure Lipasen hydrolysieren sodann die Cholesterolester in Cholesterol und freie Fettsäuren. Freies Cholesterol kann nun in die Zellmembran eingebaut, zu Hormonen oder Gallensäuren weiterverarbeitet oder durch Acyl-CoA-Cholesterol-Acyltransferasen wieder als Cholesterolester, der zellulären Speicherform, abgelegt werden.
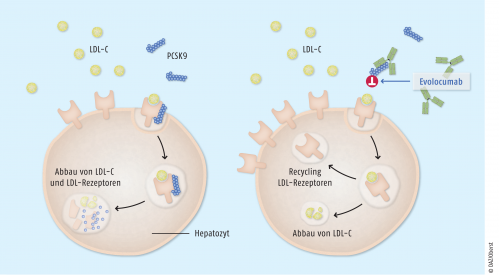
Die intrazelluläre Cholesterolkonzentration unterliegt daher strengen regulativen Mechanismen, die von der Verfügbarkeit von LDL-Rezeptoren abhängen. Der Umlauf eines Rezeptors dauert etwa zehn Minuten, und die internalisierten LDL-Rezeptoren kehren nunmehr entweder an die Zelloberfläche zurück oder werden abgebaut. Die Proproteinkonvertase PCSK9 spielt hierbei nun eine besondere Rolle, da die Bindung dieses Proteins an die LDL-Rezeptoren ihren Abbau vermittelt (Abb.). Der humane monoklonale Anti-PCSK9-IgG2-Antikörper Evolocumab (Repatha®) bindet selektiv an dieses Protein und inhibiert dessen Funktion. Das führt letztlich dazu, dass die LDL-Rezeptoren vermehrt an die Zelloberfläche zurückkehren und für die erneute Aufnahme von LDL-Cholesterol zur Verfügung stehen. Daraus resultiert eine Senkung des Cholesterolspiegels im Blut.
PCSK9. LDL-Cholesterol wird nach Bindung an seinen hepatischen Rezeptor internalisiert. Bindet gleichzeitig PCSK9 an den LDL-Rezeptor, werden LDL und der Rezeptor lysosomal abgebaut. Der Rezeptor steht nicht mehr zur Verfügung (links). Der PCSK9-Antikörper bindet zirkulierendes PCSK9 und verhindert so dessen Bindung an den LDL-Rezeptor. Ohne PCSK9 wird lediglich LDL lysosomal abgebaut, der Rezeptor wird recycelt und steht wieder zur Aufnahme von LDL-Cholesterol aus dem Blut in die Hepatozyten zur Verfügung.
Nachdem sich der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur (EMA) für eine Zulassungsempfehlung von Evolocumab ausgesprochen hat, erfolgte nun die europaweite Zulassung für die Behandlung von Patienten, die eine zusätzliche intensive LDL-Cholesterolreduktion benötigen. Indiziert ist Repatha® zur Behandlung von Erwachsenen und Jugendlichen ab 12 Jahren mit homozygoter familiärer Hypercholesterolämie in Kombination mit anderen lipidsenkenden Therapien. Weitere Indikationsgebiete für Evolocumab sind
- Erwachsene mit primärer heterozygoter familiärer und nicht-familiärer Hypercholesterolämie oder gemischter Dyslipidämie in Ergänzung zu einer Diät in Kombination mit einem Statin und ggf. weiteren Lipidsenkern sowie
- Personen, die ihre LDL-Cholesterolzielwerte mit der maximal vertretbaren Dosis eines Statins nicht erreichen bzw. intolerant gegenüber Statinen sind oder für die eine Statintherapie kontraindiziert ist.
Alle zwei Wochen oder einmal im Monat
Evolocumab wird dabei entweder einmal alle zwei Wochen (140 mg) oder einmal pro Monat (420 mg) subkutan injiziert. Repatha® ist dabei zur Selbstinjektion durch den Patienten nach angemessener Schulung vorgesehen. Sollte sich nach zwölf Wochen kein Therapieerfolg einstellen, kann die Dosis auf 420 mg alle zwei Wochen erhöht werden. Die häufigsten Nebenwirkungen umfassen Nasopharyngitis, Infektionen der oberen Atemwege, Rückenschmerzen und Arthralgien, grippeähnliche Symptome sowie Übelkeit. Bei schweren Leber- und Nierenfunktionsstörungen sollte die Applikation mit Vorsicht erfolgen, wobei ggf. eine engmaschige Überwachung erforderlich sein kann. Daten zu Wechselwirkungen mit anderen Medikamenten fehlen derzeit noch. Die Anwendung von Evolocumab bei Schwangeren ist kontraindiziert.
In bisher zwei randomisierten klinischen Studien (Open-Label Study of Long-Term Evaluation against LDL Cholesterol: OSLER-1 und OSLER-2) wurde die Langzeitsicherheit und -wirksamkeit von Evolocumab an insgesamt 4456 Patienten über median 11,1 Monate verfolgt [1]. Im Vergleich zur Standardtherapie führte die zusätzliche Behandlung mit Evolocumab zu einer Reduktion der LDL-Cholesterolwerte um 61%, von 120 mg/dl zu Studienbeginn auf 48 mg/dl. Darüber hinaus reduzierte sich die Rate an kardiovaskulären Ereignissen, inkl. Tod, Myokardinfarkt, instabiler Angina Pectoris und Hirninfarkt von 2,18% in der Standardtherapie auf 0,95% durch Evolocumab als Zusatzmedikation [HR 0,47; 95% KI, 0,28-0,78; p=0,003). Mit TAUSSIG (Trial Assessing Long Term USe of PCSK9 Inhibition in Subjects With Genetic LDL Disorders) läuft derzeit eine multizentrische, offene Fünf-Jahres-Studie zur weiteren Untersuchung der Langzeitsicherheit und -wirksamkeit von Repatha®, als Zusatz zu anderen lipidsenkenden Therapien bei Patienten mit schwerer familiärer Hypercholesterolämie einschließlich homozygoter familiärer Hypercholesterolämie.
Wer wird profitieren?
Prof. Dr. Wolfgang Koenig, Kardiologe und federführender Autor der deutschen Version ESC-Leitlinie „Dyslipidämie“
„Die primären Gruppen mit dem größten Benefit sind Patienten heterozygoter oder homozygoter familiärer Hypercholesterolämie und Statin-intolerante Patienten. Außerdem solche, die den Zielwert nicht erreichen und eine klinisch dokumentierte Progression der KHK, der Herz-Kreis‑lauf-Erkrankung oder der PAVK haben. Die amerikanischen (AHA/ACC) Leitlinien propagieren noch eine fixe Hochdosis, die der europäischen und der deutschen Gesellschaft für Kardiologie ESC/DGK empfehlen ohnehin ein Zielwert-orientiertes Vorgehen (70 mg/dl LDL-C bei Patienten mit manifester Atherosklerose). Hier lassen sich also geeignete Patienten leicht identifizieren.“
Ökonomisch problematisch
Insgesamt sehen Experten in PCSK9-Inhibitoren eine wichtige und innovative Behandlungsoption für Patienten mit unkontrollierbarem LDL-Cholesterol, die eine zusätzliche Reduktion der Serumwerte benötigen. Doch neben dieser allgemein positiven Einschätzung werden auch kritische Stimmen laut [2]. Besonders in den USA wird die Einführung dieser neuartigen, jedoch teuren Substanzklasse unter pharmakoökonomischen Gesichtspunkten als problematisch eingestuft. Denn im November 2013 veröffentlichten die American Heart Association und das American College of Cardiology (AHA/ACC) neue Leitlinien zur lipidsenkenden Therapie. Gegenüber den vorherigen amerikanischen sowie den aktuellen europäischen Leitlinien traten risikoadaptierte LDL-Cholesterol-Zielwerte in den Hintergrund. Vielmehr werden in der neuen AHA/ACC-Leitlinie nun evidenzbasierte Therapievorschläge für Statine in Abhängigkeit vom patientenindividuellen Ausgangsrisiko gemacht, was sich in der Dosis und Potenz verfügbarer Statine widerspiegelt. Entsprechend der Devise „the lower, the better“ wird laut Leitlinien bei höherem Risiko auch eine aggressivere Reduktion der LDL-Werte gefordert.
Noch im Jahr 2013 standen Statine als höchst effektive und kostengünstige Wirkstoffe mit einer Vielzahl an Generikapräparaten im Fokus der empfohlenen Behandlungsoptionen, und eine leitlinienkonforme Auswahl einer Statin-Monotherapie entsprechend des individuellen kardiovaskulären Risikos erschien vereinbar mit den geforderten Maßnahmen zur Cholesterolsenkung. Doch neuere Studien, wie die IMPROVE-IT, welche kürzlich den klinischen Zusatznutzen von Ezetimib zur Verhinderung kardiovaskulärer Ereignisse bei Hochrisikopatienten mit Statintherapie zeigen konnten [3], sowie die nun neu eingeführten, hochpreisigen Anti-PCSK9-Antikörper, die ebenfalls zu einer effektiveren Cholesterolsenkung zusätzlich zur Statintherapie beitragen, stellen die Ärzte nun vor neue Herausforderungen, eine Therapieempfehlung entsprechend der aktuellen Leitlinien abzugeben. Einige Experten befürchten nun, dass die leitlinienkonformen Vorgaben so ausgelegt werden, dass PSCK9-Inhibitoren eine breite Anwendung finden, obwohl die Unterschiede der Therapiekosten für ältere und neuere Cholesterol-senkende Arzneimittel zum Teil gravierend sind.
Rückkehr zu den Zielwerten?
Nach Möglichkeit sollten daher Maßnahmen zur Rationalisierung der verfügbaren Therapieoptionen gewährleisten, dass eine Kostenexplosion im Gesundheitssystem verhindert wird. Wichtig hierfür sind jedoch Studien zum langfristigen Vergleich der neuen PSCK9-Inhibitoren mit älteren, konventionellen Behandlungen, wie Statinen. Eine Neuanpassung der derzeit gültigen amerikanischen Leitlinien, vielleicht sogar eine Rückkehr zu risikoadaptierten LDL-Cholesterol-Zielwerten, wie es in der aktuellen europäischen Version weiterhin empfohlen wird, wäre nach Meinung von Experten notwendig, um die Finanzierbarkeit der lipidsenkenden Therapie langfristig zu sichern.
Weitere Vertreter aus der Klasse der PCSK9-Inhibitoren könnten demnächst folgen, wie Bococizumab (Pfizer) und Alirocumab (Sanofi-Aventis). Letzterer Antikörper wurde in diesem Jahr von der FDA zugelassen und ist als ergänzende Therapieoption bei heterozygoter familiärer Hypercholesterolämie indiziert. |
Literatur
[1] Sabatine, M. S., et al. (2015). „Efficacy and Safety of Evolocumab in Reducing Lipids and Cardiovascular Events.“ New England Journal of Medicine 372(16): 1500-1509.
[2] Shrank, W. H., et al. (2015). „New therapies in the treatment of high cholesterol: An argument to return to goal-based lipid guidelines.“ JAMA.
[3] Cannon, C. P., et al. (2015). „Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes.“ New England Journal of Medicine 372(25): 2387-2397.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.