
- DAZ.online
- DAZ / AZ
- DAZ 18/2021
- Biosimilars – ähnlich...
Arzneimittel und Therapie
Biosimilars – ähnlich, aber nicht gleich
Wie sich beim Switch die Adhärenz verbessern lässt
Vor mehr als 14 Jahren schauten Ärzte und Patienten bei der Zulassung des ersten Biosimilars in Europa noch skeptisch auf deren besondere Natur. Die Nachahmerpräparate der hochpreisigen Original-Biologika mussten sich gegen viele Vorurteile durchsetzen. Nach jahrelanger Erfahrung aus dem klinischen Alltag und vielen Studien zur Vergleichbarkeit und Wirksamkeit sind Biosimilars heute zu einer wirtschaftlichen und vergleichbaren therapeutischen Alternative geworden. In Deutschland waren bis zum Dezember 2020 52 Biosimilars zu 16 verschiedenen Wirkstoffen verfügbar. Darunter finden sich mit wachsendem Anteil auch monoklonale Antikörper für den onkologischen Bereich. Der aktualisierte Leitfaden der Arzneimittelkommission der deutschen Ärzteschaft behandelt die wichtigsten Punkte für den Einsatz von Biosimilars und klärt therapieentscheidende Fragen.
Biosimilars vs. Bioidenticals
Biosimilars stellen ein Nachahmerprodukt eines in der EU zugelassenen biologischen Originalpräparats (Referenzarzneimittel) dar, bei dem der Patentschutz abgelaufen ist. Anders als chemische Generika sind sie dabei nicht identisch zum Original, sondern wie der Name schon vermuten lässt, lediglich ähnlich. Sie unterstehen aufgrund ihrer Komplexität und der Art ihrer Herstellung besonderen Qualitäts- und Zulassungsvoraussetzungen. Und was ist der Unterschied zu Bioidenticals? Bei Bioidenticals sind Hersteller und Herstellungsprozess identisch. Einzig der pharmazeutische Unternehmer, der das Arzneimittel vertreibt, ist unterschiedlich. Es gibt also mehrere Fertigarzneimittel mit einem identischen Wirkstoff. Zwei prominente Beispiele: Interferon beta-1b und die dazu identischen Fertigarzneimittel Betaferon® und Extavia® oder Infliximab in Inflectra® und Remsima®.
Bedenkenloser Switch
Was ist beim „Switch“ zu beachten, also wenn Patienten von dem Originalpräparat auf ein Biosimilar umgestellt werden? Unsicherheiten bezüglich der Vergleichbarkeit und Gleichwertigkeit zwischen Biosimilar und dem Original gab und gibt es sowohl aufseiten der Ärzte als auch der Patienten. Mittlerweile hat sich jedoch die Studienlage in diesem Punkt erweitert. So gibt es eine Vielzahl an spezifischen Switch-Studien, systematischen Reviews und Metaanalysen, die Aussagen über die Sicherheit und Wirksamkeit beim Wechsel auf ein Nachahmerpräparat liefern. Und die Ergebnisse sind deutlich: Bisher konnte kein signifikanter Unterschied beim Therapieerfolg nachgewiesen werden. Dennoch obliegt die Entscheidung für eine Umstellung allein dem behandelnden Arzt, ein automatischer Austausch (Substitution) in der Apotheke darf in Deutschland aktuell nicht erfolgen. Grundsätzlich sollte die Entscheidung, ob ein Switch sinnvoll ist, stets patientenindividuell getroffen werden, um die Adhärenz des Patienten und den langfristigen Therapieerfolg nicht zu gefährden.
Bisher kein Austausch in der Apotheke
Bei der nichtärztlichen Substitution kann der Apotheker unter bestimmten Umständen, z. B. wenn es sich um therapienaive Patienten handelt, bei erstmaliger Verordnung statt dem Original das Biosimilar abgeben. Bisher ist dieses Vorgehen jedoch in Deutschland sowie in den meisten EU-Ländern unzulässig. Lediglich in Estland, Lettland, den Niederlanden, Polen und Tschechien ist dieses Prozedere unter bestimmten Voraussetzungen vorgesehen. Die Studienlage zur Sicherheit und Zweckmäßigkeit hierzu ist aber noch rar, und nur für wenige Biosimilars existieren wissenschaftliche Daten. Im Gegensatz dazu dürfen in der Apotheke schon jetzt „Bioidenticals“ (s. Kasten „Biosimilars vs. Bioidenticals“) laut Rahmenvertrag automatisch ausgetauscht werden. Mit dem Gesetz für mehr Sicherheit in der Arzneimittelversorgung, das im August 2019 in Kraft getreten ist, stehen jedoch ab August 2022 Änderungen an, die direkt am HV-Tresen spürbar werden können.
Rabattverträge ab August 2022
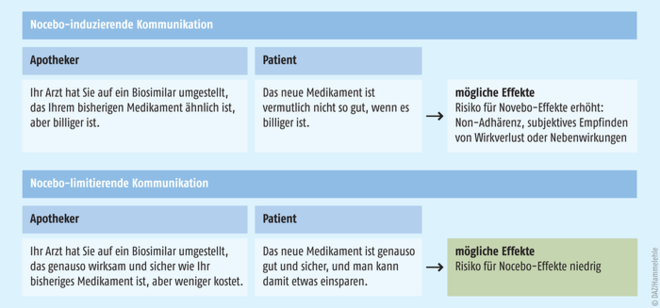
Das neue Gesetz weitet die Aut-idem-Regelung auf biologische Arzneimittel aus; unter der Voraussetzung, dass der Gemeinsame Bundesausschuss zuvor die Austauschbarkeit der Wirkstoffe nach festgelegten Kriterien bestätigt hat. Eine Liste hierzu hat der Gemeinsame Bundesausschuss bereits veröffentlicht. Das Wirtschaftlichkeitsgebot gilt dann für die Umstellung des Originalpräparats auf eines seiner Biosimilars, aber auch für den Austausch der Biosimilars untereinander. In Zukunft wird es also auch Rabattverträge der Krankenkassen für Biologika geben, die von der Apotheke eingehalten werden müssen. Diese Änderung wird von der Arzneimittelkommission der deutschen Ärzteschaft und der Bundesärztekammer sehr kritisch gesehen, daher haben sie sich mehrfach deutlich gegen die Ausweitung der Aut-idem-Regelung ausgesprochen. Sie fordern, dass die Entscheidung über einen Austausch Sache des Arztes und nicht des Rabattvertrags sein soll. Nichtsdestotrotz ist es wichtig, den Patienten fachkompetent am HV-Tresen abzuholen und gemeinsam mit dem Arzt für eine gute Therapieadhärenz zu sorgen. Es ist ratsam, dem Patienten die Gründe für die Umstellung zu erläutern und klarzumachen, dass ein Biosimilar dem Original in nichts nachsteht (s. Grafik). Besonderes Augenmerk sollte in der pharmazeutischen Beratung darauf gelegt werden, ob der Patient mit den unterschiedlichen Fertigarzneimitteln, z. B. Änderungen in der Applikation, vertraut ist.
Abb.: Die aktualisierte Leitlinie gibt Tipps, wie sich mit einer bewussten Wortwahl in der Beratung die Adhärenz der Patienten verbessern lässt. [modifiziert nach Colloca et al. 2019]
Nach dem Switch keine Wirkung mehr?
Die Leitlinie geht auch auf die in vergangenen Studien beobachteten erhöhten Therapieabbruchraten unter Teilnehmern ein, die von einem Original auf ein Biosimilar geswitcht wurden. Eine Erklärung für das beobachtete Phänomen findet sich in den sogenannten Nocebo-Effekten. Teils unerklärliche Wirkverluste, Symptomverschlimmerung und ein gehäuftes Auftreten von Nebenwirkungen werden darauf zurückgeführt. Nocebo-Effekte sind nicht objektivierbar, sondern als Gegenspieler zum Placebo-Effekt zu verstehen. Es ist also stark vom psychosozialen Kontext und der Erwartungshaltung des Patienten abhängig. Dabei spielt auch die Einstellung des Arztes und des Apothekers gegenüber Biosimilars eine nicht zu unterschätzende Rolle. Es ist daher wichtig, dass Patienten während der Umstellung eng von ihrem behandelnden Arzt und Apotheker betreut werden, ausreichend Informationen erhalten und ihre möglichen Bedenken ausführlich besprechen können. Die Arzneimittelkommission der deutschen Ärzteschaft hat hierfür unterstützend eine Patienteninformation in leicht verständlicher Sprache verfasst, die auf der Homepage heruntergeladen werden kann.
Ökonomische Aspekte nicht unterschätzen
Biosimilars sind vor allem auch im Hinblick auf die Kostenentwicklung im Gesundheitssystem für die Zukunft wichtig. Untersuchungen haben gezeigt, dass bereits im Jahr 2019 durch die Verordnung und Abgabe von Biosimilars rund 460 Millionen Euro in der gesetzlichen Krankenversicherung eingespart wurden. Man geht davon aus, dass das tatsächlich erreichbare Einsparpotenzial sogar noch höher liegt: Bei konsequenter Verordnung könnten sogar bis zu 790 Millionen Euro an Arzneimittelkosten eingespart werden und die Solidargemeinschaft dementsprechend entlasten. |
Literatur
Leitfaden der AkdÄ zu Biosimilars, 2. Auflage, Version 1.0, Januar 2021





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.