
- DAZ.online
- DAZ / AZ
- DAZ 5/2022
- Vorreiter Ensovibep
Pandemie Spezial
Vorreiter Ensovibep
Die neue DARPin-Technologie eröffnet Perspektiven im Kampf gegen COVID-19
Vor Kurzem gaben die Firmen Molecular Partners und Novartis den positiven Abschluss der Phase-IIa-Studie EMPATHY zur Wirkung ihres Arzneistoffes Ensovibep (MP0420) zur Behandlung nicht-hospitalisierter COVID-19-Patienten bekannt. Dieses Ergebnis war hinsichtlich einiger jüngst negativ ausgefallener Studienergebnisse zur Bekämpfung von SARS-CoV-2 durch eine Blockierung der Virusbindung nicht unbedingt anzunehmen. Es wirft aber nun ein erwartungsvolles Licht auf diesen Arzneistoff.
Das rekombinante Protein Ensovibep ist ein struktureller Vertreter der DARPin-Technologie, die mit großen Versprechungen, aber auch hohen Erwartungen an sie als die neue Generation von Bindeproteinen startete, weil sie in vielfältiger Weise den therapeutischen Antikörpern überlegen sein könnte. Im Folgenden soll kurz zu dieser Studie unter Vorstellung der DARPin-Technologie Bezug genommen werden.
Agiert wie ein Antikörper
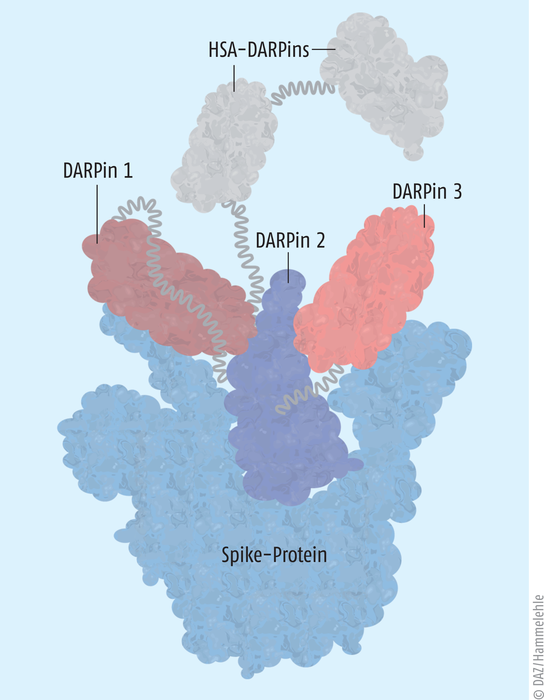
Ensovibep ist ein modular aufgebautes, rekombinant hergestelltes Protein, welches drei verschiedene Domänen zur Bindung an das virale Spike-Protein aufweist und somit die zelluläre Adhäsion und Internalisierung von SARS-CoV-2 in die Wirtszellen unterdrückt (s. Abb.). Damit folgt Ensovibep funktionell dem Prinzip jener Antikörper, die zur „Virus-Neutralisierung“ als Adhäsionshemmer in diesem Kontext schon verschiedentlich klinisch erprobt wurden. Ensovibep unterscheidet sich jedoch strukturell deutlich von Antikörpern, darauf soll nachfolgend noch detaillierter eingegangen werden.
Abb. Ensovibep besteht aus fünf DARPins: Zwei DARPins, die an das humane Serumalbumin (HSA) binden und die DARPins 1 bis 3, die jeweils eine andere funktionelle Domäne des viralen Spike-Proteins besetzen. So wird die zelluläre Adhäsion des SARS-CoV-2 behindert und in der Folge das Eindringen des Virus in die Wirtszellen. Damit fehlen die Voraussetzungen für eine effektive Virusvermehrung. Erfolgversprechend erscheint dieser Ansatz vor allem im Frühstadium einer COVID-19-Erkrankung.
Phase-II-Studie weckt Hoffnung
Funktionell scheint diese Hoffnung, die mit der Virushemmung von Ensovibep verbunden ist, nun auch aufgegangen zu sein. In der doppelblinden, randomisierten Phase-II-Studie EMPATHY wurde die Wirksamkeit einer einmaligen Infusion von Ensovibep versus Placebo an 407 akut erkrankten und ambulant versorgten COVID-19-Patienten untersucht, wobei Ensovibep in drei unterschiedlichen Wirkstärken (75 mg, 225 mg und 600 mg) zum Einsatz kam [1]. Die drei Behandlungsgruppen sowie der Placebo-Arm (99 Patienten) waren dabei hinsichtlich demographischer Aspekte und der Krankheitsparameter ausbalanciert. Der primäre Endpunkt der Studie, eine signifikante Senkung der Viruslast der Patienten, wurde im Behandlungsarm bei allen drei Konzentrationen erreicht. Auch beim sekundären Endpunkt überzeugte der Wirkstoff mit einer ca. 78%igen Senkung der Hospitalisierungsrate, der notwendigen intensivmedizinischen Betreuung der Patienten oder reduzierten Todesfolgen der Erkrankung. Während in den drei Behandlungsarmen (301 Patienten) vier Ereignisse (Hospitalisierung, kein Todesfall) auftraten, ereigneten sich in der Placebo-Gruppe sechs Ereignisse (Hospitalisierung, zwei Todesfolgen). Alle drei Konzentrationen wurden von den Patienten gut vertragen, es traten keine sicherheitsrelevanten Probleme oder Einschränkungen beim Einsatz auf, so dass in der Fortführung des EMPATHY-Studienprogramms auf die geringste Dosierung von 75 mg gesetzt wird [1]. Für diese Phase-IIb-Studie sollen weitere 1700 COVID-19-Patienten rekrutiert werden, wenn diese unabhängig von ihrem Impfstatus einen Infektionsnachweis sowie mindestens zwei milde bis moderate Krankheitssymptome aufweisen. Ergebnisse werden zur Jahresmitte oder zumindest vor Jahresende 2022 erwartet.
Im Spätstadium wirkungslos?
Diese positive Entwicklung des Ensovibep erschien noch vor ca. drei Monaten in weite Ferne gerückt, denn in einer weiteren Studie (ACTIV-3), die allerdings auf schwer erkrankte, hospitalisierte COVID-19-Patienten fokussierte, konnte Ensovibep nicht mit Wirksamkeit überzeugen und fiel im November 2021 aus der Studie heraus. In dieser, vom National Institute of Health (NIH) initiierten und gesponserten Studie, kamen mehrere Wirkstoffkandidaten zusätzlich zur Standardbehandlung mit Remdesivir zum Einsatz. Neben Ensovibep wurden aber auch die Versuche mit Virus-bindenden Antikörpern von Eli Lilly (LY3819253), GlaxoSmithKline (VIR-7831, Sotrovimab), Astra-Zeneca (AZD7442) sowie Brii Biosciences (Amubarvimab/Romlusevimab; BRII-196/BRII-198) gestoppt und eine Fortführung der Studie nicht mehr empfohlen [2]. Dies warf die generelle Frage auf, inwieweit man durch Unterdrückung der Virusbindung überhaupt erfolgreich in Krankheitsverlauf und Progression intervenieren kann. Die Studien legen nahe, dass im fortgeschrittenen Krankheitsstatus oder bei schweren Verlaufsformen durch die Dominanz der inflammatorischen Gesamtsituation hier nur bedingt über eine Unterdrückung der Virusbindung antagonisiert werden kann, so auch die Erklärung seitens der Ensovibep-Entwickler [3]. Zu einem früheren Erkrankungszeitpunkt oder bei moderateren Verläufen hingegen, so zeigt es ja nun die EMPATHY-Studie, offensichtlich schon. Über einen Erfolg scheint aber die Art der Bindung des Wirkstoffes am Virus, und damit die Bindungskompetition von großer Bedeutung zu sein.
Die DARPin-Technologie
Ensovibep repräsentiert in seiner Struktur ein Designed Ankyrin Repeat Protein (DARPin). DARPins sind rekombinant erzeugte Proteine, die über eine Anzahl sogenannter Ankyrin-Repeat Motive in linearer Aneinanderreihung verfügen. Diese Motive, die den Namen vom Zytoskelett-bindenden Protein Ankyrin erhielten, sind im natürlichen Proteinaufbau häufig zu finden und dienen mit ihrer aus 33 Aminosäuren aufgebauten konservierten Struktur (zwei α-Helices und ein β-Turn) als Bindungsverstärker. Vor über 15 Jahren entstand die Idee, durch eine rekombinante Aneinanderreihung solcher Domänen künstliche hochaffine Bindeproteine zu erschaffen, die im medizinischen Kontext als Agonisten oder Antagonisten ein nahezu unendliches Spektrum an Targetaktivitäten entfalten könnten [4]. Die Entwicklung dieser „Antikörper-Mimetika“ wurde entscheidend durch die Schweizer Biotech-Firma Molecular Partners vorangetrieben, die für verschiedene klinische Entwicklungen Allianzen mit großen Pharma-Unternehmen eingegangen ist. DARPin-Moleküle weisen, eingefasst durch zwei konservierte Ankyrin-Repeats (N-Cap und C-Cap) eine Anzahl (zumeist drei bis fünf) modifizierter Repeats auf, die charakteristische Bindungseigenschaften steuern.
DARPins bieten viele Vorteile
Zeigen diese DARPins eine identische oder sogar höhere Bindungsaffinität gegenüber Antikörpern, so sind sie diesen in vielen Charakteristika offensichtlich deutlich überlegen. Ihr wesentlich geringeres Molekulargewicht, denn ein aus fünf Domänen aufgebautes DARPin repräsentiert mit ca. 14 kDa nur ca. ein Zehntel der Masse eines Antikörpers, sowie der einfache modulare Aufbau erbringen einerseits eine größere physikalische Stabilität der Konstrukte. Dies äußert sich insbesondere in einer höheren Thermostabilität: DARPins denaturieren ihre Struktur erst bei Temperaturen über 60 °C. Andererseits können sie auch deutlich einfacher und schneller als Antikörper in besser handhabbaren Expressionssystemen wie E-coli-Zellen hergestellt werden.
Viele Kombinationsmöglichkeiten
Da ohne strukturelle Veränderungen innerhalb der Repeat-Einheiten an sieben Positionen Aminosäuren ausgetauscht werden können, die dann einen starken Einfluss auf die Bindungsselektivität und Affinität entfalten, können unendlich viele Repeats mit unterschiedlichen Bindungseigenschaften erzeugt werden. Die Auswahlmöglichkeiten der Bindedomänen aus Strukturbibliotheken und die funktionellen Selektionsmechanismen über beispielsweise Phagen-Displays erscheinen im Licht des einfachen Strukturaufbaus und der Kombinierbarkeit der Repeats unendlich groß [5]. So können innerhalb eines DARPins dann auch mehrere Motive mit Selektivität für unterschiedliche Bindungsdomänen am gleichen Zielprotein kombiniert werden. Daraus resultiert nicht nur eine hohe Affinität, sondern auch die Chance zur Aufrechterhaltung der Effektivität bei mutagenen Veränderungen im Zielprotein. Dies erscheint beim Targeting von Viren von herausragender Bedeutung und übertrifft so die im Fall einer Antikörperanwendung häufig genutzten Kombinationen oder sogar „Antikörpercocktails“ rational und funktionell bei Weitem.
Ensovibep mit fünf Ankyrin-Repeats
Ensovibep weist in seiner Struktur fünf Ankyrin-Repeats auf, von denen drei eine Bindungsaffinität zu unterschiedlichen Bereichen des Spike-Proteins des SARS-CoV-2 Virus aufweisen und so die Rezeptorbindungsdomäne funktionell attackieren (siehe Abbildung). Durch diese Variabilität erscheint das Konstrukt unabhängiger gegenüber viralen Mutationen, In-vitro-Studien zufolge verfügt Ensovibep über eine gleichartige Bindungsaffinität an die bisher dominierenden Varianten des SARS-CoV-2, inklusive der Omikron-Variante. Die zwei weiteren terminalen Domänen besitzen eine Bindungsselektivität für humanes Serumalbumin. Dies sichert nach Infusion des Wirkstoffes eine längere Verweilzeit im Blut der Patienten und erhöht damit die Chance zur Targetierung der Viren und deren funktionelle Beeinträchtigung.
FDA-Notfallzulassung beantragt
Wie kann und wird es weitergehen mit Ensovibep für die Therapie des Corona-Virus? Nach dem erfolgreichen Teil A der EMPATHY-Studie will Novartis nun den Wirkstoff aus der Allianz mit Molecular Partners einlizensieren und damit federführend die Verantwortung für die weitere Entwicklung und Kommerzialisierung von Ensovibep übernehmen [6]. Der zweite Teil der EMPATHY-Studie ist in einem größeren Patientenkollektiv angelaufen. Um den beschleunigten Zugang zum Arzneimittelmarkt zu erreichen wird zunächst ein Notfallzulassungsverfahren bei der FDA angestrebt. Wie auch immer dies ausgehen mag, Ensovibep ist als ein Vorreiter einer innovativen Strategie innerhalb der Biologica der Öffentlichkeit bekannt geworden und eröffnet vielleicht auch einen neuen Beitrag, die Folgen der COVID-19-Pandemie für bestimmte Patientenkreise besser zu bewältigen. Zumindest aber wird dies nicht der einzige Aspekt bleiben, der die DARPin-Technologie in Medizin und Pharmazie im Gespräch hält. Weitere klinische Studien sind auf anderen Gebieten angelaufen. Gemeinsam mit Amgen wird seitens Molecular Partners ein immunonkologischer Ansatz verfolgt [7], andere onkologische Studien laufen [8,9]. Eine automatische Erfolgsgarantie haben DARPins jedoch nicht, eine gegen VEGF-gerichtete und zugelassene DARPin-Struktur zur ophthalmologischen Behandlung der Makuladegenerierung wurde kürzlich wegen entzündlichen Nebenwirkungen seitens der FDA zurückgezogen [10]. |
Literatur
[1] Molecular Partners Press Release EMPATHY Studienergebnis: https://investors.molecularpartners.com/news-releases/news-release-details/molecular-partners-and-novartis-report-positive-topline-data/
[2] ACTIV-3 Studie: https://clinicaltrials.gov/ct2/show/NCT04501978
[3] Stellungnahme Molecular Partners; Ensovibep zur Teilnahme an ACTIV-3 Studie gestoppt: https://investors.molecularpartners.com/news-releases/news-release-details/molecular-partners-provides-update-activ-3-global-clinical-study/
[4] Stumpp MT, Amstutz P. DARPins: a true alternative to antibodies. Curr Opin Drug Discov Devel. 2007;10(2):153-9.
[5] Plückthun A. Designed ankyrin repeat proteins (DARPins): binding proteins for research, diagnostics, and therapy. Annu Rev Pharmacol Toxicol 2015;55:489-511. doi: 10.1146/annurev-pharmtox-010611-134654.
[6] Ausblick Norvartis zur Entwicklung von Ensovibep: https://www.novartis.com/news/media-releases/novartis-and-molecular-partners-report-positive-topline-data-from-phase-2-study-ensovibep-mp0420-darpin-antiviral-therapeutic-COVID-19
[7] Kooperation mit Amgen zur Immunonkologie, Entwicklung von MP0310: https://www.bio-technopark.ch/news/molecular-partners-vereinbart-partnerschaft-mit-amgen/
[8] Baird RD, Linossi C, Middleton M et al., First-in-Human Phase I Study of MP0250, a First-in-Class DARPin Drug Candidate Targeting VEGF and HGF, in Patients With Advanced Solid Tumors. J Clin Oncol. 2021;39(2):145-154.
[9] van den Brand D, van Lith SAM, de Jong JM, et al. EpCAM-Binding DARPins for Targeted Photodynamic Therapy of Ovarian Cancer. Cancers (Basel). 2020;12(7):1762.
[10] Mullard A. Nature Reviews Drug Discovery 2020;19:501.























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.