
- DAZ.online
- News
- Hürden für Hersteller ...
Arzneimittel für Kinder
Hürden für Hersteller nicht zu hoch setzen
Beim Bundesverband der Arzneimittel-Hersteller und der Initiative Arzneimittel für Kinder begrüßt man ausdrücklich, dass der G-BA Propranolol einen erheblichen Zusatznutzen zugesprochen hat. Erstmalig vergab das Gremium für einen Wirkstoff die Bestnote – und zwar für einen mit PUMA-Zulassung, also zur pädiatrischen Verwendung. Gleichzeitig weisen die beiden Verbände darauf hin, dass die Hürden für die Zulassung von Kinderarzneimitteln nicht unnötig hoch gesetzt werden sollten.
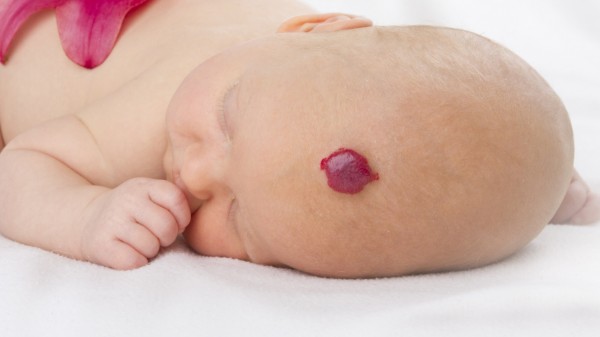
Für eine Patientengruppe, nämlich Kinder mit einem Hämangiom, bei dem die Gefahr von bleibenden Narben oder Entstellung besteht, sprach der G-BA Propranolol (Hemangiol®/Pierre Fabre) einen erheblichen Zusatznutzen zu. Für Kinder mit lebens- oder funktionsbedrohendem Hämangiom sowie Kinder mit ulzeriertem Hämangiom, das Schmerzen verursacht und/oder nicht auf einfache Wundpflegemaßnahmen anspricht, attestierte der G-BA einen nicht quantifizierbaren Zusatznutzen. Die Bestnote sei zu begrüßen, teilen BAH und IKAM in einer gemeinsamen Mitteilung mit.
Wie zuvor der G-BA-Vorsitzende Josef Hecken halten es die Verbände für besonders erfreulich, dass trotz der besonderen Aufwendungen, die Studien an Kindern erfordern, aussagekräftige Daten ermittelt und berücksichtigt werden konnten. BAH und IKAM regen aber gleichwohl an, im Rahmen der Nutzenbewertung von Kinderarzneimitteln den Zusatznutzen als belegt anzusehen, wenn diese das nach europäischem Recht gesonderte Zulassungsverfahren für die pädiatrische Verwendung (Pediatric Use Marketing Authorisation – PUMA) erfolgreich abgeschlossen haben.
Kinderarzneimittel wie Orphan Drugs behandeln
Zwar sei die Zulassung eines Kinderarzneimittels zurecht mit hohen regulatorischen Anforderungen verbunden, konstatiert BAH-Hauptgeschäftsführer Dr. Martin Weiser. Zusätzlich zum zugelassenen „Erwachsenenarzneimittel“ müssten Hersteller umfangreiche pädiatrische Studien und Konzepte bei der Europäischen Arzneimittel-Agentur vorlegen. Allerdings sei mit dem Erhalt der PUMA-Zulassung der Zusatznutzen des Kinderarzneimittels bewiesen – der Zusatznutzen sollte daher nicht in einem weiteren Verfahren erneut belegt werden müssen. „Vielmehr sollte die frühe Nutzenbewertung des G-BA nur noch das Ausmaß des Zusatznutzens bewerten“, fordert Weiser.
Nach Meinung des IKAM-Vorsitzenden Dr. Markus Rudolph sollte das gemeinsame Ziel aller Beteiligten sein, möglichst gute Zugangsvoraussetzungen für Kinderarzneimittel zu schaffen. Wie bei Arzneimitteln zur Behandlung seltener Krankheiten – den Orphan Drugs – sei davon auszugehen, dass es für die Behandlung bei Kindern und Jugendlichen keine therapeutisch gleichwertige Alternative gebe. „Daher ist eine erteilte PUMA-Zulassung als Zusatznutzen in der pädiatrischen Bevölkerungsgruppe anzuerkennen“, fordert auch er.

























Berlin - 20.02.2015, 14:33 Uhr