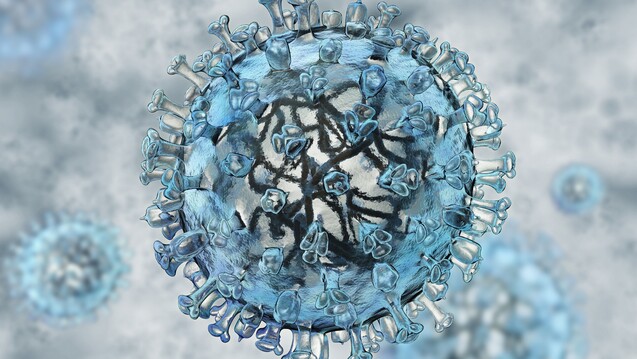
Wie wirkt Baloxavir marboxil?
Baloxavir marboxil nutzt als Virustatikum einen bei Influenzaviren bislang nicht therapeutisch verwendeten Angriffspunkt: Baloxavir hemmt die CAP-abhängige Endonuklease und somit einen der ersten Schritte im Replikationszykus des Influenzavirus.
Influenzaviren werden mittels Endozytose in die Wirtszelle aufgenommen. Anschließend erfolgt die Freisetzung des viralen Ribonukleoproteins ins Zytosol und in der Folge der Import in den Nucleus. Dort findet – neben der Replikation viraler RNA – die Transkription des Influenzagenoms in virale mRNA statt.

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.