
- DAZ.online
- News
- Mehrere Wirkstoffe in ...
Genau getimt
Mehrere Wirkstoffe in einem Medikament – dank künstlicher DNA
Düsseldorf - 10.07.2019, 09:00 Uhr

Mit farbigen Bällen und Pfeifenreinigern veranschaulichen Prof. Oliver Lieleg und Doktorandin Ceren Kimna, wie DNA-Stücke Nanopartikel miteinander verbinden können. (Foto: Uli Benz / TU Muenchen)
Forscher der TU München arbeiten an einer Methode, mit einer Gabe gleich drei Wirkstoffe zu verabreichen, die zu festen Zeitpunkten nacheinander freigesetzt werden. Die Gruppe um Professor Oliver Lieleg nutzt dazu die Eigenschaften von künstlicher DNA.
Dass Patienten mehrere Wirkstoffe einnehmen müssen, zu unterschiedlichen Zeiten, ist nichts Ungewöhnliches. Auch dass mehrere Wirkstoffe in Kombination in einem Medikament gegeben werden können, ist wenig überraschend. Neu allerdings ist eine Methode, mit der sehr spezifisch derzeit bis zu drei verschiedene Wirkstoffe in einer Gabe verabreicht werden können, die passgenau nacheinander in vorgegebener Reihenfolge und zu vorgegebenem Zeitpunkt freigesetzt werden.
Der Professor für Biomechanik Oliver Lieleg an der Munich School of BioEngineering an der Technischen Universität München und seine Doktorandin Ceren Kimna haben jetzt die Ergebnisse ihrer Arbeit an dem neuentwickelten Verfahren veröffentlicht (Engineering an orchestrated release avalanche from hydrogels using DNA-nanotechnology): Sie verwenden dazu eine Kombination aus Hydrogelen, künstlicher DNA und Nanopartikeln. „So könnte zum Beispiel eine Salbe, die auf eine Operationswunde aufgetragen wird, Schmerzmittel, Entzündungshemmer und abschwellend wirkendes Mittel nacheinander freisetzen“, erklärt Lieleg das Prinzip. Herkömmliche Präparate, die ihre Wirkstoffe retardiert, also verzögert freisetzen, könnten im Gegensatz zum Verfahren der Münchener nicht garantieren, „dass nicht zeitweise mehrere Wirkstoffe gleichzeitig in den Organismus gelangen“, sagt der Professor.
Silber-, Eisenoxid- und Gold-Partikel im Modellversuch
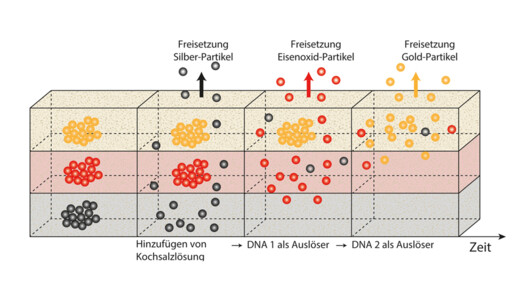
In den Arbeiten von Kimna wurde zunächst das Prinzip getestet. Dazu verwendeten die Forscher Nanopartikel aus Silber, Eisenoxid und Gold, die sich spezifisch spektroskopisch nachweisen ließen. Die Partikel betteten sie in ein Hydrogel ein. Als Steuerungselement der Wirkstofffreigabe nutzten die Forscher künstliche DNA und deren Eigenschaft, genau bestimmen zu können, wie stark und auf welche Weise sich deren Abschnitte miteinander verbinden.
So konstruierten die Wissenschaftler DNA-Stränge, die mit den Silberpartikeln komplexierten und einen großen Teilchen-Cluster bildeten. Dieser war so groß, dass er sich in dem Hydrogel nicht bewegen konnte. Die Zugabe von Kochsalzlösung initiierte dann die Ablösung der Partikel von der DNA, die sich dann zur Geloberfläche bewegten. „Da die Kochsalzlösung ungefähr denselben Salzgehalt hat wie der menschliche Körper, konnten wir so simulieren, dass die Wirkstoffe erst bei Anwendung des Präparats frei werden“, sagt Kimna.
Als zweite „Schicht“ sollten in dem Modellversuch die Eisenoxid-Partikel freigesetzt werden. Diese waren durch zwei Arten von DNA verbunden, wobei die eine an einem Ende mit den Partikeln verbunden war während die andere DNA die Abschnitte miteinander verband. Diese Verbindung ist von der Salzkonzentration unabhängig. Die in der ersten Schicht von den Silberpartikeln freigesetzten DNA-Stücke verdrängen schließlich die Verbindungs-DNA und setzen so zeitlich nach dem Silber das Eisenoxid frei.
In der dritten Phase verdrängt wiederum die freigesetzte Verbindungs-DNA der Eisenoxid-Schicht nun spezifisch die Verbindungs-DNA der Gold-Phase, welches als dritter Modell-Wirkstoff zeitlich als letztes freigesetzt wird.


















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.