
- DAZ.online
- News
- Spektrum
- Ein Gang durch die ...
150 Jahre Periodensystem der Elemente
Ein Gang durch die Entstehungsgeschichte dieser berühmtesten Tabelle der Welt
Hofheim am Taunus - 30.12.2019, 16:30 Uhr

Das Periodensystem der Elemente hat für das Verständnis der Chemie eine ähnliche fundamentale Bedeutung wie die Evolutionstheorie für die Biologie. (m / Foto: Tomasz Zajda / stock.adobe.com)
2019 wurde durch die UNESCO und die Generalversammlung der Vereinten Nationen das Jahr des Periodensystems der Elemente ausgerufen. Anlass ist das 150-jährige Jubiläum der ‚Erst‘beschreibung dieser Sequenz der chemischen Elemente. Anlass genug, sich die Entstehungsgeschichte der berühmtesten Tabelle der Welt einmal anzusehen.
Derzeit sind 118 chemische Elemente bekannt, die sich aufgrund ihrer elektrischen Leitfähigkeit unterteilen lassen in: Metalle - Halbmetalle - Nichtmetalle. Diese Klassifizierung sagt aber wenig aus über die weiteren sich periodisch ändernden Eigenschaften der Elemente und den sich daraus ableitenden Gesetzmäßigkeiten.
Bereits Anfang des 19. Jahrhunderts wurden vom Schotten William Prout und den deutschen Chemikern Wolfgang Döbereiner in Jena und Leopold Gmelin in Heidelberg erste Versuche unternommen, die zu ihrer Zeit bekannten 53 Elemente aufgrund ihrer Atommasse (Atomgewicht) zu ordnen. Um 1864 erkannte der Brite John A. R. Newlands, dass sich bei Anordnung der Elemente nach steigender Atommasse die chemischen Eigenschaften in jeder achten Position wiederholten. Er nannte seine Entdeckung das „Gesetz der Oktaven“, ein Vorläufer der heutigen Oktettregel, obwohl zur damaligen Zeit die Edelgase noch nicht bekannt waren.
Mehr zum Thema

Das Periodensystem der Elemente – eine pharmazeutische Würdigung des Jubilars
Happy Birthday, PSE!
Triadenregel bildete die wichtigste Grundlage
Die Triadenregel von Döbereiner bildete sicherlich die wichtigste Grundlage für das im Jahr 1869 von Dimitri Mendelejew (Russland) und Lothar Meyer (Deutschland) unabhängig voneinander entwickelte Periodensystem der Elemente (PSE) aufgrund steigender Atommassen. Dabei besitzt Mendelejew in der Fachwelt die größere Wertschätzung, weil er seine Anordnung nicht nur zur Voraussage neuer, noch unbekannter Elemente nutzte, sondern erstmals auch den Begriff der „Periodizität“ für die sich kontinuierlich ändernden Eigenschaften der chemischen Elemente prägte. Beide zusammen erhielten 1882 die von der britischen Royal Society verliehene Davy-Medaille, die damals höchste Auszeichnung für einen Chemiker.
Das Periodensystem der Elemente hat für das Verständnis der Chemie eine ähnliche fundamentale Bedeutung wie die Evolutionstheorie Darwins für die Biologie. Deshalb haben die Vereinten Nationen und die UNESCO das Jahr 2019 zum Jahr des PSE ausgerufen.
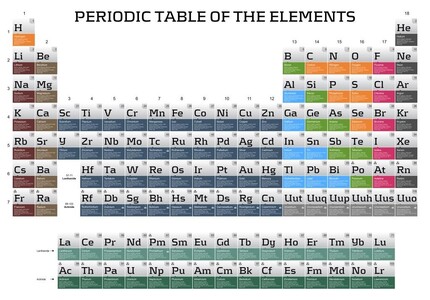
Das von Mendelejew skizzierte Periodensystem der Elemente (Abb.) motivierte den dänischen Quantenpionier Nils Bohr, sein nach ihm benanntes Atommodell zu entwickeln, weil er das Periodensystem der chemischen Elemente besser verstehen wollte.
Das PSE nach Mendelejew war somit auch – ausgehend vom Bohrschen Schalenmodell – die Geburtsstunde der Quantenchemie und führte schließlich dazu, dass heute die Ordnungszahl (Kernladungszahl) und damit auch in einem neutralen Atom die Elektronenzahl in der Atomhülle das bestimmende Ordnungsprinzip für die tabellarische Anordnung der Elemente darstellt (Abb.). Dies stimmt auch mit dem Elementbegriff überein, nach dem ein Element eine Ansammlung von Atomen ist, die alle die gleiche Zahl an positiv geladenen Protonen in ihrem Atomkern besitzen.
Ursache, die Kernladungszahl als Ordnungsprinzip zu wählen, war, dass die von Mendelejew entworfene Anordnung der Elemente nach steigender Atommasse an mehreren Stellen aufgrund der Eigenschaften des betreffenden Elements korrigiert werden musste. In der Regel ist die relative Atommasse des Elements zur rechten größer. Ausnahmen von dieser Regel nennt man Inversionen [Argon (Ar) vor Kalium (K) - Tellur (Te) vor Iod (I) - Cobalt (Co) vor Nickel (Ni) - Thorium (Th) vor Protactinium (Pa)].
Anordnung des PSE
In der heutigen Form des PSE sind die 118 bekannten chemischen Elemente nach steigender Kernladungszahl (Ordnungszahl) in 7 Perioden (waagrecht) und 16 Gruppen (senkrecht) geordnet und werden mit einem ein- oder zweibuchstabigen Elementsymbol abgebildet. Innerhalb einer Periode steigt die Ordnungszahl (Kernladungszahl) jeweils um 1 an. Die Perioden werden mit arabischen Ziffern gekennzeichnet.
Früher unterteilte man die 16 Gruppen in 8 Hauptgruppen (Valenzelektronen in der äußersten Schale) und 8 Nebengruppen (Valenzelektronen in der äußersten und zweitäußersten Schale). Als Valenzelektronen bezeichnet man die Elektronen in der Atomhülle, die vorrangig für die chemischen Eigenschaften des betreffenden Elements verantwortlich sind. Bei den Lanthanoiden und Actinoiden fungiert auch die drittäußerste Schale als Valenzschale. Die 16 Gruppen wurden mit römischen Zahlen gekennzeichnet, wobei zur Kennzeichnung der Hauptgruppe ein „a“ und zur Kennzeichnung der Nebengruppe ein „b“ der Gruppennummer hinzugefügt wurde. Da nach dem Bohrschen Atommodell in der 3. Schale (M-Schale) 18 Elektronen untergebracht werden mussten, führte dies dazu, dass die VIII. Nebengruppe drei Elemente enthielt [z.B. Eisen (Fe) - Cobalt (Co) - Nickel (Ni)].
Hauptgruppen und Valenzorbitale
Daher hat die International Union of Pure and Applied Chemistry (IUPAC) empfohlen, die Gruppen des PSE durchgehend zu nummerieren und mit den arabischen Zahlen von 1-18 zu belegen.
Elemente, die in der gleichen Gruppe stehen, verhalten sich chemisch ähnlich und werden als homologe Elemente bezeichnet. Einige Hauptgruppen (HG) des PSE tragen Trivialnamen: 1.HG: Alkalimetalle - 2.HG: Erdalkalimetalle - 3.HG: Erdmetalle - 6.HG: Chalkogene (Erzbildner) - 7.HG: Halogene (Salzbildner) - 8.HG: Edelgase. Die 4.HG „Kohlenstoff-Gruppe“ und die 5.HG „Stickstoff-Gruppe“ werden jeweils nach dem ersten Element dieser Gruppe bezeichnet.
Die Elektronen eines Atoms besetzen bestimmte wahrscheinliche Aufenthaltsräume, die man Atomorbitale nennt. Je nach der räumlichen Gestalt der Orbitale für die Valenzelektronen kann man die Elemente auch unterteilen in die s-Elemente der 1. und 2.HG [s kennzeichnet die kugelförmige Gestalt des Valenzorbitals], p-Elemente der 3. bis 8.HG [p kennzeichnet die hantelförmige (keulenförmige) Gestalt des Valenzorbitals] und d-Elemente der Nebengruppen [d kennzeichnet die rosettenförmige Gestalt des Valenzorbitals]. Die Lanthanoiden und Actinoiden bilden den Block der f-Elemente, deren Valenzorbitale von komplexer Gestalt sind.
Wann werden neue Elemente aufgenommen?
Neue Elemente erhalten erst dann einen bleibenden chemischen Namen und damit ein Elementsymbol, wenn ihre Existenz bestätigt wurde. Die Namen werden von der IUPAC festgelegt, wobei die Entdecker ein Vorschlagsrecht besitzen. Daher leiten sich die Namen vieler Elemente von Kontinenten [Americium (Am), Europium (Eu)], Ländern [Californium (Cf), Hassium (Hs), Nihonium (Nh), Gallium (Ga), Polonium (Po) …], Städten [Darmstadtium (Ds), Dubnium (Db), Moscovium (Mc), Lutetium (Lu) …], Planeten [Uran (U), Neptunium (Np), Plutonium (Pu) …] und Göttern [Thorium (Th), Titan (Ti), Promethium (Pm) …] ab oder es werden bedeutende Wissenschaftler dadurch geehrt, dass ein neues Element nach ihnen benannt wird [Curium (Cm), Mendelevium (Md), Roentgenium (Rg), Meitnerium (Mt), Fermium (Fm) …].
Bis zur Festlegung eines endgültigen Namens erhalten neue Elemente einen vorläufigen Namen, dem die Protonenzahl zugrunde liegt, die einzelnen Ziffern dieser Zahl werden fortlaufend durch griechische oder römische Abkürzungen wiedergegeben und die Endung -ium wird angefügt (Tab. 1). Danach besaß das Element 112 [Copernicium (Cn)] den vorläufigen Namen Un-un-bium (Symbol: Uub).
Tab. 1: Vorläufige Benennung von Elementen
Ziffer | Zahlwort | Symbol | Ziffer | Zahlwort | Symbol |
0 1 2 3 4 | nil un bi tri quad | n n b t q | 5 6 7 8 9 | pent hex sept oct enn | p h s o e |
Pharmazeuten als Entdecker neuer Elemente
Bei der Entdeckung neuer Elemente spielten auch Pharmazeuten eine herausgehobene Rolle. Der deutsche Apotheker und Alchemist Hennig Brand (1630-1692) entdeckte 1669 in Hamburg des Element Phosphor (P). Phosphor war das erste der 118 Elemente, dessen Entdecker uns namentlich bekannt ist. Studien in den Jahren von 1772-1773 führten den deutsch-schwedischen Apotheker und Chemiker Carl Wilhelm Scheele (1742-1786) zur Entdeckung der Elemente Sauerstoff und Stickstoff. Leider publizierte er seine Ergebnisse erst im Jahr 1777, so dass Joseph Priestley den Ruhm für die Entdeckung des Elements Sauerstoff einheimste, den er unabhängig von Scheele 1774 gefunden hatte.
Besonders erfolgreich bei der Entdeckung neuer Elemente war der aus bescheidenen Verhältnissen stammende Apothekengehilfe Martin Heinrich Klaproth. Er fand 1779 die beiden Elemente Uran (U) [Isolierung aus der Pechblende] und Zirkonium (Zr) sowie 1803 das Element Cerium (Ce). Er war Namensgeber für die Elemente Titan (Ti) [1795] und Tellur (Te) [1798]. 1793 entdeckte Klaproth (gleichzeitig mit T.C. Hope) das Strontium (Sr) und 1797 (gleichzeitig mit Louis-Nicolas Vanquelin) das Element Chrom (Cr). Dem von Vanquelin gefundenen Beryllium (Be) gab er den Namen. Der in Wernigerode geborene Apothekengehilfe Klaproth – mit beruflichen Stationen in Apotheken in Quedlinburg, Hannover, Berlin und Danzig – entwickelte sich als Autodidakt zu einem der führenden und renommiertesten Gelehrten seiner Zeit. 1778 legte er das Pharmazeutische Staatsexamen ab und 1788 wurde er Mitglied der Akademie der Wissenschaften in Berlin. Ohne Studium, Promotion und Habilitation in der Tat eine bemerkenswerte Leistung auf dem Weg zu einer ordentlichen Professur in Chemie.
Noch erfolgreicher beim Auffinden neuer Elemente war der US-Amerikaner Glenn Theodore Seaborg, der 1951 hierfür den Nobelpreis für Chemie erhielt und insgesamt 11 neue Elemente aus dem Transuran-Bereich entdeckte. Das Element 106 erhielt 1997 zu seinen Ehren den Namen Seaborgium (Sg). Seaborg ist der erste Forscher, der noch lebte, als ein Element nach ihm benannt wurde. Später folgte noch der russische Chemiker Yuri Oganessian, zu dessen Lebzeiten das Element 118 den Namen Oganesson (Og) erhielt.
Eines der wichtigsten Werkzeuge
Das Periodensystem der Elemente (PSE) ist ein faszinierendes Ordnungsprinzip und heute eines der wichtigsten Werkzeuge für jeden Wissenschaftler, der sich mit Chemie beschäftigt. Es ordnet die Elemente in Abhängigkeit von ihrem Bau (Elektronenstruktur) und die Stellung eines Elements im PSE gibt Auskunft und liefert grundlegende Erklärungen über wichtige Eigenschaften des betreffenden Elements (Tab. 2).
Tab. 2: Periodisch sich ändernde Elementeigenschaften
● Elektronenkonfiguration (Anordnung der Elektronen in der Atomhülle) ● Ionisierungsenergie (Ionisierungspotential) [Bildung von Kationen] ● Elektronenaffinität [Bildung von Anionen] ● Atomradius [Größe von Atomen] ● Ionenradius - Kovalenzradius - van der Waals-Radius ● Elektronegativität [Bildung polarer Atombindungen] ● Metallcharakter [Metalle - Halbmetalle - Nichtmetalle] ● Basizität der Oxide (Sauerstoffverbindungen) ● Schrägbeziehung (Li/Mg - Be/Al - B/Si) |
Auch heute noch Überraschungen
Und! Jeder, der sich intensiv mit dem Periodensystem beschäftigt, ist vor angenehmen Überraschungen nicht gefeit. Ende Januar 2019 berichtete die Weltpresse über das älteste Periodensystem der Welt, das in St. Andrews gefunden wurde. Die Universität St. Andrews ist die älteste Universität Schottlands und die drittälteste Universität – nach Oxford und Cambridge – im englischen Sprachraum. In Fachkreisen zählt sie zu den Eliteuniversitäten. An dieser Hochschule stießen Forscher der chemischen Fakultät 2014 beim Entrümpeln des Kellers auf ein uraltes Schaubild des PSE, wahrscheinlich das älteste seiner Art. Da die Elemente Scandium und Gallium (Ga), die 1879 bzw. 1875 entdeckt wurden, bereits aufgelistet sind, aber Germanium (Ge), das 1886 gefunden wurde, fehlt, dürfte das Poster aus dem Jahre 1885 stammen. Wahrscheinlich hat es der Chemieprofessor Thomas Purdie während seines Deutschlandaufenthaltes im Jahre 1888 käuflich erworben. Es ist beruhigend zu wissen, dass dieses wichtige Dokumente der Chemiegeschichte restauriert werden konnte und heute in einem klimatisierten Raum in St. Andrews lagert und somit der Nachwelt zugänglich ist.






















1 Kommentar
Artikel 150 Jahre PSE
von Claudia Christmann am 02.01.2020 um 17:52 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.