
- DAZ.online
- News
- USA: Die fünf ...
Operation Warp Speed
USA: Die fünf aussichtsreichsten COVID-19-Impfstoffkandidaten
Stuttgart - 16.07.2020, 11:45 Uhr

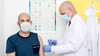
Dr. Francis Collins, Direktor der „National Institutes of Health“ (NIH) während einer Anhörung des Unterausschusses für Haushaltsmittel des US-Senats über den Plan zur Erforschung, Herstellung und Verteilung eines Coronavirus-Impfstoffs, bekannt als „Operation Warp Speed“. (Foto: imago images / Starface)
Die US-Regierung verfolgt mit der „Operation Warp Speed“ das Ziel, Ende des Jahres einen wirksamen und sicheren Impfstoff gegen SARS-CoV-2 einsetzen zu können. Von ursprünglich 125 potenziellen Kandidaten sind nunmehr fünf Impfstoffe in der engeren Auswahl, zwei mRNA-basierte Impfstoffe und drei Vektor-Vakzine.
Mitte Mai 2020 leitete die US-Regierung die „Operation Warp Speed“ ein, mit der die Entwicklung und Herstellung vielversprechender Impfstoffkandidaten gegen SARS-CoV-2 beschleunigt werden soll. Der Name des Projekts leitet sich vom fiktiven Warp-Antrieb in der Serie Raumschiff Enterprise ab, mit dessen Hilfe die Lichtgeschwindigkeit überflügelt wird. Dementsprechend ambitioniert ist auch der vorgesehene Zeitplan: Bis zum Jahresende oder Januar 2021 soll ein zugelassener Impfstoff (300 Millionen Dosen) gegen COVID-19 auf dem Markt sein.
Mehr zum Thema
Pfizer und Biontech
FDA: beschleunigtes Zulassungsverfahren für zwei Corona-Impfstoffe
Dieses Ziel wird durch eine Kooperation zwischen der Industrie und dem US-Gesundheitsministerium angestrebt. Im Mai 2020 waren von 125 möglichen Impfstoffkandidaten noch 14 in der engeren Auswahl, im Juni konzentrierte sich das Projekt auf fünf Impfstoffe, die alle gegen die Rezeptorbindungsdomäne des Oberflächen-Spike-Proteins von SARS-CoV-2 gerichtet sind (s. Tab.). Es sind zwei Messenger-RNA-Impfstoffe sowie drei Vektor-Impfstoffe.
| Impfstoff (Hersteller) | Technologie | Einmalgabe | Stadium der klinischen Prüfung |
| mRNA-1273 (Moderna) | mRNA | nein | Phase IIa |
| BNT 162 (BioNTech/Pfizer/ Fosun Pharma) | mRNA | möglicherweise | Phase I bis II |
| International Aids Vaccine Initiative (Merck Sharp & Dohme) | Vektor-Vakzine | nicht bekannt | präklinisch |
| Ad26.COV2-S (Johnson & Johnson/Janssen) | Vektor-Vakzine | ja | Phase I bis IIa |
| ChAdOx1 nCoV-19 (AstraZeneca/ Universität Oxford) | Vektor-Vakzine | ja | Phase I bis IIa |
Der Impfstoff mRNA-1273 (entwickelt vom National Institute of Allergy and Infectious Diseases und Moderna) enthält in Lipid-Nanopartikeln verkapselte mRNA, die für das Spike-Protein von SARS-CoV-2 kodiert.
BNT162 (Pfizer, Fosun und BioNTech) besteht aus vier Impfstoffkandidaten, die unterschiedliche mRNA-Formate und Zielantigene repräsentieren. Jedes mRNA-Format ist mit einer Lipid-Nanopartikel-Formulierung kombiniert. Die Zielstrukturen sind das SARS-CoV-2-Spike-Protein und die Rezeptorbindungsdomäne.
Replizierende virale Vektorimpfstoffe
Virale Vektorimpfstoffe verwenden replikationsfähige Versionen anderer Viren (Vektoren), um Antigen-produzierende Gene vom Zielpathogen zu menschlichen Zellen zu transportieren. Unter Verwendung eines rekombinanten vesikulären Stomatitis-Virus (rVSV) entwickeln Merck Sharp & Dohme in Kooperation mit der „International AIDS Vaccine Initiative“ einen Impfstoff gegen SARS-CoV-2 mit rVSV-Vektor-Plattform; das antigene Ziel ist das Spike-Protein.
Mehr zum Thema

Entwicklung von COVID-19-Impfstoffen
Kritik: Erster Corona-Impfstoff soll in Indien im August verfügbar sein
AZD1222 bekommt „Konkurrenz“
COVID-19-Impfstoffe: ein Kandidat in Phase 3, zweiter folgt
Eine weitere Strategie ist der Einsatz nicht replizierbarer rekombinanter adenoviraler Vektoren. Im Gegensatz zum rVSV-vektorisierten Impfstoff, der ein replikationskompetentes, aber harmloses Virus als Vektor verwendet, wird hier ein replikationsdefektes Schimpansen-Adenovirus oder ein replikationsdefektes menschliches Adenovirus Typ 26 eingesetzt.
Die Vektor-Vakzine ChAdOx1 nCoV-19 (AstraZeneca) basiert auf einem abgeschwächten Adenovirus aus Schimpansen (ChAd), das mit dem Gen für das Spike-Protein von SARS-CoV-2 ausgestattet ist.
Die Vektor-Vakzine Ad26.COV2-S (Johnson & Johnson) basiert auf einem replikationsdefekten Adenovirus Typ 26, das mit dem Gen für das Spike-Protein von SARS-CoV-2 ausgestattet ist.
Sicherheitsaspekte nicht vernachlässigen
An jeden dieser Impfstoffkandidaten werden neben der Wirksamkeit und der Dauer der immunogenen Reaktion hohe Sicherheitsansprüche gestellt werden. Der Erfolgsdruck, unter dem derzeit jede Zulassungs- bzw. Gesundheitsbehörde steht, darf die Sicherheitsaspekte nicht vernachlässigen. Eine US-amerikanische Arbeitsgruppe stellte einige Kriterien auf, die bei der Bewertung und Zulassung neuer COVID-19-Impfstoffe berücksichtigt werden sollten:
- Nachweis der Wirksamkeit
Dieser sollte auf der Basis großer klinischer Studien erfolgen, indem die Ergebnisse geimpfter und nicht geimpfter Probanden miteinander verglichen werden. In diese Studien müssen auch ethnisch unterschiedliche Bevölkerungsgruppen, ältere Probanden, chronisch Kranke und Risikogruppen eingeschlossen werden. Ferner ist die Beurteilung der Wirksamkeit zu überdenken, da die Bildung und der Nachweis von Antikörpern zu wenig aussagekräftig sind.
- Bewertung der Sicherheit
Vor einer breiten Anwendung sind Daten zur Pharmakovigilanz zu erheben; dabei muss unter anderem bedacht werden, dass eine Impfung auch für vulnerable Personenkreise wie Kleinkinder und Schwangere gedacht ist.
- Einsatz vor der Zulassung
Abweichend vom gängigen, vorgeschriebenen Prozedere, bei dem ein Wirkstoff erst nach dessen Zulassung eingesetzt werden darf, hat die FDA mehrere Möglichkeiten (z. B. im Rahmen eines Compassionate Use-Programms oder als Emergency Use Authorization), einen COVID-19-Impfstoff vor der Zulassung zur Verfügung zu stellen. Dieses Vorgehen sollte beim Einsatz von COVID-19-Impfstoffen sorgfältig bedacht werden. Eine vorherige Nutzen-Risiko-Abwägung ist unabdingbar.
- langfristige Überwachung
Da einige schwerwiegende unerwünschte Ereignisse sehr selten auftreten, werden sie möglicherweise im Rahmen der Zulassungsstudien nicht erfasst. Um sicherzustellen, dass seltene Ereignisse schnell erkannt und gemeldet werden, ist eine umfassende Überwachung erforderlich. Unerwünschte Wirkungen müssen zentral gesammelt und von unabhängigen Experten ausgewertet werden.


















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.