
- DAZ.online
- News
- Unerwünschte ...
Haben Sie sich schon einmal über den Satz, „Zu Risiken und Nebenwirkungen, lesen Sie die Packungsbeilage oder fragen sie ihren Arzt oder Apotheker“ geärgert? Faktisch bedeutet dieser Satz, das Fragen über Risiken und Nebenwirkungen immer bei den Ärzten und Apothekern, in der Mehrzahl aber bei den Apothekern landen. Patienten sind oft nicht in der Lage oder willens, sich selber damit zu befassen.
Tatsächlich ist der Umgang mit solchen Fragen sehr zeitaufwendig, setzt eine hohe Qualifikation voraus und wird nicht honoriert. Was viele nicht bedenken ist, dass von der Beantwortung solcher Fragen auch ein hohes Risiko für den ausgehen kann, der sie beantwortet.
Dieser Satz trifft nämlich auf alle Arzneimittel zu, unabhängig davon, ob diese verschreibungspflichtig oder rezeptpflichtig sind. Dass es sich hierbei um Tausende Arzneimittel handelt, das war den Schöpfern dieses Staatsgebildes sicherlich bekannt. Dass ein Mensch alleine - ob Arzt oder Apotheker - nicht über alle Arzneimittel detailliert im Bilde sein kann, sicherlich auch. Nun werden sich die Betreffenden gedacht haben, dass diese Fragen auch über die Fachinformationen oder Datenbanken zur Meldung von Nebenwirkungen geklärt werden können.
Also schnell die Rote Liste aufgeschlagen oder die Fachinformationen in der Roten-Liste online einsehen. Was aber machen Sie, wenn Patienten in die Apotheke kommen und sich über Nebenwirkungen informieren wollen, über die soeben in der Laienpresse berichtet worden ist? Aktuelle Entwicklungen können auf diesem Wege nicht beurteilt werden, weil neu aufgetretene Nebenwirkungen nur mit u. U. deutlicher zeitlicher Verzögerung in der Roten Liste oder in den Fachinformationen auftauchen. Eine Beurteilung solcher aktueller Entwicklungen ist so nicht möglich.
Nun werden Sie auf den Gedanken kommen, in einer zentralen Datenbank nach derartigen Einträgen zu suchen. Nehmen wir einmal an, Apotheker oder Arzt sind überzeugte Europäer und wollen dies in der von der EMA geführten „Europäischen Datenbank gemeldeter Verdachtsfälle von Arzneimittelnebenwirkungen“ analysieren.
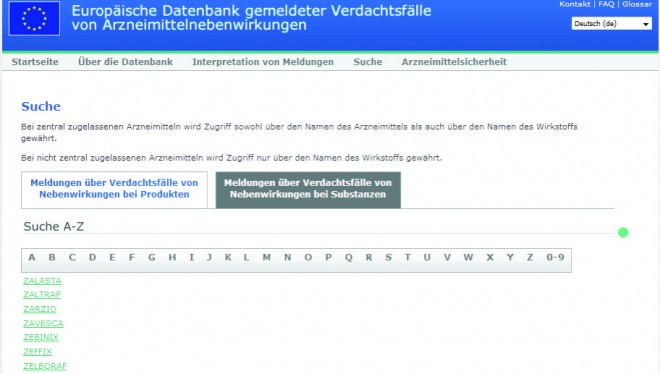
Nachdem Sie auf der ersten Seite die Hinweise akzeptiert haben, werden Sie auf eine Seite gelenkt, in der Sie eine der europäischen Sprachen auswählen können. Sodann erhalten Sie die Möglichkeit, entweder eine Nebenwirkung zu melden oder eine solche zu suchen. Entscheiden wir uns für die Suche nach einer Nebenwirkung. Dann wird eine Seite geöffnet, auf der die Unmöglichkeit dieses Systems sofort offen zutage tritt.
Suche „Bei zentral zugelassenen Arzneimitteln wird Zugriff sowohl über den Namen des Arzneimittels als auch über dem Namen des Wirkstoffs gewährt."
Zweite Anmerkung: „Bei nicht zentral zugelassenen Arzneimitteln wird Zugriff nur über dem Namen des Wirkstoffs gewährt."
Haben Sie sich schon einmal Gedanken darüber gemacht, bei welcher Regulierungsbehörde in Europa das Arzneimittel, mit dem sie sich gerade befassen, zugelassen wurde? Wohl kaum! Werden wir aber praktisch: Nehmen wir an, Sie wollen sich über das Kontrazeptivum Maxim® in dieser Datenbank orientieren. Maxim® wurde nicht zentral zugelassen. Sie werden sofort wissen, was jetzt kommt. Wie viele andere Kontrazeptiva auch, besteht dieses Arzneimittel aus mehreren Wirkstoffen, nämlich Ethinylestradiol und Dienogest. Der Systematik, in der diese Datenbank geführt wird, folgend, hieße dies, das Risiken und Nebenwirkungen für beide Substanzen nur einzeln, nicht aber in der Kombination der Wirkstoffe, analysiert werden können. Das Fertigarzneimittel zu beurteilen ist so unmöglich. Völlig daneben sagen Sie und haben natürlich recht.
Wer jetzt annimmt, dass dies ein Einzelfall ist, sieht sich schnell getäuscht. Auf der Suche nach anderen Kontrazeptiva wird sie/er sich vor genau derselben Situation wiederfinden. Einzig das von der Firma MSD in Verkehr gebrachte Präparat Zoely® kann in dieser Datenbank unter dem Handelsnamen aufgerufen und bezüglich Risiken und Nebenwirkungen beurteilt werden.
Sie wollen die aktuelle Lage bei den Impfstoffen analysieren? Dieses Thema, interessiert insbesondere junge Mütter oft und auch zurecht, weil sie wegen der Risiken deutlich verunsichert sind oder verunsichert werden. Als Apothekerin oder Apotheker finden Sie sich in genau derselben Situation wieder, wie bei den Kontrazeptiva.
Überbordende Bürokratie in der Europäischen Union, hohe Kosten, mangelnde Transparenz und Effektivität, zeigen sich hier wie an vielen anderen Stellen. Die Systeme, die die Lösung bestimmter Fragestellungen ermöglichen sollen, verhindern sie. Wenn im Rahmen des Zulassungsverfahrens, der Zulassungsantrag, der von einer nationalen Arzneimittelbehörde positiv beschieden worden ist, in der gesamten EU zu einer Zulassung dieses Arzneimittels führt, dann muss auch sichergestellt sein, dass die Daten dieses Arzneimittels auf europäischer Ebene über zentrale Strukturen vollständig eingesehen werden können.
Die
Analyse von akut berichteten Nebenwirkungen ist über die von der EMA bereitgestellte
Datenbank in der vorliegenden Struktur so nicht möglich. Wesentliche
Nebenwirkungsmeldungen können so verloren gehen oder entziehen sich praktisch
der Kenntnis der Fachkreise. Interessant in diesem Zusammenhang ist auch, dass
Oberbehörden in Deutschland zunehmend die Nutzer ihrer Internetseiten,
bezüglich Risiken und Nebenwirkungen auf eben diese Datenbank verweisen. Welche
gravierenden Konsequenzen das haben kann, wurde respektive wird dabei wohl
nicht bedacht.






















5 Kommentare
Fragenbanken
von Bernd Jas am 20.07.2016 um 18:24 Uhr
» Auf diesen Kommentar antworten | 1 Antwort
AW: Wie groß ist das Interesse der Industrie, dass UAWs transparent dargestellt werden?
von Roland Holtz am 26.07.2016 um 12:37 Uhr
Zündstoff hoch drei
von Wolfgang Müller am 20.07.2016 um 14:20 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Datenbanken-Hoheit ist Wissenshoheit!
von Kerstin Kemmritz am 19.07.2016 um 22:24 Uhr
» Auf diesen Kommentar antworten | 1 Antwort
AW: Ich stelle mir einmal vor ich bin ein Pharmaunternehmen
von Roland Holtz am 19.07.2016 um 23:17 Uhr
Das Kommentieren ist aktuell nicht möglich.