
Thema
Zulassung

CHMP macht Weg für Remdesivir frei
cel | Der Humanarzneimittelausschuss der EMA (CHMP) empfiehlt, Remdesivir in „Veklury“ eine bedingte Zulassung für die Behandlung von COVID-19 zu erteilen. Es wäre das erste in der EU zuge... » Weiterlesen
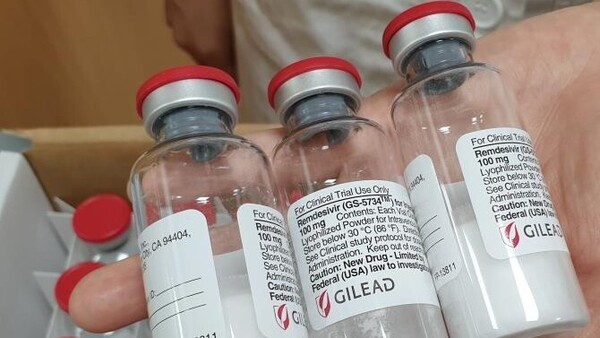
Remdesivir auch in der EU zur Zulassung empfohlen
Der Humanarzneimittelausschuss der EMA (CHMP) empfiehlt, Remdesivir in „Veklury“ eine bedingte Zulassung für die Behandlung von COVID-19 zu erteilen. Nach Rat der EMA soll das erste Corona-... » Weiterlesen

Zulassungen für Celecoxib axcount 100 mg und 200 mg Hartkapseln ruhen
Als „Spätfolge“ eines EU-Risikobewertungsverfahrens, das schon ein bisschen zurückliegt, hat es jetzt noch mal zwei Celecoxib-Generika „erwischt“. Damals waren die Zulassungen zahlreicher ... » Weiterlesen
Fluad Tetra erhält Zulassung in Europa
Die Europäische Kommission hat den ersten tetravalenten adjuvantierten Grippeimpfstoff Fluad Tetra zugelassen. Indiziert ist er für Ältere ab 65 Jahren. Der Vorgänger, Fluad, war ebenfalls ... » Weiterlesen
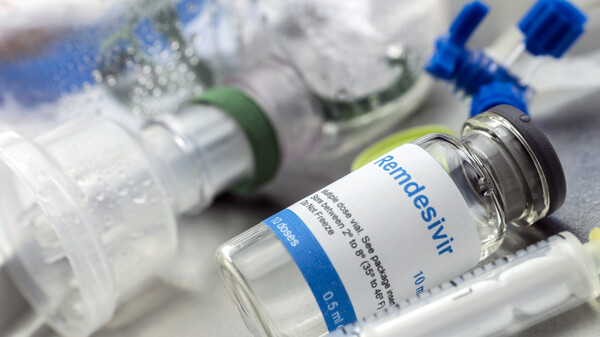
Remdesivir bald in Europa?
Gilead hat nun auch bei der Europäischen Arzneimittel-Agentur EMA die Zulassung für Remdesivir eingereicht. Der RNA-Polymerasehemmer war das erste zugelassene Arzneimittel bei COVID-19, in den ... » Weiterlesen
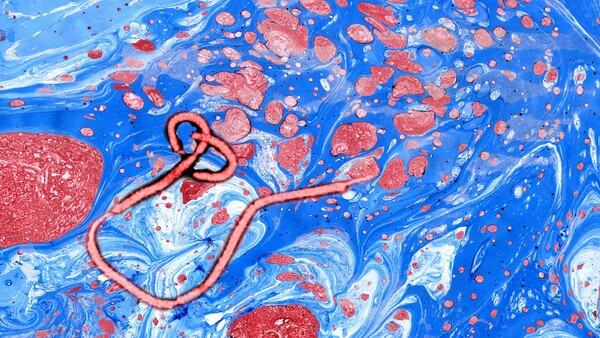
Mit zwei neuen Impfstoffen gegen Ebola
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittel-Agentur hat empfohlen, die von Janssen Pharmaceuticals entwickelte Impfstoffkombination aus Zabdeno (Ad26.ZEBOV) und ... » Weiterlesen

Keine vorschnelle Zulassung
cel/ral | AkdÄ-Chef Professor Wolf-Dieter Ludwig warnt vor einer zu schnellen EU-Zulassung von Remdesivir bei COVID-19. Die EMA erlaubt das erste Arzneimittel bislang nur in klinischen Studien oder H... » Weiterlesen

Keine vorschnelle Remdesivir-Zulassung
Remdesivir ist in den USA bereits genehmigt. Die EMA erlaubt das erste COVID-19-Arzneimittel nur in klinischen Studien oder Härtefallprogrammen, kündigte jedoch jüngst die baldige Zulassung an. ... » Weiterlesen
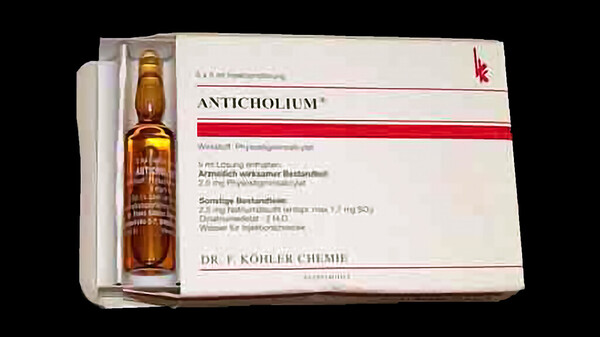
Anticholium: nicht mehr in den Muskel
Das physostigminhaltige Arzneimittel Anticholium darf fortan nicht mehr intramuskulär verabreicht werden. Darüber informiert der Hersteller Dr. Franz Köhler Chemie gemeinsam mit dem BfArM. Grund ... » Weiterlesen

Zulassung für Fostemsavir beantragt
Patienten mit multiresistenten HIV-Infektionen haben wenig Behandlungsmöglichkeiten. Arzneimittel mit neuen Wirkmechanismen werden dringend benötigt. Der Kandidat Fostemsavir, der kürzlich zur ... » Weiterlesen
Efluelda – hochdosiert für ältere Menschen
Ältere Menschen entwickeln besonders häufig schwere Grippeverläufe mit Komplikationen wie Pneumonie. Gerade bei Älteren wirkt jedoch die Influenzaimpfung meist weniger gut als bei Jüngeren. ... » Weiterlesen

BfArM lässt weitere Valsartan-Zulassungen ruhen
Das Bundesinstitut für Arzneimittel und Medizinprodukte hat für weitere valsartanhaltige Arzneimittel das Ruhen der Zulassung angeordnet. Betroffen sind drei Valsartan/Amlodipin-Kombinationen von ... » Weiterlesen

EMA erteilt Zolgensma bedingte Zulassung
Das als teuerstes Medikament der Welt bekannt gewordene Gentherapeutikum Zolgensma (Onasemnogene abeparvovec-xioi) erhält offenbar eine bedingte Zulassung in Europa. Um das Mittel schnell ... » Weiterlesen
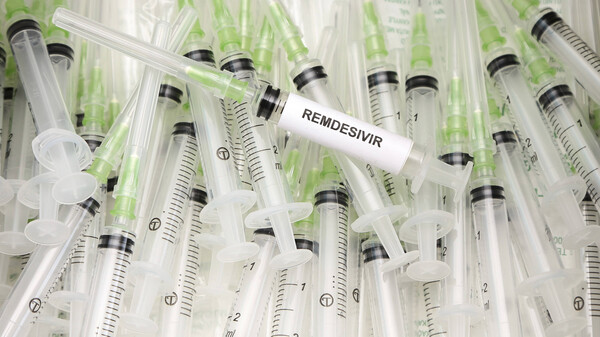
Compassionate Use: Mehr Coronapatienten erhalten Remdesivir
In den Vereinigten Staaten ist Remdesivir bereits zugelassen, auch Japan setzt das Virostatikum bei COVID-19 seit Kurzem offiziell ein. Nun zieht die Europäische Arzneimittel-Agentur nach, zwar nicht... » Weiterlesen
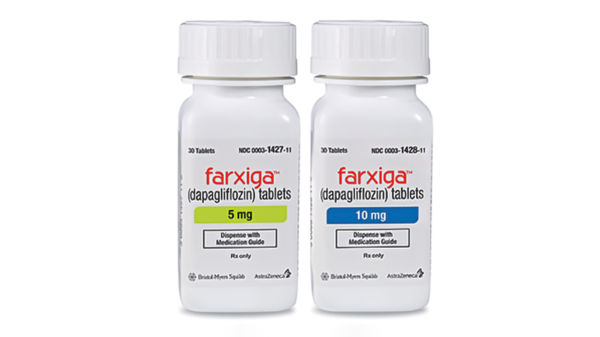
Dapagliflozin künftig bei Herzinsuffizienz – auch ohne Diabetes
Die FDA hat dem seither ausschließlich bei Diabetes mellitus eingesetzten Dapagliflozin die Zulassung in einer völlig neuen Indikation erteilt: In den Vereinigten Staaten darf Dapagliflozin als ... » Weiterlesen
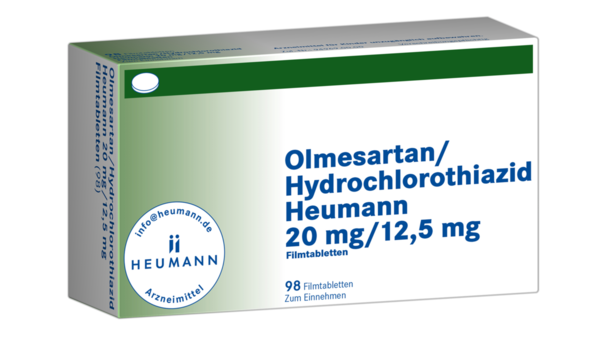
Weitere Sartan-Zulassungen ruhen
Das Bundesinstitut für Arzneimittel und Medizinprodukte hat für weitere sartanhaltige Arzneimittel das Ruhen der Zulassung angeordnet. Betroffen sind vier Olmesartan/Hydrochlorothiazid-Kombinationen... » Weiterlesen
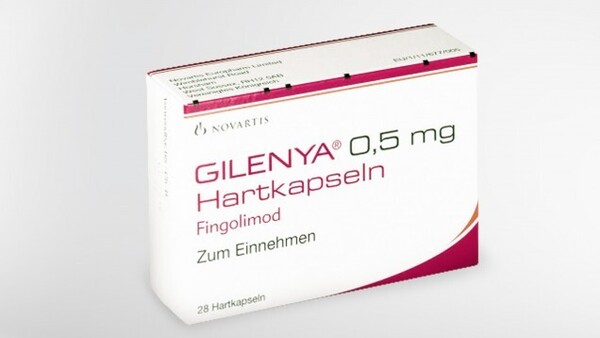
Gilenya wird generisch, Novorapid bekommt Biosimilar-Konkurrenz
Das zur Behandlung einer hoch aktiven remittierend-schubförmigen Multiplen Sklerose eingesetzte orale Arzneimittel Gilenya bekommt generische Konkurrenz: Am 30. April 2020 empfahl der Ausschuss für ... » Weiterlesen
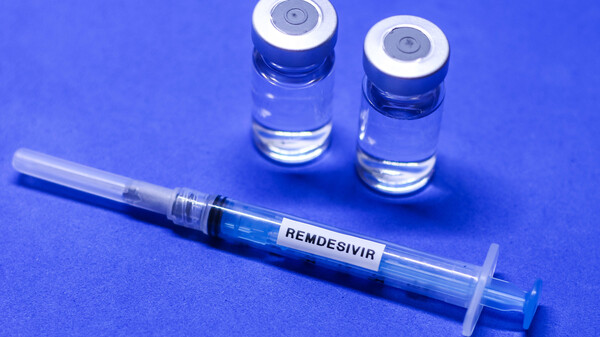
EMA prüft Remdesivir
Remdesivir ist zugelassen – bislang nur durch die FDA in den Vereinigten Staaten und nur in Form einer Notfallgenehmigung, die keiner formellen Zulassung entspricht. Das Virostatikum soll laut einer... » Weiterlesen
Zolgensma: PKV und GWQ vereinbaren erfolgsorientierte Erstattung
Zum Ende des ersten Halbjahres 2020 soll das Gentherapeutikum Zolgensma die europäische Zulassung erhalten. Die Kostenträger dürften dem mit gemischten Gefühlen entgegenblicken. In den USA kostet ... » Weiterlesen

Alleskönner Ketamin
Ketamin wird seit Langem für Allgemein- und Regionalanästhesien eingesetzt. Dank der Zulassung seines S-Enantiomers zur Behandlung therapieresistenter Depressionen (Spravato® Nasenspray) ist der ... » Weiterlesen

Erste klinische Prüfungen an einem Corona-Impfstoff beginnen
Das Paul-Ehrlich-Institut (PEI) hat erstmals in Deutschland eine Zulassung für die klinische Prüfung eines Impfstoff-Kandidaten gegen das neuartige Coronavirus erteilt. Das Mainzer Unternehmen ... » Weiterlesen

COVID-19-Arzneimittel könnte noch in diesem Jahr zugelassen werden
Der Präsident des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM), Karl Broich, hat die Einschätzung von Experten bestätigt, dass es noch in diesem Jahr eine Zulassung für COVID... » Weiterlesen





















Foto: psdesign1 / Fotolia