
Thema
Zulassungsbehörde

Catridecacog für Bluter
Catridecacog (Novothirteen, Novo) hat Ende Mai vom Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) eine Zulassungsempfehlung für die Langzeitbehandlung von Blutern ... » Weiterlesen

Phytos im Aufwärtstrend
Deutschland hat die Nase vorn – neue Erhebung der EMALONDON (hb). Befürchtungen der letzten Jahre, der Markt der pflanzlichen Arzneimittel in Europa sei ernsthaft gefährdet, sind offenbar unbegr... » Weiterlesen

Erhöhtes Blasenkrebsrisiko unter Pioglitazon
Verdacht gegen das orale Antidiabetikum bestätigtDie aktuelle Auswertung der britischen General Practice Research Database (GPRD) zum Blasenkrebsrisiko unter einer Therapie mit Pioglitazon wird ... » Weiterlesen

Neue Datenbank der EMA: Nebenwirkungen gehen online
BERLIN (as). Die Europäische Arzneimittelagentur EMA ist mit einer neuen Datenbank online gegangen. Auf der Internetseite www.adrreports.eu veröffentlicht sie ab sofort Informationen über mutmaß... » Weiterlesen

Nebenwirkungen gehen online
Die Europäische Arzneimittelagentur EMA ist mit einer neuen Datenbank online gegangen. Auf der Internetseite www.adrreports.eu veröffentlicht sie ab sofort Informationen über mutmaßliche unerwü... » Weiterlesen

Xarelto® ausgebremst – US-Experten gegen Zulassungserweiterung
Ein Expertengremium der US-Arzneimittelbehörde FDA spricht sich mit knapper Mehrheit gegen eine Zulassungserweiterung von Rivaroxaban (Xarelto®) auf das Akute Koronarsyndrom (ACS) aus. Der Faktor Xa... » Weiterlesen

Lebererkrankungen durch Phytopharmaka?
Spezifische und validierte Kausalitätsbewertung von VerdachtsfällenEin Meinungsbeitrag von Rolf Teschke, Christian Frenzel, Albrecht Wolff, Xaver Glass, Johannes Schulze, Jutta Herzog, Axel Eickhoff... » Weiterlesen
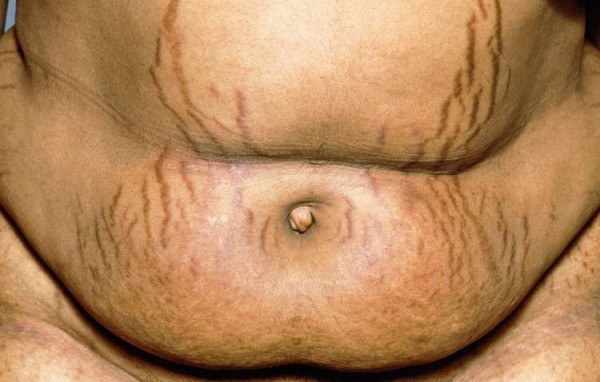
Erstes Somatostatin-Analogon bei Morbus Cushing
Beim seltenen Morbus Cushing verursacht ein gutartiger Tumor eine ziemlich bösartige Krankheit. Entfernen kann das Hypophysenadenom, das zu Hypercortisolismus führt, der Chirurg nur manchmal. Und ... » Weiterlesen

Experten für „Over the Counter”-HIV-Test
Ein „In-Home HIV Test“ könnte in den USA bald als OTC-Produkt von der amerikanischen Arzneimittelbehörde (FDA) zugelassen werden. Externe Sachverständige beurteilten den Test als „sicher und ... » Weiterlesen

EU-Parlament will verständlichere Beipackzettel
Europaweite Arzneimittelüberwachung soll verbessert werdenBrüssel (jz). Der Gesundheitsausschuss des Europäischen Parlaments hat letzte Woche Änderungen des europäischen Pharmakovigilanzsystems ... » Weiterlesen

Experten: FDA soll Pille zur oralen HIV-Infektionsprophylaxe zulassen
Ein US-amerikanisches Expertengremium hat der zuständigen Food and Drug Administration (FDA) empfohlen, die Zulassung für das bereits im Markt befindliche HIV-Medikament Truvada zu erweitern: Es ... » Weiterlesen

Neue Beobachtungsliste zu Arzneimittelrisiken erschienen: FDA schreibt 16 Wirkstoffe zur Beobachtung aus
Die amerikanische Arzneimittelbehörde FDA veröffentlicht quartalsweise eine Beobachtungs-/Kontrollliste (FDA watch list) zu Wirkstoffen mit schwerwiegenden Risiken, welche anhand des nationalen ... » Weiterlesen
Statin-induzierte Myopathie
Statine besitzen ein myotoxisches Potenzial, das dosisabhängig ist. Dabei ist zu beachten, dass Arzneimittel, die über das Cytochrom-P450-System den Statin-Abbau hemmen, zu erhöhten Statin-Serum-... » Weiterlesen

Registrierung und Zulassung von Arzneimitteln
Bekanntmachung über die Registrierung und Zulassung von Arzneimitteln Abwehr von Gefahren durch Arzneimittel, Stufe II Antiepileptika und Knochenerkrankungen » Weiterlesen





















Foto: Imago