
- DAZ.online
- DAZ / AZ
- DAZ 48/2005
- HIV-Infektion: Neuer ...
Arzneimittel und Therapie
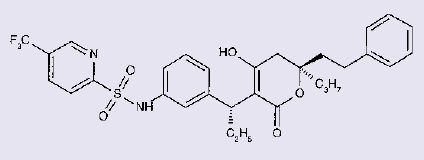
HIV-Infektion: Neuer Proteasehemmer Tipranavir
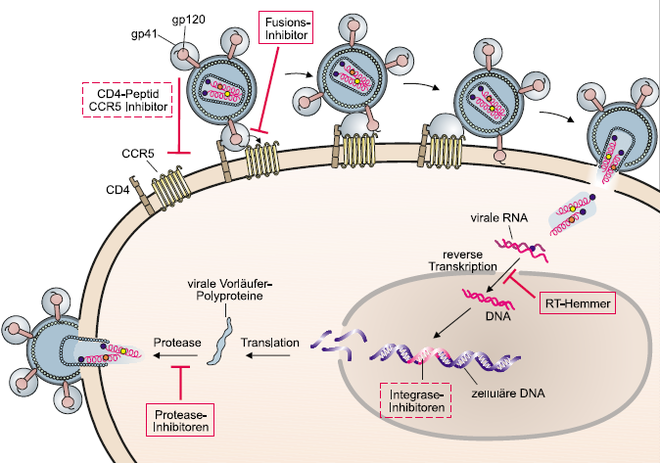
Polyproteinen des Virus funktionsfähige Proteine spaltet. So wird die Reifung der Viruspartikel verhindert.
(rote Kästchen: bereits zugelassene Arzneistoffe, gestrichelte Kästchen: noch nicht zugelassene Arzneistoffe)
Grafik: Immunologie. Grundlagen und Wirkstoffe. A. Vollmar, Th. Dingermann, Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart (2005).
Die Indikation basiert auf den Ergebnissen zweier Phase-III-Studien bei mehrfach vorbehandelten Patienten (im Mittel mit zwölf vorausgegangenen antiretroviralen Wirkstoffen) mit einer Virusresistenz gegen Proteasehemmer.
Die US-amerikanische Arzneimittelbehörde FDA hatte zuvor die beschleunigte Zulassung von Aptivus® genehmigt. Diese ist ein besonderes Genehmigungsverfahren für Therapien bei lebensbedrohlichen Krankheiten, die einen entscheidenden Nutzen für Patienten gegenüber bestehenden Therapien aufweisen. Die Zulassung beruht auf 24-Wochen-Daten aus laufenden Studien. Studienergebnisse, welche die Wirkungen von Aptivus® auf die klinische Progression zum Krankheitsbild Aids zeigen, gibt es noch nicht.
Hemmung der HIV-Protease
Tipranavir ist ein nicht-peptidischer Hemmstoff der HIV-1-Protease. Dieses Enzym wird benötigt, um den HIV-Replikationsprozess zu beenden. Tipranavir verhindert die Reifung der viralen Partikel und hemmt so die Virusreplikation.
In Kombination mit anderen antiretroviralen Mitteln hat Tipranavir einen synergistischen bis additiven Effekt. Resistenzen gegen Tipranavir entwickeln sich in vitro langsam und komplex. In klinischen Phase-II- und Phase-III-Prüfungen waren bei 276 Patienten unter einer Behandlung mit Tipranavir drei Mutationen nachweisbar. Für eine reduzierte Empfindlichkeit war eine Kombination aller drei Mutationen erforderlich. Kreuzresistenzen traten kaum auf. Tipranavir hemmt die Replikation vieler HIV-Stämme, die gegenüber herkömmlichen Proteasehemmern resistent sind.
Abbau über das Cytochrom-P450-System
Beim Menschen ist die Resorption von Tipranavir begrenzt. Die Plasmaspitzenkonzentration wird in Abhängigkeit von der Dosis ein bis fünf Stunden nach der Einnahme erreicht. Das Steady state wird bei den meisten Patienten nach einer siebentägigen Einnahme erreicht. Nahrung erhöht die Verträglichkeit von Tipranavir/Ritonavir. Daher sollte Tipranavir/Ritonavir mit dem Essen eingenommen werden. In Gegenwart von Antazida ist die Resorption von Tipranavir/Ritonavir vermindert.
Tipranavir ist ein Substrat, ein schwacher Hemmstoff und anscheinend auch ein starker Aktivator des P-Glycoproteins (P-gp). Als vorherrschendes CYP-Isoenzym ist CYP3A4 an der Metabolisierung von Tipranavir beteiligt. Um eine effektive Tipranavir-Plasmakonzentration zu erreichen, muss Tipranavir in Kombination mit niedrig dosiertem Ritonavir zweimal täglich eingenommen werden. Ritonavir hemmt das hepatische Cytochrom P450 CYP3A, die intestinale P-Glycoprotein(P-gp)-Effluxpumpe, und möglicherweise auch das intestinale Cytochrom P450 CYP3A. Ritonavir erhöht die die AUC0–12h, Cmax und Cmin von Tipranavir und senkt die Tipranavir-Clearance.
Tipranavir wird hauptsächlich unverändert in den Fäzes, zu einem kleinen Teil auch im Urin ausgeschieden. Die effektive mittlere Eliminations-Halbwertszeit von Tipranavir/Ritonavir (500/200 mg zweimal täglich, mit einer leichten Mahlzeit eingenommen) liegt zwischen 4,8 und 6,0 Stunden im Steady state.
Nach einmaliger und mehrfacher Einnahme von Tipranavir und Ritonavir war die Plasmakonzentration bei Patienten mit einer Leberfunktionsstörung erhöht. Für Patienten mit leichter Leberfunktionsstörung ist keine Dosisanpassung notwendig, jedoch sollten die Patienten engmaschig überwacht werden. Bei einer mittelgradigen (Child-Pugh-Klasse B) oder schweren Leberfunktionsstörung (Child-Pugh-Klasse C) ist Tipranavir/Ritonavir kontraindiziert. Bei Patienten mit Nierenfunktionsstörungen ist keine Dosisanpassung notwendig.
Wechselwirkungen beachten
Das Wechselwirkungsprofil von Tipranavir in Kombination mit niedrig dosiertem Ritonavir ist komplex und erfordert erhöhte Vorsicht, insbesondere bei Kombination mit anderen antiretroviralen Wirkstoffen.
Tipranavir ist ein Substrat, ein Aktivator und ein Hemmstoff von Cytochrom P450 3A. Bei Anwendung in Kombination mit Ritonavir resultiert insgesamt eine Hemmung von CYP450 3A. Die gleichzeitige Anwendung von Tipranavir/Ritonavir und Wirkstoffen, die bevorzugt durch CYP3A verstoffwechselt werden, kann zu Veränderungen der Plasmakonzentrationen von Tipranavir oder dieser anderen Wirkstoffe führen und deren therapeutische Effekte und Nebenwirkungen verändern.
Da Nukleosid- und Nukleotidanaloga das CYP450-Enzymsystem nicht signifikant beeinflussen, ist für Tipranavir keine Dosisanpassung bei gemeinsamer Anwendung mit diesen Wirkstoffen erforderlich. Tipranavir ist ein Substrat des P-Glycoproteins P-gp. Bei gleichzeitiger Anwendung von Tipranavir und Wirkstoffen, die CYP3A und/oder P-gp induzieren, kann die Tipranavir-Konzentration erniedrigt und der therapeutische Effekt verringert sein. Arzneimittel, die P-gp hemmen, können die Tipranavir-Plasmakonzentration erhöhen.
Deshalb sind zahlreiche Wechselwirkungen mit anderen Arzneimitteln zu beachten. Die gleichzeitige Anwendung von zahlreichen Substanzen ist absolut kontraindiziert. So hat die gleichzeitige Gabe von Rifampicin oder Johanniskraut-Präparaten stark erniedrigte Tipranavir-Plasmaspiegel zur Folge, was den therapeutischen Effekt von Tipranavir verringert oder gefährdet. Dagegen steigen die Plasmaspiegel von Arzneimitteln, deren Clearance in hohem Maß von den Cytochrom-P450-Enzymen CYP3A4 oder 2D6 abhängt, in Kombination mit Tipranavir/Ritonavir stark an, was mit schwerwiegenden, teils lebensbedrohlichen Nebenwirkungen verbunden ist. Dazu gehören Amiodaron, Chinidin, Astemizol, Terfenadin, Ergotamin, Dihydroergotamin, Cisaprid, Pimozid, Sertindol, Triazolam, Simvastatin oder Lovastatin sowie Flecainid und Propafenon.
Lebertoxische Wirkung
Ein Problem von Tipranavir ist ferner die Lebertoxizität: Unter der Therapie mit Tiprinavir/Ritonavir erkrankten Patienten an Hepatitis und Leberversagen, es kam zu einzelnen Todesfällen. Die Transaminasen sollen deshalb in jedem Fall vor Therapiebeginn und dann regelmäßig während der Therapie gemessen werden. Bei Patienten mit erhöhten Transaminasen, Hepatitis-B- oder Hepatitis-C-Koinfektion muss wegen potenzieller Verschlechterung der Leberfunktion das Nutzen-Risiko-Verhältnis sehr sorgfältig abgewogen werden.
Vor allem gastrointestinale Nebenwirkungen
Die häufigsten Nebenwirkungen waren gastrointestinale Störungen wie Diarrhö und Übelkeit, Erbrechen, Flatulenz, Trommelbauch, Bauchschmerzen, weiche Stühle, Dyspepsie Hypertriglyzeridämie, Hyperlipidämie und Anorexie. Häufig kam es außerdem zu Kopfschmerzen, Erschöpfung, Hautausschlägen und Pruritus.
Steckbrief: Tipranavir
Handelsname/Hersteller: Aptivus (Boehringer Ingelheim, Ingelheim)
Einführungsdatum: 15. November 2005
Zusammensetzung: Jede Weichkapsel enthält 250 mg Tipranavir. Sonstige Bestandteile: Kapselinhalt: Macrogolglycerolricinoleat, Ethanol, Mono- und Diglyceride der Octan-/Decansäure, Propylenglycol, gereinigtes Wasser, Trometamol, Propylgallat. Kapselhülle: Gelatine, rotes Eisenoxid (E172), Propylenglycol, gereinigtes Wasser, ,,Sorbitol spezial – Glycerin Mischung‘‘ (d-Sorbitol, 1,4-Sorbitan, Mannitol und Glycerol), Titandioxid (E171). Schwarze Drucktinte: Propylenglycol, schwarzes Eisenoxid (E172), Polyvinylacetat-Phthalat, Macrogol, Ammoniumhydroxid
Packungsgrößen, Preise und PZN: 120 Kapseln, 945,97 Euro, PZN 4231423
Stoffklasse: Antibiotika/Antiinfektiva, antiretrovirale Wirkstoffe, HIV-1-Proteasehemmer.
Indikation: In Kombination mit niedrig dosiertem Ritonavir zur antiretroviralen Kombinationsbehandlung der HIV-1-Infektion bei mehrfach vorbehandelten erwachsenen Patienten mit Viren, die gegen mehrere Proteasehemmer resistent sind.
Dosierung: 500 mg in Kombination mit 200 mg Ritonavir (niedrig dosiertes Ritonavir), zweimal täglich. Nahrung erhöht die Verträglichkeit von Tipranavir/Ritonavir, daher sollte die Kombination mit dem Essen eingenommen werden.
Gegenanzeigen: Mittelgradige oder schwere Leberfunktionsstörung (Child-Pugh-Klasse B oder C). Nicht zusammen anwenden mit: Rifampicin, Johanniskraut, bestimmten (s. o.) Antiarrhythmika, Antihistaminika, Mutterkorn-Derivaten, Mitteln zur Beeinflussung der gastrointestinalen Motilität, Neuroleptika, Sedativa/Hypnotika, HMG-CoA-Reduktase-Hemmern sowie mit Arzneimitteln, deren Clearance in hohem Maße von CYP2D6 abhängt.
Nebenwirkungen: Sehr häufig: Diarrhö, Übelkeit; häufig: Hypertriglyzeridämie, Hyperlipidämie, Anorexie; Kopfschmerzen; Erbrechen, Flatulenz, Trommelbauch, Bauchschmerzen, weiche Stühle, Dyspepsie; Hautausschlag, Pruritus; Erschöpfung.
Wechselwirkungen: Das Wechselwirkungsprofil von Tipranavir in Kombination mit niedrig dosiertem Ritonavir ist komplex. Tipranavir ist ein Substrat, ein Aktivator und ein Hemmstoff von Cytochrom P450 3A. Die gleichzeitige Anwendung von Tipranavir/Ritonavir und Wirkstoffen, die bevorzugt durch CYP3A verstoffwechselt werden, kann zu Veränderungen der Plasmakonzentrationen von Tipranavir oder dieser anderen Wirkstoffe führen und möglicherweise deren therapeutische Effekte und Nebenwirkungen verändern. Gleichzeitige Anwendung nicht empfohlen: mit Abacavir, Zidovudin; Amprenavir/Ritonavir, Lopinavir/Ritonavir, Saquinavir/Ritonavir; Atorvastatin; oralen Kontrazeptiva/Östrogene; Halofantrin/Lumefantrin; Fluticason oder anderen Glucocorticoiden, die durch CYP3A4 verstoffwechselt werden. Bei gleichzeitiger Anwendung mit Sildenafil, Tadalafil und Vardenafil ist ein deutlicher Anstieg der PDE5-Konzentration zu erwarten, was zu vermehrten Nebenwirkungen führen kann, darunter Blutdruckabfall, Sehstörungen und Priapismus. Tipranavir/Ritonavir soll in einem Abstand von mindestens zwei Stunden zu Antazida eingenommen werden.
Warnhinweise und Vorsichtsmaßnahmen: Tipranavir muss zusammen mit niedrig dosiertem Ritonavir angewendet werden, um einen ausreichend hohen Plasmaspiegel und damit den therapeutischen Effekt sicherzustellen. Eine antiretrovirale Kombinationstherapie, die auch Behandlungsregime mit einem Proteasehemmer einschließt, ist bei einigen Patienten mit einer Umverteilung des Körperfetts verbunden (Lipodystrophie). Proteasehemmer sind auch mit Stoffwechselstörungen assoziiert, beispielsweise Hypertriglyzeridämie, Hypercholesterinämie, Insulinresistenz und Hyperglykämie.




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.