
- DAZ.online
- DAZ / AZ
- DAZ 19/2009
- Retaxfalle Betä...
Praxis
Retaxfalle Betäubungsmittel
Der Internetseite des BfArM entnehmen wir ein Beispiel für eine korrekte Verordnung eines Fentanylpflasters (Abb. 1). Wie das Beispiel zeigt, wird mittlerweile sogar bei Namensverordnungen die Angabe der Wirkstoffbeladung gefordert. Eine Fentanylpflaster-Verordnung ist somit nur noch als korrekt anzusehen, wenn sie dem vom BfArM genannten Beispiel entspricht:
Fentanyl-musterpharm 50 Mikrogramm/h, 5 St., enthält 8,25 mg Fentanyl
Bei Namensverordnungen von Fentanylpflastern ergibt sich die Wirkstoffbeladung fast immer eindeutig aus der Verordnung (Ausnahme: Hexal Matrix- und Reservoirpflaster). Daher könnte man laut § 9 BtMVV bei eindeutiger Namensverordnung eigentlich darauf verzichten, aber zusätzliche Sicherheit kann nicht schaden.
Obwohl es sich vorrangig um eine Verschreibungsvorschrift handelt, sind auch die Apotheken gehalten, diese Vorschrift bei der Abgabe zu beachten. Denn laut § 12 BtMVV darf die Apotheke BtM-Verordnungen nicht beliefern, wenn diese nicht korrekt nach § 9 BtMVV ausgestellt sind.
Das Problem ist, dass die zusätzlich verlangte Angabe der Wirkstoffbeladung auch bei Namensverordnungen bis dato weder den Ärzten noch den Apothekern offiziell bekannt gemacht wurde. Es gibt anscheinend auch noch keine Arztpraxissoftware, die die Wirkstoffbeladung pro Pflaster automatisch aufdruckt.
Bei Wirkstoff- und Namensverordnungen, die nur die Freisetzungsrate (z. B. 25 μg/h) nennen, ist daher der Arzt um die zusätzliche Angabe des Wirkstoffgehalts zu bitten.
Die Apotheke darf die fehlende Wirkstoffangabe laut Ministerium auf Teil 1 und 2 des Rezeptes nach Rücksprache mit dem Arzt ergänzen. Der Arzt ergänzt den in der Arztpraxis verbliebenen Teil 3 der Verordnung (§ 12 (2) BtMVV).
Sollte eine Rezeptprüfstelle sich auf die Lieferverträge berufen und die Abgabe wegen fehlender Zweitunterschrift des Arztes retaxieren, so kann sich die Apotheke auf die gesetzliche Ermächtigung, die Stellungnahme des Ministeriums und die Meinung der Apothekerverbände zur Rezeptergänzung berufen.
Es ist dennoch zu empfehlen, nach Möglichkeit alle drei Teile vom Arzt per Unterschrift ändern zu lassen, denn die telefonisch erbetene Änderung auf Teil 3 der Verordnung könnte in der Arztpraxis vergessen werden.
Im Falle einer Retaxation ist die Apotheke somit durch drei identisch geänderte und vom Arzt abgezeichnete Rezeptbelege geschützt (Beweiskraft).
Abweichende Applikationsdauer: kein Austausch
BtM-Pflaster unterschiedlicher Applikationsdauer sind nicht gegeneinander austauschbar.
Laut Mitteilung der Fa. Grünenthal – Eingang am 25. November (!) 2008 – hat das Bundesinstitut für Arzneimittel und Medizinprodukte beschlossen: Buprenorphin-Pflaster dürfen seit 1. Oktober (!) 2008 nur noch ausgetauscht werden, wenn die Applikationsdauer übereinstimmt.
Laut Hersteller darf Transtec® PRO daher nicht ausgetauscht werden, denn seine Applikationsdauer beträgt – im Gegensatz zu generischen Produkten – 96 Stunden.
Obwohl diese Regelung seit dem 1. Oktober 2008 gilt, ist sie nicht nur weitgehend unbekannt; die Apotheken-EDV kann sie offenbar auch noch nicht umsetzen, wie folgende Tests beweisen:
- Namensverordnung
Transtec ® PRO 35 μg/h, 8 Pflaster, enthält 20 mg Buprenorphin
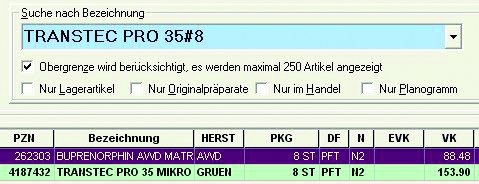
Es wird kein erforderlicher Austausch angezeigt, was sogar korrekt ist, weil Transtec® aufgrund der viertägigen Applikationsdauer nicht ausgetauscht werden darf. Dass kein Austausch angezeigt wird, liegt aber nicht daran, dass unsere Apotheken-EDV-Systeme das neue BfArM-Austauschkriterium "Applikationsdauer" schon vergleichen können, sondern daran, dass die alternativen Buprenorphin-Präparate keinen Rabattvertrag aufweisen. Also offenbar ein Zufallstreffer!
Dass die korrekte Anzeige tatsächlich nur zufällig ist, zeigt sich, wenn wir manuell nach gemäß § 129 SGB V austauschbaren Präparaten suchen: Wie die Abbildung 2 zeigt, werden Transtec® PRO und das AWD-Generikum als austauschbar angezeigt. Wählt die Apotheke nun das günstigere AWD-Generikum, so läuft sie Gefahr retaxiert zu werden.
- Wirkstoffverordnung
Buprenorphin 35 μg/h, Pflaster, 8 St., enthält 20 mg Buprenorphin
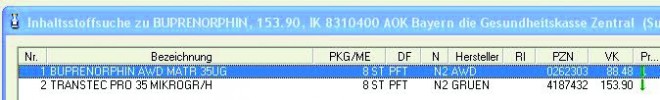
Die Eingabe einer Wirkstoffverordnung führt zu einem unbrauchbaren Ergebnis (Abb. 3): Da kein Rabattarzneimittel existiert, werden die "drei günstigsten" als abgabefähig angezeigt, nämlich Transtec® PRO und das AWD-Generikum. Trotz des erheblichen Preisunterschieds zählen beide Präparate zu den "drei günstigsten". Welches von beiden abzugeben ist, entscheidet die vom Arzt anzugebende Dosierung: "Alle 3 Tage 1 Pflaster" bedeutet die Abgabe des AWD-Präparats; bei "alle 4 Tage 1 Pflaster" ist Transtec® PRO abzugeben.
Der bisher zulässige Vermerk "gem. schriftlicher Anweisung" reicht somit hier nicht mehr aus, da der Apotheker die Applikationsdauer kennen muss.
Unterschiedliche Retardierung: kein Austausch
BtM-Darreichungsformen mit unterschiedlicher Wirkdauer (Retardierung) sind generell nicht austauschbar (Abb. 4). Das neue Austauschkriterium "Wirkdauer" gilt also nicht nur für Buprenorphin-Pflaster, sondern für alle retardierten Darreichungsformen bei BtM. So darf z. B. eine BtM-Tablette mit 24-stündiger Wirkdauer nicht mehr gegen eine Tablette mit 12-stündiger Wirkdauer ausgetauscht werden.
Dieses neue Austauschkriterium wird sich wohl kaum auf Betäubungsmittel begrenzen lassen. Es ist damit zu rechnen, dass pharmazeutische Hersteller dieses Austauschkriterium auch für den übrigen Arzneimittelbereich fordern werden. Nachdem man – gegen den Widerstand der Apotheker – im April 2008 (Rahmenvertrag) beim Austausch gleicher Darreichungsformen die Prüfung durch den G-BA für entbehrlich erklärt hat, zeigen sich jetzt offenbar erste berechtigte Zweifel.
Falls sich die Erkenntnis durchsetzen sollte, dass doch nicht alles "gleich" und austauschbar ist, was in der Datenbank mit den gleichen drei Buchstaben abgekürzt wird, so wäre dies pharmazeutisch nur zu begrüßen. Leider ergibt sich auch hier das Problem, dass diese neue Austauschvorschrift den Apothekern offiziell weder bekannt ist, noch vermutlich in absehbarer Zeit von der Apotheken-EDV umgesetzt werden kann. Weitgehend ohne EDV-Unterstützung über die korrekte Abgabe zu recherchieren, ist im Apothekenalltag jedoch auf Dauer nicht praktikabel.
Gleichwohl laufen wir auch hier Gefahr, künftig wegen "Falschabgabe" retaxiert oder gar schadensersatzpflichtig gemacht zu werden. Analog zur neuen Interpretation des Begriffes "Zulassung für den gleichen Indikationsbereich" sind auch hier eine schnelle Klärung und offizielle Vorgaben erforderlich.
AutorApotheker Dieter Drinhaus, Retaxforum des Deutschen Apotheken Portals retaxforum@gmx.de





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.