
- DAZ.online
- DAZ / AZ
- DAZ 23/2009
- Zulassung für Ulipristal...
Arzneimittel und Therapie
Zulassung für Ulipristal erteilt
Die Zulassung der Europäischen Kommission erfolgte aufgrund der positiven Bewertung des Ausschusses für Humanmedizin der Europäischen Arzneimittelagentur (EMEA) im März 2009. Diese stützte sich auf die präklinischen und klinischen Studiendaten, die der EMEA seit dem 25. Juni 2008 vorliegen und im Zuge des zentralisierten Zulassungsverfahrens ausgewertet wurden. HRA Pharma entwickelt zurzeit Ulipristalacetat auch für andere Anwendungsbereiche in der Gynäkologie außerhalb der Notfallkontrazeption weiter. So zur Behandlung von Uterusmyomen, einem häufig auftretenden gutartigen Tumor bei Frauen im gebärfähigen Alter, da es in Tierversuchen zu einer Atrophie des Endometriums kam.
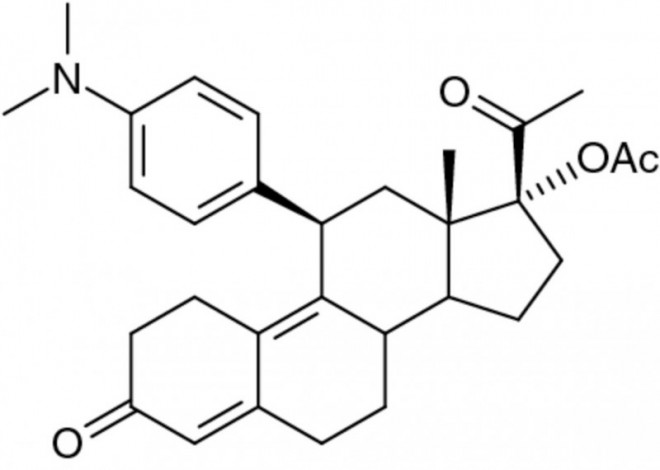
Ulipristal ist ein synthetischer, selektiver Progesteron-Rezeptor-Modulator, der antagonistische und partiell agonistische Eigenschaften besitzt. Er verhindert das Andocken von Progesteron an den entsprechenden Rezeptor. Als Folge wird die Synthese von Proteinen unterdrückt, die für den Beginn und Erhalt einer Schwangerschaft notwendig sind. Die Wirksamkeit der derzeitigen Präparate zur hormonellen Notfallkontrazeption basierend auf dem Wirkstoff Levonorgestrel Notfallkontrazeption (Unofem® [Hexal] und Levogynon® [Bayer]) sinkt, je mehr Zeit nach dem ungeschützten Geschlechtsverkehr verstrichen ist. Sie müssen spätestens 72 Stunden nach einem ungeschützten Geschlechtsverkehr eingenommen werden, um eine Schwangerschaft zu verhindern. Ulipristal verfügt über eine längere Wirksamkeit und wurde deshalb für den Einsatz bis zu fünf Tagen nach dem ungeschützten Geschlechtsverkehr zugelassen, bei einem vergleichbaren Sicherheits- und Verträglichkeitsprofil wie Levonorgestrel. Ulipristalacetat wird einmalig in einer Dosis von 30 mg eingenommen und kann bis zu 120 Stunden (fünf Tage) nach einer möglichen unerwünschten Befruchtung eingesetzt werden. Als häufigste unerwünschte Wirkungen traten in den Studien Menstruationsstörungen, Übelkeit, Unterleibsschmerzen und Kopfschmerzen auf.
Quelle
HRA Pharma erhält die europäische Marketingzulassung für ellaOne®. Pressemitteilung der HRA Pharma vom 26. Mai 2009.
Summary of the positive opinion for Ellaone. Committee for medicinal products for human use, European Medicines Agency, 19. März 2009.
ck




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.