
- DAZ.online
- DAZ / AZ
- DAZ 38/2009
- Brezeln, Brücken, Bembel...
Feuilleton
Brezeln, Brücken, Bembel, Krüge, Käfige und Kronen*
Die Brezel erhält ihre charakteristische Form durch die Verknotung eines Teigstranges, wodurch zwei Ringe entstehen, die sich nur an einer Stelle berühren.
Die Brücke verbindet – meist durch die Luft – zwei nicht aneinander grenzende Objekte.
Am Bembel , den man normalerweise dazu benutzt, Apfelwein vom Fass zum Tisch zu transportieren, ist ein Henkel .
Diese drei Strukturmerkmale, Brezelknoten, Brücke und Objekt mit Henkel, findet man auch in interessanten Naturstoffen und Arzneistoffen. Sie werden
- als Spirane oder Spiroverbindungen,
- als überbrückte Ringsysteme oder "Käfige" und
- als Ansa-Verbindungen
bezeichnet. Als molekulare Kronen könnte man viele kleine bis mittelgroße Ringe betrachten, die sich um ein zentrales Atom oder Ion gruppieren.
Spirane
Der Name ist abgeleitet von lat. spira = Brezel bzw. griech. σπειρα (speira) = Windung.
Sie sind dadurch charakterisiert, dass sie aus zwei Ringen bestehen, die über nur ein gemeinsames C-Atom miteinander verknüpft sind, wodurch die Ringebenen mehr oder weniger senkrecht zueinander stehen. Dies gilt uneingeschränkt nur dann, wenn die beteiligten Ringe eine ausreichende Rigidität aufweisen.
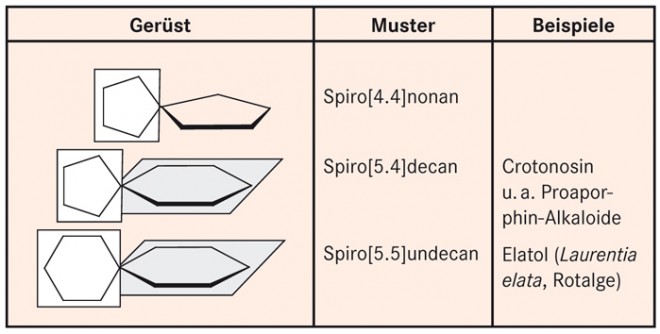
Ein einfacher Vertreter solcher molekularer Brezeln ist das Spiro[4.4]nonan (Abb. 1), bestehend aus zwei Cyclopentanringen mit einem gemeinsamen C-Atom. Spirane, die aus zwei gleichen Ringen aufgebaut sind, besitzen eine Drehspiegelachse und sind achiral. Abbildung 1 zeigt zwei weitere, einfache Spirangerüste, an deren Aufbau ausschließlich C-Atome beteiligt sind.
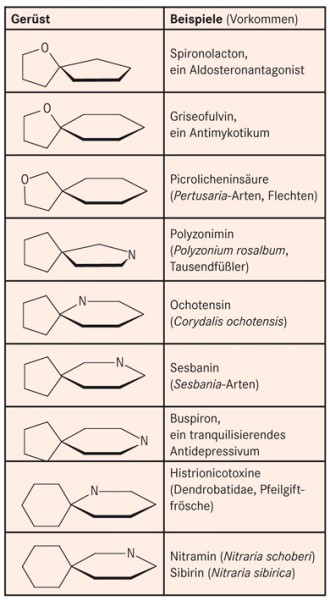
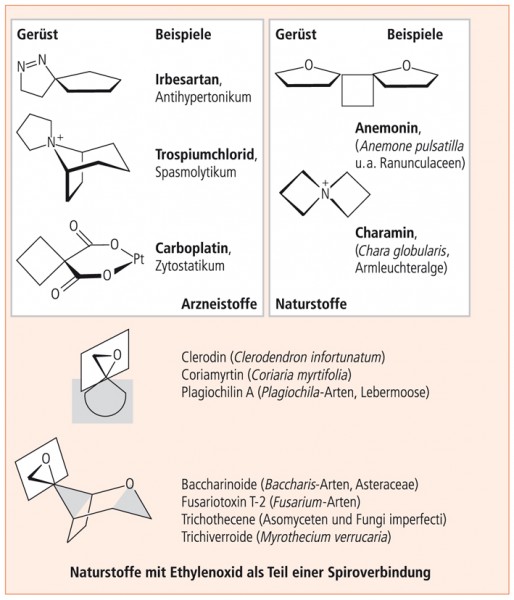
Unter den Naturstoffen sind verschiedene Spirane anzutreffen, die Heteroatome wie O und N enthalten. Muster und Beispiele gehen aus Abbildung 2 hervor. Dabei handelt es sich um zyklische Ether oder Amine, die nicht verseifbar sind.
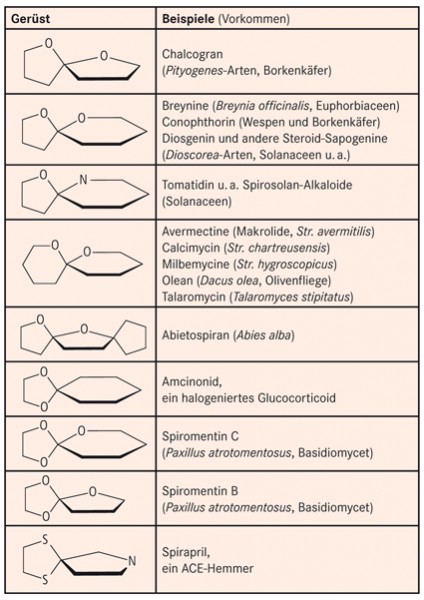
Die in Abbildung 3zusammengestellten Heterospirane mit zwei oder drei Heteroatomen sind alle unter Ringöffnung verseifbar, entweder zu Hydroxyketonen (Aminoketonen) oder zu zwei Komponenten, von denen die eine ein Ethylenglykol-Derivat darstellt.
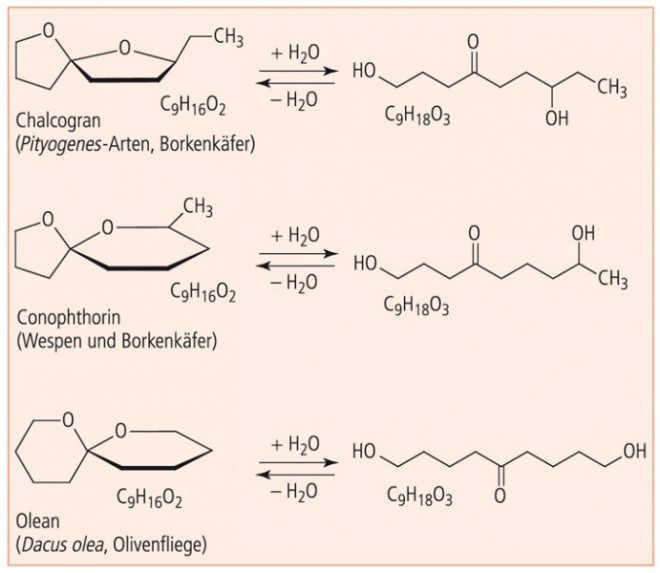
Interessanterweise liefern die chiralen Insekten-Pheromone Chalcogran, Conophthorin und Olean bei der Verseifung drei isomere Dihydroxyketone derselben Kettenlänge von neun C‑Atomen (Abb. 4). Die entsprechenden Enantiomere und Diastereomere vermitteln unterschiedliche Signale. So lockt beispielsweise die S -Form des Oleans das Weibchen der Olivenfliege an, während das R -Enantiomer attraktiv auf das Männchen wirkt.
Spiroverbindungen mit strukturellen Besonderheiten aus dem Bereich der Natur- und Arzneistoffe sowie Naturstoffe mit Ethylenoxid als Teil eines Spirans sind in Abbildung 5 zu finden.
Überbrückte Ringsysteme, molekulare Käfige
Bizyklische oder multizyklische überbrückte Ringsysteme, die in beiden oder weiteren Ringen drei oder mehr C-Atome gemeinsam haben, stellen molekulare Käfige dar.
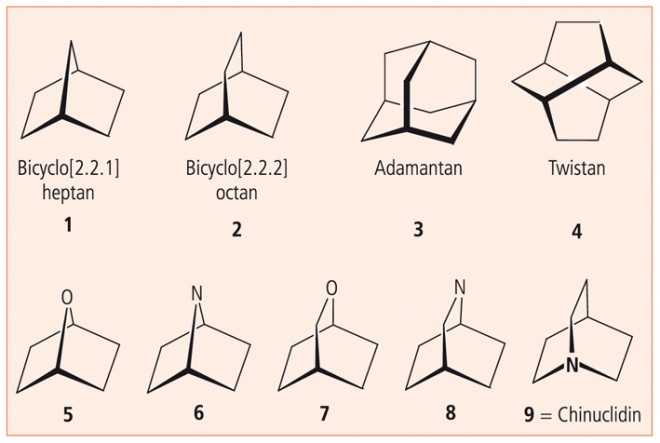
Klassische, ästhetisch anspruchsvolle molekulare Käfige sind die überbrückten Kohlenwasserstoffe Bicyclo[2.2.1]heptan (1), Bicyclo[2.2.2]octan (2), Adamantan (3) und Twistan (4) (Abb. 6). Twistan, die Krönung des abgebildeten Käfig-Quartetts, ist allerdings – auch wenn es auf den ersten Blick unwahrscheinlich ist – nicht symmetrisch, sondern chiral (s. hierzu 8. Essay).
Bicyclo[2.2.1]heptan-Derivate, bizyklische Terpene
1 ist als Gerüst enthalten in den Arzneistoffen Bornaprin (Anticholinergikum) und Biperidin (Anticholinergikum) sowie in mehreren bizyklischen und trizyklischen Mono- und Diterpenen (Tab. 1).
| Tab. 1: Mono- und Diterpene, die als Gerüst Bicyclo[2.2.1]heptan enthalten (vgl. Abb. 6, 1) | |
| bizyklisch | trizyklisch |
Borneol (Pinaceae) Campher (Cinnamomum camphora) Fenchene (Thuja plicata, Valeriana officinalis) Isoborneol (Pinaceae) β-Santalol (Santalum album) Sordaricin (Sordaria araneosa, Ascomycet) | α-Santalen (S. album) α-Santalol (S. album) Teresantalal (S. album) Teresantalol (S. album) Teresantalsäure (S. album) Tricyclen (Juniperus communis, Abies balsamea) |
Analoge Käfige, die an der Spitze ein Sauerstoffatom (5) oder ein Stickstoffatom (6) aufweisen (Abb. 6), sind Grundgerüste verschiedener Naturstoffe. 5 ist Gerüst des 1,4-Cineols und Teilgerüst des Cantharidins, das von Lytta vesicatoria , der "Spanischen Fliege", und anderen Ölkäfern produziert wird und früher als Aphrodisiakum galt.
6 bildet den überbrückten Teil von Epibatidin, einem ungewöhnlichen Chlorpyridin-Alkaloid, das vom ecuadorianischen Pfeilgiftfrosch Epipedobates tricolor stammt.
Bicyclo[2.2.2]octan-Derivate
2 stellt das Ringgerüst des Arzneistoffs Maprotilin und der Naturstoffe Seychellen und Pupukeanan (-Derivate) dar.
Der Ersatz einer CH2 -Gruppe durch ein Sauerstoffatom führt zu einem Käfig 7 , der das Ringgerüst des 1,8-Cineols darstellt.
Ersetzt man eine CH2 -Gruppe durch ein Stickstoffatom, so wird das Gerüst 8 des Dioscorins sichtbar, eines Naturstoffs, der zugleich ein Spiran darstellt (Abb. 6). Das gleiche Ringgerüst findet sich im dem Indolizidin-Alkaloid Securinol A (Securinega -Arten, Euphorbiaceen).
Am weitesten verbreitet, am bekanntesten und wichtigsten ist das Ringsystem, das beim Ersatz einer Brückenkopf-CH-Gruppe durch ein Stickstoffatom entsteht und als Chinuclidin bezeichnet wird (9). Chinuclidin ist anzutreffen in
- Aceclidin (Miotikum, zur Glaukom-Therapie),
- Ajmalin und Derivaten (Antiarrhythmika der Klasse I),
- Chinaalkaloiden (Chinin, Chinidin, Cinchonin, Cinchonidin, Cinchonamin),
- Clidiniumbromid (Anticholinergikum),
- Iboga-Alkaloiden (Coronaridin, Heyneatin, Ibogain, Iboganin, Tabemanthin) und
- Mequitazin (H1 ‑Rezeptor-Antagonist der ersten Generation).
Adamantan-Derivate
Adamantan (3) ist als Kohlenwasserstoff in bestimmten Petroleumsorten anzutreffen und insofern als Naturstoff anzusprechen. Es bildet auch lipophile Partialstrukturen verschiedener Arzneistoffe wie Adapalen (zur topischen Behandlung der Akne), Amantadin und Memantin (Anticholinergika zur Behandlung des Parkinson-Syndroms), Tromantadin (Dermatikum bei Infektionen mit Herpes-simplex-Viren) und Vildagliptin (orales Antidiabetikum, Einführung Sept. 2008).
Ersetzt man gedanklich die vier tertiären C‑Atome des Adamantans durch N-Atome, so gelangt man zum Methenamin (Hexamethylentetramin). Auch in einem äußerst toxischen Naturstoff, dem Tetrodotoxin aus dem Kugelfisch, steckt das überbrückte Ringgerüst des Adamantans (s. hierzu auch das Glossay "Mit und ohne Spitzenhäubchen").
Tropan und verwandte überbrückte Ringe
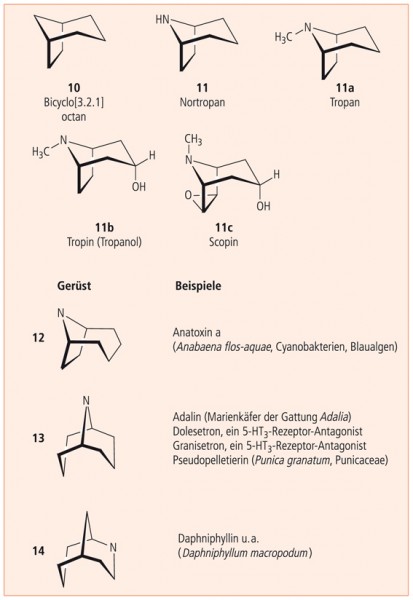
Das dem Nortropan (11) zugrunde liegende Bicyclo[3.2.1]octan (10 , Abb. 7) ist als Gerüst zu finden in den Gymnomitranen (Gymnomitren, Gymnomitrol, α-Barbaten), in Sesquiterpenen, die von Lebermoosen (Hepaticae) gebildet werden, sowie in anderen Sesquiterpenen wie Helminthosporal und Helminthosporol, die von phytopathogenen Pilzen wie Cochliobolus sativus oder Helminthosporium sativum stammen.
Das N-methylierte Tropan (11a) wird durch Hydroxylierung zum Tropin (syn. Tropanol, 11b) und dieses durch Epoxidierung zum Scopin (syn. Scopinol, 11c).
Ester dieser zyklischen Aminoalkohole sind Solanaceen-Alkaloide wie Hyoscyamin (Atropin) und Scopolamin (s. hierzu 9. Essay, Abb. 22 und 23) sowie partialsynthetische Arzneistoffe wie Butylscopolamin und das homologe Benzatropin (Spasmolytika). Tropisetron, ein halbsynthetischer Ester des Tropanols, ist ein 5‑HT3 -Rezeptor-Antagonist, der zur Behandlung von Chemotherapie-induzierter Nausea und Emesis eingesetzt wird.
Tropan-ähnliche Ringsysteme
Beispiele aus dem Bereich der Naturstoffe (Adalin, Anatoxin a, Daphniphyllin u. a., Pseudopelletierin) und Arzneistoffe (Granisetron, Dolasetron) sind in Abbildung 7 zu finden.
Endozyklische Peroxide
Einige Naturstoffe bilden auch käfigartige Moleküle durch Überbrückung eines fünf-, sechs- oder siebengliedrigen aliphatischen Ringes mit einer Peroxidfunktion. Belege zu dieser Feststellung findet man in Abbildung 8.
Pavin- und Chinolizidin-Alkaloide
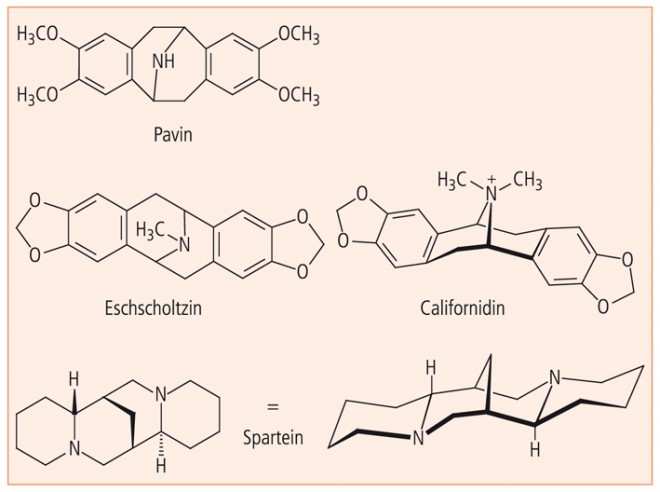
Eines der prominentesten Alkaloide, das Morphin, entsteht bekanntlich durch Ringschluss einer Benzyl(tetrahydro)isochinolin-Einheit. Andere Opiumalkaloide von unsymmetrischer Struktur mit asymmetrischen Zentren werden ebenfalls durch intramolekulare Zyklisierung der gleichen Grundeinheit biosynthetisiert. Daneben existiert aber auch ein Zyklisierungsweg, der zu symmetrischen, käfigartigen Alkaloiden vom Typ des Pavins führt. Abbildung 9 zeigt drei Vertreter dieses überbrückten Systems in drei verschiedenen Schreibweisen.
Chinolizidin-Alkaloide vom Typ des Sparteins wie Anagyrin, Genistein, Lupanin, Pachycarpin, Isospartein, Spartalupin kommen im Besenginster (Sarothamnus scoparius), in zahlreichen anderen Fabaceen (Lupinus, Cytisus) und in Berberidaceen (Leontice) vor. In Abbildung 9 ist Spartein in zwei verschiedenen Schreibweisen zu sehen, aus denen die rotationssymmetrische Grundstruktur und die Käfigstruktur zu erkennen sind.
Ästhetisch anspruchsvolle molekulare Käfige
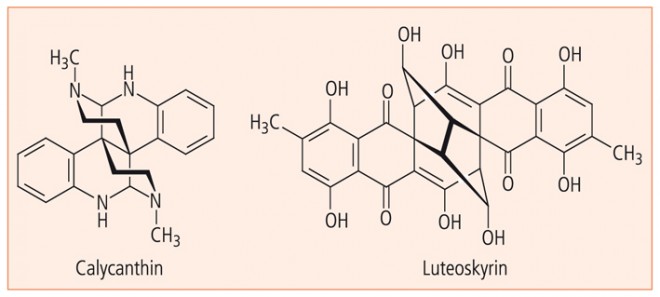
Das 13. Essay zum Thema "Molekulare Ästhetik" erhebt keinen Anspruch auf Vollständigkeit, wäre jedoch mangelhaft ohne die Vorstellung zweier spielkartensymmetrischer und ästhetisch sehr anspruchsvoller Naturstoffe. Es sind dies das in Pflanzen der Gattung Calycanthus und im Hautsekret südamerikanischer Pfeilgiftfrösche (Phyllobates terribilis) vorkommende Alkaloid Calycanthin (Abb. 10, s. auch 4. Essay) und das mykotoxische Bianthrachinon Luteoskyrin (Abb. 10), das von Penicillium islandicum geliefert wird.
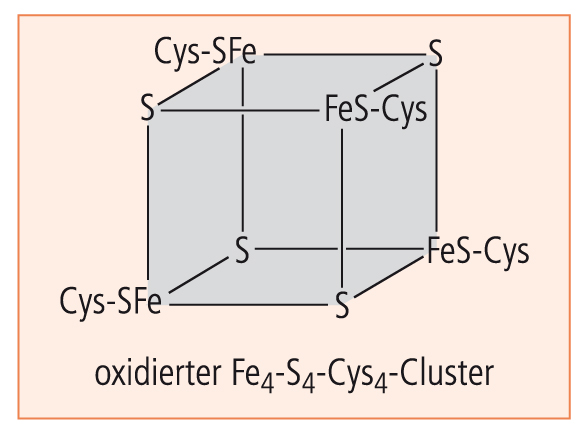
Wenn wir ferner einen Blick in den Bereich der bioanorganischen Chemie werfen, so fällt dort ein Ferredoxin-Cluster durch seine würfelförmige Käfigstruktur auf (Abb. 11).
Henkel
Ansa-Verbindungen ist die Bezeichnung für planare, aromatische Verbindungen, die von einem Henkel überbrückt werden, der aus einer aliphatischen Kette besteht.
Heute spricht man auch von Cyclophanen, die in Para- und Metacyclophane unterteilt werden.
Von therapeutischer Bedeutung als Hemmstoffe der bakteriellen DNA-abhängigen RNA-Polymerase sind die Rifamycine Rifampicin und Rifabutin (Abb. 12). Sie bestehen aus einem Naphthohydrochinon- oder Naphthochinon-Chromophor, der von einer aliphatischen Kohlenstoffkette überbrückt ist; die Verbindungen werden von seltenen Actinomyceten (Amycolatopsis mediterranei) produziert und partialsynthetisch abgewandelt.
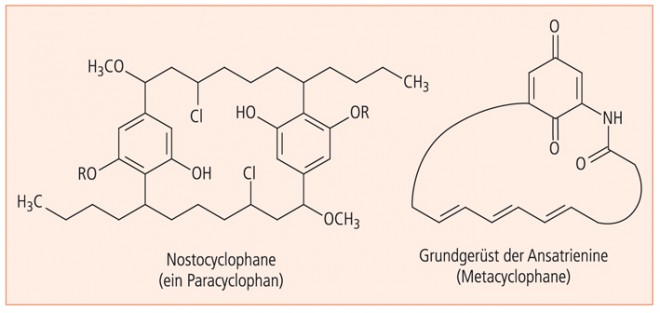
Als Vertreter der nativen Paracyclophane seien die Nostocyclophane genannt, die aus dem Cyanobakterium (Blaualge) Nostoc linckia isoliert wurden; ein Vertreter der Metacyclophane ist das Ansatrienin A, das von Streptomyces collinus geliefert wird.
In Abbildung 13 sind die Gesamtstruktur der spielkartensymmetrischen Nostocyclophane und das Grundgerüst der Ansatrienine dargestellt.
Kronen
"Kronen" ist ein von Charles J. Pedersen geprägter Trivialname für makrozyklische Polyether, der auf eine zickzackförmige Anordnung der Atome verweist. Kronenether (Coronanden, Kronen-Verbindungen) bilden Hohlräume, in die Fremdatome eingelagert werden können. Ihre wichtigste Eigenschaft ist die Fähigkeit, multidentale Komplexe mit Metallionen zu bilden. Sie werden auch als Ionophore bezeichnet, weil sie in der Lage sind, Metallionen zu transportieren. Natürliche Coronanden, mit welchen wir uns unter anderen Aspekten schon in vorangehenden Essays befasst haben, sind beispielsweise die folgenden zyklischen Peptide und Depsipeptide:
Enterobactin: 7. Essay, Abb. 13 und 14.
Enniatine: 8. Essay, Abb. 21 und 30.
Valinomycin: 8. Essay, Abb. 29 und 30.
Nonactin: 8. und 9. Essay, Abb. 11 (8) und 24 (9).
Abgesang
Viele gebildete Menschen äußern sich in Gesprächen über ihre Unkenntnis, ihr Missverständnis oder gar ihre Abneigung gegenüber der Chemie. Das mag mit der Vorstellung zusammenhängen, die Chemie als Fachwissen sei zu abstrakt, zu schwierig und zu trocken, oder mit der Phobie, die von Naturaposteln und naturwissenschaftlichen Laien kultiviert wird, und mit der Tendenz der Medien, das Negative als das Interessante zu verkaufen. Etwas Abhilfe wäre mit einer lebensnahen, interdisziplinären Betrachtungsweise und Darstellung zu schaffen.
In diesem Sinne sollten wir uns weiter unterhalten über molekulare Kreuze, Propeller, Röhren und Kanäle, was aber an dieser Stelle aus Platzgründen und wegen der Ermüdungsgefahr für den Leser unterbleibt. Daher nur so viel:
- Propeller entstehen oft bei der Komplexierung von Metallionen, insbesondere durch Siderophore (Eisenträger).
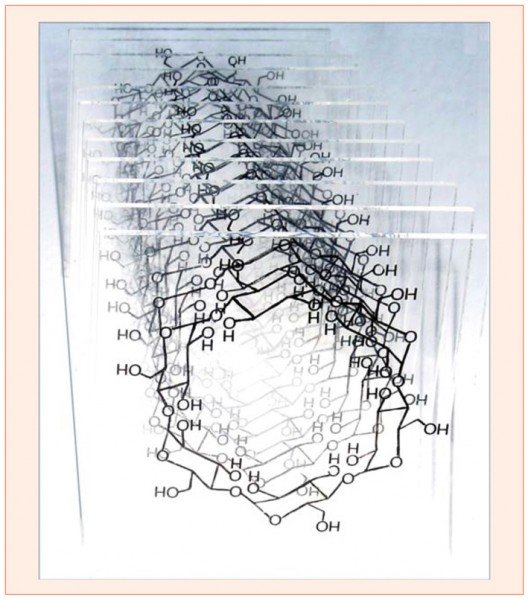
- Röhrchen bilden sich manchmal spontan, etwa wenn sich Cyclodextrine zusammenlagern (Abb. 14 und 8. Essay, Abb. 15).
- Membrankanäle bilden beispielsweise die linearen Gramicidine und die Polyen-Antibiotika, insbesondere sind sie aber Targets, an welchen die Wirkmechanismen zahlreicher Arzneistoffe ablaufen.
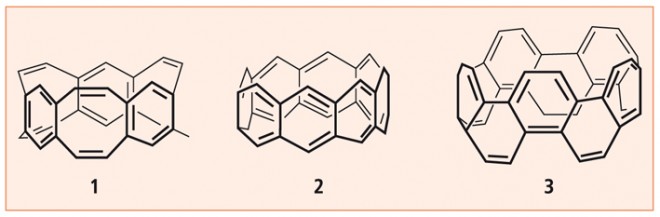
Ob die Cyclacene (Abb. 15), die kürzlich von R. Gleiter und Mitarbeitern synthetisiert wurden, einmal als "Nanotubes" therapeutische Bedeutung erlangen werden, steht noch in den Sternen.
Literatur beim Verfasser
Autor
Prof. Dr. rer. nat. Dr. h. c. Hermann J. Roth,
Friedrich-Naumann-Str. 33,
76187 Karlsruhe,
www.h-roth-kunst.com,
info@h-roth-kunst.com























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.