
- DAZ.online
- DAZ / AZ
- DAZ 42/2009
- Biosimilars auf dem ...
DPhG-Jahrestagung
Biosimilars auf dem Vormarsch
Die Wirkstoffe von Biopharmazeutika sind Proteine, die in einem mehrstufigen Prozess von lebenden Zellen produziert, anschließend isoliert und in eine applizierbare Form überführt werden. Während dieses Herstellungsprozesses kommt es zu natürlichen Schwankungen ("Batch-to-batch-Variabilität"), denn die Zellen produzieren neben der für das Arzneimittel gewünschten Substanz zahlreiche andere Proteine, von denen das Endprodukt schließlich gereinigt werden muss. Dies ist der Grund, weshalb biotechnologisch erzeugte Wirkstoffe nicht wie die klassischen Arzneistoffe nur durch ihre physikalischen und chemischen Eigenschaften, sondern zusätzlich durch das komplette Herstellungsverfahren definiert werden müssen ("The process is the product").
Biosimilar versus Generikum
Zu den Biopharmazeutika zählen Hormone (z. B. Wachstumshormone), hämatopoetische Wachstumsfaktoren (z. B. Erythropoetin), Immunmodulatoren (z. B. β-Interferon), monoklonale Antikörper (z. B. Trastuzumab), Blutgerinnungsfaktoren, Enzyme und Impfstoffe. Bereits 1998 begannen einige Generikafirmen mit der Entwicklung von Nachfolgeprodukten für biotechnologisch erzeugte Wirkstoffe, um sie nach dem Patentablauf der Originalpräparate auf den Markt bringen zu können. Da jedoch wegen der Schwankungen im Herstellungsprozess Referenz- und Nachfolgeprodukt nie völlig identisch, sondern nur ähnlich sein können, wurde der Begriff Biosimilar eingeführt. Er beschreibt, dass ein Biopharmazeutikum hinsichtlich des molekularen Aufbaus, der Qualität, Wirksamkeit, Verträglichkeit und Sicherheit dem Referenzprodukt erwiesenermaßen entspricht. Ein Vorteil bei der Entwicklung von Biosimilars liegt darin, dass dabei Technologien zum Einsatz kommen können, die zum Zeitpunkt der Zulassung des Originalpräparats noch nicht verfügbar waren. Dadurch ist es möglich, dass ein Biosimilar Vorteile gegenüber dem Original aufweist, z. B. eine längere Haltbarkeit.
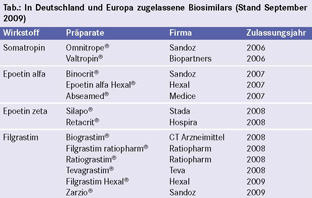
Gegenwärtig sind in Deutschland und Europa 13 Biosimilars zugelassen (siehe Tab.). Ab dem Jahr 2013 laufen die Patente für einige monoklonale Antikörper (z. B. Rituximab) aus; daher gewinnt gegenwärtig die Entwicklung von Follow-on-Versionen monoklonaler Antikörper für die Pharmaindustrie an Bedeutung.
Unterschiede bei der Zulassung
Biosimilars werden von der Europäischen Arzneimittelagentur EMEA in einem zentralen Verfahren zugelassen. Die rechtlichen Grundlagen dafür wurden im Jahre 2004 geschaffen. Inzwischen hat die EMEA eine Reihe von Richtlinien veröffentlicht, die die präklinischen und klinischen Anforderungen an die Zulassung von Biosimilars ausführlich beschreiben. Ein wichtiger Unterschied ist dabei, dass für die Zulassung eines Biosimilars präklinische und (fallweise) klinische Studien bis Phase III durchgeführt werden müssen, während bei den klassischen Generika der Nachweis der Bioäquivalenz meist ausreichend ist. Die Schwerpunkte und Anforderungen an die Phase-III-Studien sind produktspezifisch, das heißt für die einzelnen Biosimilar-Klassen unterschiedlich. So verlangt die EMEA beispielsweise für rekombinantes humanes Insulin keine klinischen Prüfungen an Patienten. Für Erythropoetin dagegen werden zwei kontrollierte Studien im randomisierten Parallelgruppendesign bei Patienten mit renaler Anämie vorausgesetzt.
Einsparpotenzial von Biosimilars
Berechnungen und Schätzungen von Gesundheitsökonomen verdeutlichen, dass durch den Einsatz von Biosimilars die Kosten im Gesundheitswesen reduziert werden können. So wurden beispielsweise nach Angaben von Prof. Dr. Bertram Häussler vom IGES Institut ein Jahr nach Einführung des Epoetin-alfa-Biosimilars (Fa. Hexal) eine Einsparung von 60 Millionen Euro erzielt. Laut einer von der Firma Hexal in Auftrag gegebenen Studie dieses Instituts könnten die Krankenkassen in Deutschland in den nächsten zwölf Jahren durch den Einsatz von Biosimilars 8,1 Milliarden Euro einsparen. Ab 2017 werden Einsparungen in Höhe von 1 Mrd. Euro pro Jahr erwartet.
cb





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.