
- DAZ.online
- DAZ / AZ
- DAZ 13/2010
- DNA-Kontamination in ...
Arzneimittel und Therapie
DNA-Kontamination in Rotarix
Somit sind alle Studien, die der Hersteller GlaxoSmithKline mit Rotarix® durchgeführt hat – immerhin laut Herstellerangaben mit insgesamt 90.000 Studienteilnehmern – und auch alle bisher durchgeführten Impfungen mit den weltweit ca. 69 Millionen Dosen ebenfalls in Anwesenheit der PCV-1-DNA durchgeführt worden. Sicherlich zeigt das gewissermaßen, dass diese Kontamination nicht schädlich ist, aber rechtfertigt diese Beobachtung, dass der Hersteller jetzt erstmal so weitermacht, wie bisher bis denn der Prozess so umgestellt wurde, dass sicher keine PCV-1-DNA mehr enthalten ist?
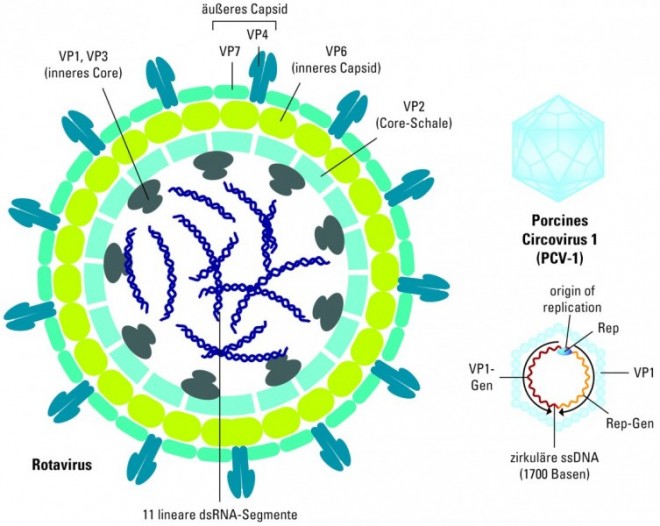
Rotavirus-Infektionen
1973 wurde das Virus erstmals beschrieben und wegen seines Rad-ähnlichen Aussehens im Elektronenmikroskop als Rotavirus bezeichnet. Es gehört zur Familie der Reoviridae und weist ein doppelsträngiges RNA-Genom aus elf Segmenten auf, wobei jedes Segment für ein Virusprotein codiert: sechs Strukturproteine (VP1-VP4, VP6, VP7) und fünf Nicht-Strukturproteine (NSP1-NSP5). Umhüllt wird das Genom zunächst von dem sogenannten Core, um das noch ein inneres und ein äußeres Capsid liegen. VP6 bildet das innere Capsid. Es ist das mengenmäßig dominierende Protein und die Zielstruktur bei den einfachen Virus-Nachweismethoden. Das Glykoprotein (G-Protein) VP7 und das Protease-geschnittene Protein (P-Protein) VP4 bilden das äußere Capsid. VP4 und VP7 definieren die verschiedenen Virus-Serotypen und sind wichtige Strukturen für die Entwicklung eines Impfstoffes. Sieben verschiedene Rotavirus-Gruppen wurden bisher beschrieben und mit A bis G durchnummeriert. Nur die Gruppen A, B und C infizieren den Menschen, und die Gruppe A, die wiederum mehrere Stämme umfasst, ist für die meisten Infektionen im Kindesalter verantwortlich. Die genauere Klassifizierung der Stämme basiert auf den Unterschieden in VP7 (G) und VP4 (P). Weltweit sind die G-Serotypen 1-4 und die P-Genotypen P[8] und P[4] am häufigsten vertreten.
Der Erreger ist hoch kontagiös, und bereits zehn Viruspartikel genügen, um ein Kind zu infizieren. Die Rotaviren vermehren sich sehr rasch in den Zellen des Dünndarms, was dazu führt, dass Wasser und Salz nicht mehr resorbiert werden können und es zu starkem Durchfall kommt. Ein Infizierter scheidet mit 1 ml Stuhl etwa zehn Milliarden Viruspartikel aus. Eine Rotavirusinfektion wird durch direkten Kontakt mit Infizierten oder mit kontaminierten Personen bzw. Gegenständen (fäkal-oral) oder auch über Atemwegssekrete übertragen. Das Virus ist äußerst resistent gegenüber Umwelteinflüssen und weitgehend unempfindlich gegenüber Seifen und Desinfektionsmitteln.
Laut WHO-Angaben gehen ca. 40% der schweren Durchfälle bei Kindern auf das Konto des Rotavirus und führen jährlich zu ungefähr 527.000 Todesfällen – überwiegend bei Kindern unter zwei Jahren und überwiegend in Süd- und Südostasien sowie in afrikanischen Ländern südlich der Sahara.
Derzeit sind zwei lebend-attenuierte Impfstoffe verfügbar, die oral angewendet werden. In Deutschland gehört eine Impfung gegen Rotavirus-Infektionen nicht zu den von der STIKO empfohlenen Regelimpfungen [2, 3].
| Tab. 1: Rotavirus-Impfstoffe im Vergleich | ||
| Rotarix® (GlaxoSmithKline) | RotaTeq® (Merck & Co., Inc.) | |
| Ursprung | Human, monovalent; gezüchtet in Vero- Zellen | Human-bovine Ressortante, pentavalent; gezüchtet in Vero-Zellen |
| Enthaltene Serotypen | G1, P[8] | G1, G2, G3, G4, P[8] |
| Impfschutz gegen | G1P[8], G2P[4], G3P[8], G4P[8], G9P[8] | G1P1[8], G2P[4], G3P1[8], G4P1[8], G9P1[8] |
| Anwendung | 2 Impfungen (mit DTP1, DTP2) ab 6 Wochen | 3 Impfungen (mit DTP1, DTP2, DTP3) ab 6 Wochen |
| Darreichungsform | Oral, Applikator | Oral, Dosiertube |
| Gleichzeitige Impfung möglich mit | Polio (IPV), DTaP, DTwP, HepB, Hib, Pneumokokken (PCV), MenCC | Polio (IPV), DTaP, HepB, Hib, Pneumokokken (PCV), MenCC |
| Preis/Dosis* [Euro] | 67,97 | 58,39 |
* laut Rote Liste® 2009
Die Impfstoffe
Rotarix® ist ein oral zu applizierender Impfstoff, der pro Dosis (1 ml) mindestens 106,0 ZKID50 (Zellkultur-Infektionsdosis 50%) lebende, attenuierte humane Rotaviren (Stamm RIX4414) enthält, die in Vero-Zellen, einer Nierenzelllinie aus der Grünen Meerkatze, in einem Saatgut-Prozess hergestellt wurden. Dabei wird das Arbeits-Saatgut durch einen zusätzlichen Kultivierungs-Schritt aus dem Master-Saatgut gewonnen, an den kein DNA-Abreicherungsschritt angeschlossen wird.
Die Viren werden nach der Vermehrung zunächst von den Zellresten der Vero-Zellen abgetrennt. Durch Behandlung mit Benzonase sowie einer anschließenden Ultrafiltration wird eventuell noch vorhandene DNA hydrolysiert und verbliebene Oligonukleotide werden abgetrennt. Nach weiteren Dia- und Sterilfiltrationsschritten wird der Impfstoff endformuliert und steht für die Verimpfung zur Verfügung.
Der Impfstoff wird in zwei Dosen an Säuglingen im Alter ab sechs Wochen verabreicht um einer Rotavirus-bedingten Gastroenteritis vorzubeugen. Zwischen den einzelnen Dosen ist ein Zeitabstand von mindestens vier Wochen einzuhalten. Die Impfung sollte vorzugsweise vor dem Alter von 16 Wochen verabreicht werden, muss aber auf jeden Fall bis zum Alter von 24 Wochen abgeschlossen sein. In klinischen Studien zeigte sich, dass Rotarix® vor einer Gastroenteritis schützt, die durch die Subtypen G1P[8], G2P[4], G3P[8], G4P[8] und G9P[8] hervorgerufen wird.
2009 lagen die weltweiten Verkaufszahlen von Rotarix® bei 440 Millionen US-Dollar und damit um 50% höher als noch 2008 [4, 5].
Der zweite zugelassene Impfstoff RotaTeq® enthält pro Dosis lebende human-bovine Rotavirus-Reassortanten der Serotypen G1 (mind. 2,2 x 106 infektiöse Einheiten, IE), G2 (mind. 2,8 x 106 IE), G3 (mind. 2,2 x 106 IE), G4 (mind. 2,0 x 106 IE) und P1[8] (mind. 2,3 x 106 IE), die ebenfalls in Vero-Zellen gezüchtet wurden. Für die Immunisierung sollten drei Dosen (je 2 ml) RotaTeq® ab Vollendung der 6. Lebenswoche mit einem Abstand von mindestens vier Wochen bis zur Vollendung der 26. Lebenswoche verabreicht werden. In klinischen Studien zeigte sich, dass RotaTeq® vor einer Gastroenteritis schützt, die durch die Subtypen G1P1[8], G2P[4], G3P1[8], G4P1[8] und G9P1[8] hervorgerufen wird. Laut FDA-Angaben ist dieser Impfstoff nicht mit PCV-1-DNA kontaminiert.
Für 2009 lag der weltweite Umsatz mit RotaTeq® bei ca. 565 Millionen US-Dollar [5, 6].
Porcine Circoviren (PCV)
Porcine Circoviren gehören zur Familie der Circoviridae, einer Gruppe kleiner, ca. 17 nm großer Viren, die keine Membranhülle, aber ein ikosaedrisches Capsid aufweisen. Das Genom besteht aus einer zirkulären, einzelsträngigen DNA von ca. 1800 bis 2000 Nukleotiden Länge. Circoviren infizieren spezifisch Zellen von Schweinen oder Vögeln. Für die Virus-Vermehrung wird das Genom im Kern der Wirtszelle zunächst mithilfe des viralen Replikationsproteins (Rep) und der zellulären DNA-Polymerase zu einem Doppelstrang ergänzt und dann über einen Rolling-circle-Mechanismus weiter vermehrt. Der DNA-Doppelstrang dient auch als Matrize für die Transkription der mRNAs. Von den Schweine-spezifischen Circoviren sind zwei Typen bekannt: PCV-1 und PCV-2. Das PCV-1-Genom trägt nur die beiden Leserahmen für das Rep- und für das Capsidprotein und infiziert zwar Schweine, ist aber nicht pathogen und ist deshalb sehr weit verbreitet. Demgegenüber codiert das Genom von PCV-2 noch für zwei zusätzliche Proteine, das Nicht-Strukturprotein NS0 sowie das Protein ORF3 und ist der Erreger des sogenannten post-weaning multisystemic wasting syndrome (PMWS) sowie des porcinen Dermatitis- und Nephropathie-Syndroms (PDNS) [7].
Positives Nutzen/Risiko-Verhältnis?
Sowohl die Europäische Zulassungsbehörde EMA als auch die nationale Zulassungsbehörde im Paul-Ehrlich-Institut (PEI) haben ein positives Nutzen/Risiko-Verhältnis für den Impfstoff festgestellt, da PCV-1 apathogen für den Menschen ist und die Durchseuchung der Schweinepopulation mit PCV-1 so hoch ist, dass man z. B. beim Verzehr von rohem Schweinfleisch in Hackbrötchen ebenfalls PCV-1 oral aufnimmt.
Das PEI weist ferner darauf hin, dass die PCV-1-DNA jetzt mit einer neuen, sehr empfindlichen Nukleinsäure-Amplifizierungsmethode (Polymerase-Kettenreaktion, PCR) in Kombination mit einer schnellen und breiten DNA-Sequenzidentifizierung gefunden wurde. Mit dieser Technik lassen sich jetzt auch solche Verunreinigungen nachweisen, die man vor einigen Jahren wegen der methodischen Beschränkungen nicht hätte finden können. Allerdings hat die EMA den Hersteller nachdrücklich dazu angehalten, möglichst schnell die Ursache der Verunreinigung zu finden und Maßnahmen zu ergreifen, zukünftig Impfstoff herzustellen, der frei von PCV-1-DNA ist [8, 9, 10].
Eine Wertung aus pharmazeutischer Sicht: Prozessmodifikation ist geboten!Das Prinzip "The process is the product", das heute für alle biotechnologischen Arzneimittel gilt, besagt, dass ein Wirkstoff auf Basis eines in allen Einzelheiten spezifizierten Herstellungsprozesses nach dem Stand des Wissens mit einer höchst möglichen Reproduzierbarkeit hergestellt und dann klinisch getestet wird. Bei dieser klinischen Testung kommt der Bewertung der Sicherheit eine herausragende Bedeutung zu. Diese Prüfung hat der Impfstoff Rotarix® positiv bestanden, was zu einer positiven Nutzen/Risiko-Bewertung durch nationale und internationale Zulassungsbehörden geführt hat. Aus pharmazeutischer Sicht ist es allerdings jetzt, nachdem die "Verunreinigung" mit einem viralen Genom gezeigt wurde, dringend geboten, den Prozess so zu modifizieren, dass die virale DNA unter die Nachweisgrenze bzw. unter eine zu definierende Rest-DNA-Menge gedrückt wird. Dies scheint auch GlaxoSmithKline zu akzeptieren, denn in einer am 26. März 2010 verbreiteten Pressemitteilung heißt es, dass man sich bei GlaxoSmithKline natürlich alternativlos zu einer hohen pharmazeutischen Qualität der eigenen Produkte verpflichtet fühlt. Man habe damit begonnen, den Herstellungsprozess zu evaluieren und zeitnah vor allem das offensichtlich mit einer Fremd-DNA verunreinigte Saatgutvirus zu ersetzen. Ferner teilen sowohl das Unternehmen und die EMA mit, dass nach Sichtung der Dokumentation zu anderen Lebendimpfstoffen von GlaxoSmithKline keine Hinweise erkennbar wurden, dass auch hier eine Verunreinigung mit PCV-1-Genomen vorliegen könnte. Andererseits sollte in diesem Zusammenhang aber auch betont werden, dass die klinische Evidenzlage für die Sicherheit von Rotarix® überwältigend ist, so dass kein Grund besteht, die Bevölkerung durch theoretische Überlegungen über die Einschätzung der europäischen und nationalen Zulassungsbehörden hinaus weiter zu verunsichern. Dies sollten vor allem auch Apothekerinnen und Apotheker beherzigen, die vielleicht von besorgten Patientinnen und Patienten oder von Ärzten hinsichtlich der klinischen Relevanz diese pharmazeutischen Qualitätsproblems um Rat gefragt werden. Dr. Ilse Zündorf, Prof. Dr. Theo Dingermann
|
Literatur [1] www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm205625.htm: Components of Extraneous Virus Detected in Rotarix Vaccine; No Known Safety Risk; 22.3.2010. [2] www.rki.de: RKI-Ratgeber Infektionskrankheiten – Merkblätter für Ärzte: Rotaviren. [3] http://www.who.int: Diarrhoeal Diseases – Rotavirus. [4] www.ema.europa.eu: EPAR Rotarix® [5] Dow Jones Pressemitteilung, 23.3.2010: FDA: GSK-Impfstoff "Rotarix" sollte vorerst nicht angewandt werden. [6] www.ema.europa.eu: EPAR RotaTeq® [7] Cheung, A.K.: Comparative analysis of the transcriptional patterns of pathogenic and nonpathogenic porcine circoviruses. Virology 310 (2003) 41– 49. [8] www.ema.europa.eu: European Medicines Agency statement on new information on Rotarix oral vaccine; Pressemitteilung vom 22. 3. 2010. [9] http://www.pei.de: Informationen zum Lebendvirusimpfstoff Rotarix; Pressemitteilung vom 22.3.2010. [10] www.ema.europa.eu: European Medicines Agency sees no safety concerns with the Rotarix oral vaccine; Pressemitteilung vom 26.3.2010.




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.