
- DAZ.online
- DAZ / AZ
- DAZ 34/2010
- Salbengrundlagen und die ...
Biopharmazie
Salbengrundlagen und die Wasserabgaberate der Haut
Was ist TEWL ?
Die Bestimmung des transepidermalen Wasserverlustes (TEWL) erlaubt eine Aussage über die Barrierefunktion der Haut. Gemessen wird hierbei, wie viel körpereigenes Wasser eine bestimmte Fläche der Haut in einem bestimmten Zeitraum abgibt. Je kleiner der TEWL-Wert ist, desto besser ist die Barriere- oder Schutzfunktion der Haut, und desto weniger Wasser geht verloren.
Die äußerste Schicht der Epidermis ist das Stratum corneum (SC). Sein Aufbau lässt sich anschaulich mit einer Ziegelsteinmauer vergleichen, wobei die Korneozyten den Ziegelsteinen und die Lipidmatrix dem Mörtel entsprechen. Korneozyten bestehen hauptsächlich aus Keratin und haben ein hohes Wasseraufnahmevermögen, die Lipidmatrix hingegen besteht aus Ceramiden, Cholesterol und Fettsäuren. Aufgrund dieser Kombination hemmt das SC die Verdunstung von Wasser aus dem Körperinneren und schützt es zugleich vor dem Eindringen von exogenen Substanzen.
Sowohl bei der Dicke als auch bei den Barriereeigenschaften des SC gibt es interindividuelle und intraindividuelle Unterschiede. So können für gesunde Haut mit intakter Barrierefunktion TEWL-Werte unter 10 g/hm² gefunden werden, wohingegen bei kritischem Hautzustand mit gestörter Barrierefunktion Werte über 30 g/hm² vorkommen können [1].
In der Kosmetik wird die TEWL-Messung oft angewendet, um die Wirkung verschiedener Formulierungen während einer längeren Anwendungsdauer zu testen. Erwünscht ist, dass die TEWL-Werte im Laufe der Behandlung abnehmen.
Wir haben dagegen getestet, in welchem Maße die einmalige Applikation verschiedener Salbengrundlagen die Wasserabgabe über die Haut beeinflusst. Der TEWL umfasste hier nicht nur das körpereigene Wasser, sondern auch Wasser, das aus der applizierten Salbengrundlage in das SC aufgenommen und anschließend wieder daraus freigesetzt wurde.
Untersuchte Salbengrundlagen
Es wurden fünf verschiedene halbfeste Zubereitungen mit unterschiedlichem Wassergehalt getestet:
Zubereitung |
Wassergehalt |
| Weißes Vaselin Ph. Eur. 6 | 0% |
| Basiscreme DAC | 40% |
| Wasserhaltige hydrophile Salbe DAB 2009 | 70% |
| Hydroxyethylcellulosegel DAB 2009 | 87,5% |
| Wasserhaltiges Carbomergel DAB 2009 | 96,5% |
Foto: Hahn
Messmethode
Der TEWL wurde mit einer offenen Sonde (Multiprobe-Adapter (MPA-9)-System, Courage + Khazaka, Köln, mit Tewameter®-Sonde, Typ TCC-300) gemessen; die Messwerte wurden vom angeschlossenen Computer mit der Software MAP 5 (Courage + Khazaka) aufgezeichnet. Der Kopf der Sonde hat die Form eines Hohlzylinders mit 1 cm Durchmesser und 2 cm Höhe (Abb. 1). An der Innenwand befinden sich jeweils zwei Feuchtigkeits- und Temperatursensoren, welche den Gradienten des partiellen Wasserdrucks messen, der dann von einem Mikroprozessor in den TEWL-Wert umgerechnet wird.
Die TEWL-Werte werden 75 Sekunden lang im Sekundentakt aufgezeichnet. Da der Sensor erst nach etwa 15 Sekunden stabile Messwerte liefert, wurden bei der anschließenden Berechnung des summarischen TEWL-Wertes die ersten 15 Messwerte nicht berücksichtigt, sondern nur die folgenden 60 Messwerte.
Die Messung mit der offenen Sonde ("offene Kammer") übt – anders als die Messmethode der geschlossenen Kammer – keinen Einfluss auf die Haut aus [2, 3]; daher ist eine kontinuierliche Messung möglich.
Alle Messungen wurden nachmittags unter gleichbleibenden Raumbedingungen durchgeführt, da deren Veränderung die Messwerte verfälschen kann [3, 4]. Die Luftfeuchtigkeit betrug 40 bis 50%, die Temperatur 22 °C.
MessprogrammFolgende Parameter wurden bei den Messungen variiert:
|
Applikation und Messzeitpunkte
Die Salbengrundlagen wurden auf die Unterarme und Handrücken von 13 weiblichen Probanden im Alter zwischen 23 und 37 Jahren aufgetragen. Alle Probandinnen wiesen einen gesunden Hautzustand auf und waren angewiesen, ihre Haut am Versuchstag nicht einzucremen.
Die für den Test ausgewählten Hautareale ("Testfelder") waren kreisförmig und so groß (7 cm²), dass man die Messsonde bequem in ihrer Mitte aufsetzen konnte (Abb. 2 und 3). Zuerst wurden die TEWL-Ausgangswerte aller Testfelder gemessen. Anschließend wurden auf die Testfelder jeweils 0,2 g Zubereitung mit einem durch Latexhandschuhe geschützten Zeigefinger, der mit derselben Zubereitung vorgesättigt war, aufgebracht, gut verteilt und etwa zehn Sekunden lang leicht einmassiert, was der üblichen praktischen Anwendung entspricht. Nach einer Inkubationszeit von 15 bzw. 45 min wurde die Zubereitung mit einem Einmaltuch abgewischt. Der TEWL wurde erneut gemessen, und zwar bei allen Testfeldern direkt nach dem Abwischen sowie bei einigen Testfeldern nochmals 10 min später.
Getestete Hautstellen
An unterschiedlichen Hautstellen können sehr unterschiedliche TEWL-Werte auftreten [3]. Deshalb wurde der TEWL sowohl am Unterarm (die übliche Stelle für In-vivo-Versuche) als auch auf dem Handrücken gemessen.
Die Ausgangwerte am Unterarm sind mit 8,7 ± 1,8 g/hm2 statistisch signifikant kleiner als die Werte auf dem Handrücken mit etwa 12,8 ± 3,2 g/hm2. Dies liegt vermutlich daran, dass die Haut am Handrücken deutlich stärker beansprucht ist, z. B. durch häufiges Händewaschen und stärkere Exposition gegenüber Licht und Luft. Als weiteres Ergebnis konnte festgehalten werden, dass kein signifikanter Unterschied zwischen den Körperseiten besteht. Daher wurden die Messwerte unabhängig von der Körperseite analysiert.
Testreihen am Unterarm
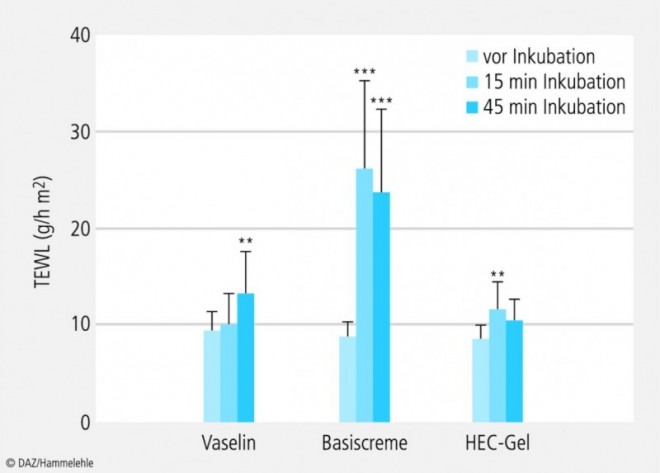
Die Testfelder auf beiden Unterarmen wurden mit den Zubereitungen Weißes Vaselin, Basiscreme und Hydroxyethylcellulosegel (HEC-Gel) entweder 15 min oder 45 min inkubiert. Direkt nach der Entfernung der Zubereitungen wurde der TEWL jedes Testfeldes gemessen.
Weißes Vaselin: Nach 45 min Inkubation mit Vaselin hat sich der TEWL im Vergleich zum Ausgangswert statistisch signifikant verändert, während sich nach 15 min Inkubation kein signifikanter Effekt zeigte (Abb. 4). Vaselin ist eine hydrophobe Salbengrundlage, die aus einem Gemisch von flüssigen und festen Paraffinen besteht. Erst während der 45-minütigen Inkubationszeit macht sich eine Okklusion bemerkbar: Das Wasser kann nicht mehr über die Haut austreten, es kommt zum Feuchtigkeitsstau im SC und infolge dessen zur Quellung der Haut. Dadurch wird die Haut durchlässiger (diesen Effekt macht man sich bei der transdermalen Arzneistoffapplikation zunutze) und gibt nach Beendigung der Inkubation mehr Feuchtigkeit ab.
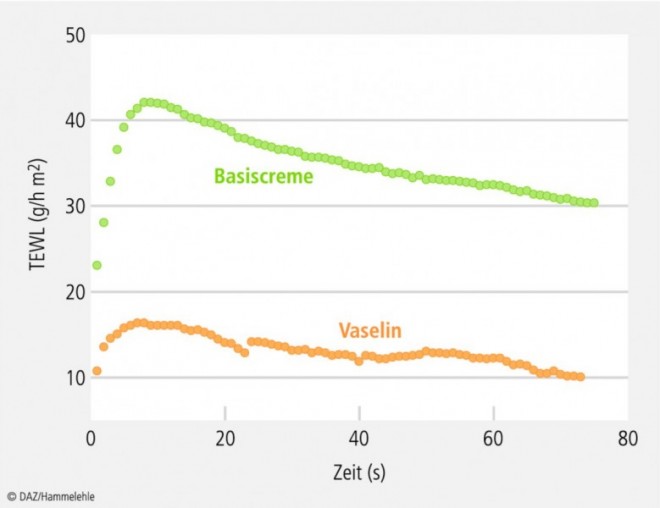
Basiscreme: Bei den TEWL-Werten der Basiscreme-Testreihe besteht ein statistisch signifikanter Unterschied zwischen unbehandelter und behandelter Haut, aber nicht zwischen den beiden Inkubationszeiten (Abb. 4). Auffallend sind die sehr hohen Standardabweichungen der Messwerte nach der Inkubation. Diese hängen damit zusammen, dass die TEWL-Werte während der Messung stetig abnehmen (Abb. 5). Aufgrund dieser Tatsache wurden bei den folgenden Testreihen die TEWL-Werte 10 min nach Entfernen der Salbengrundlage nochmals gemessen, um herauszufinden, ob sie dann stabil sind.
Hydroxyethylcellulosegel: Auch bei den TEWL-Werten des HEC-Gels ist ein signifikanter Unterschied zwischen unbehandelter und 15 min inkubierter Haut zu erkennen (Abb. 4). Dagegen ist der Unterschied zwischen unbehandelter Haut und 45 min inkubierter Haut nicht statistisch signifikant. HEC-Gel besteht zu 87,5% aus Wasser, zu 10% aus Glycerol und zu 2,5% aus dem Gelbildner HEC. Durch die schnelle Verdunstung des Wassers aus dem HEC-Gel bildet sich ein Film auf der Haut. Daher steht nicht mehr so viel Wasser zur Penetration in das SC zur Verfügung, und die TEWL-Werte ändern sich nicht so stark wie bei der Basiscreme.
Da sich nur bei Vaselin deutliche Unterschiede der TEWL-Werte nach 15 min bzw. 45 min Einwirkzeit ergaben, wurde in den folgenden Versuchen stets eine Inkubationszeit von 15 min gewählt. Außerdem erschien das HEC-Gel wegen der Filmbildung als ungeeignet und wurde deshalb nicht weiter getestet.
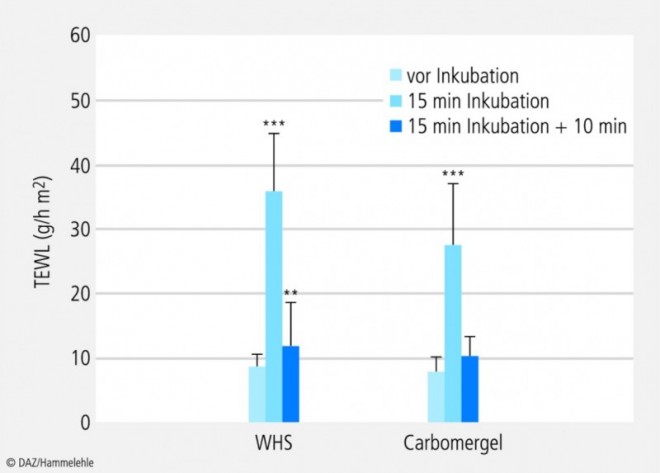
WHS und Carbomergel: Die Testfelder wurden mit Wasserhaltiger hydrophiler Salbe (WHS) oder Wasserhaltigem Carbomergel 15 min inkubiert. Der TEWL wurde jeweils vor dem Auftragen der Zubereitung, direkt nach ihrer Entfernung und 10 min später gemessen (Abb. 6).
Auf den ersten Blick ist erkennbar, dass nach 15 min Inkubation die TEWL-Werte deutlich erhöht sind, dass dieser Effekt aber nicht anhält: Der 10 min später gemessene TEWL-Wert ist bei Carbomergel annähernd auf den Ausgangswert gefallen; auch bei WHS ist er gesunken, sein Unterschied zum Ausgangswert ist aber noch statistisch signifikant. WHS enthält 70% Wasser, welches teils gebunden, teils frei vorliegt [5]; das freie Wasser wird während der Inkubation in das SC aufgenommen und anschließend über eine längere Zeit wieder daraus freigesetzt. Daher ist auch nach 10 min noch eine erhöhte Feuchtigkeit in der Haut zu finden.
Diese Ergebnisse bestätigen frühere Studien, die gezeigt haben, dass die Hydratisierung der Haut ein vorübergehender Zustand ist, welcher nach Entfernen der Salbengrundlage stetig abnimmt [6].
Testreihen am Handrücken
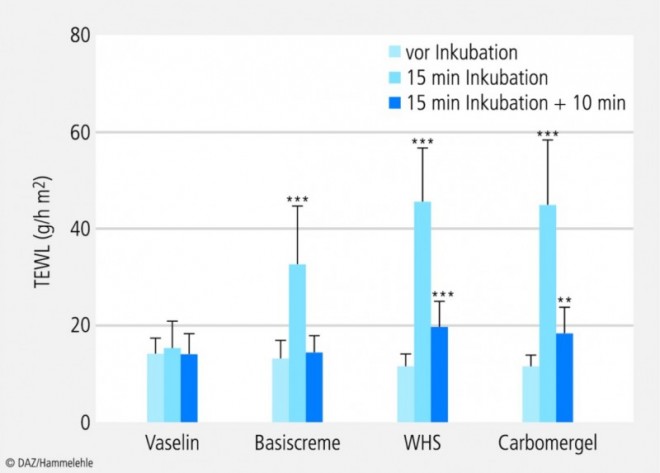
Um die am Unterarm erhaltenen Ergebnisse mit einer anderen Körperstelle vergleichen zu können, wurden Vaselin, Basiscreme, WHS und Carbomergel zusätzlich auf dem Handrücken von sechs Probandinnen getestet (Abb. 3). Auch hier wurde der TEWL sowohl sofort nach dem Entfernen der Salbengrundlage als auch 10 min später gemessen.
Alle getesteten Salbengrundlagen außer Vaselin haben den TEWL-Wert sehr stark erhöht. Es fällt auf, dass die Steigerung des TEWL vom Wassergehalt der applizierten Salbengrundlage abhängt. Vaselin war fast wirkungslos, während Basiscreme die TEWL-Werte mehr als verdoppelte und WHS und Carbomergel sie etwa vervierfachten (Abb. 7).
Auch 10 min nach dem Abwischen von WHS bzw. Carbomergel waren die TEWL-Werte noch signifikant erhöht, also weniger gefallen als beim Test dieser Salbengrundlagen am Unterarm.
Zusammenfassung und Fazit
Es gibt deutliche Unterschiede des TEWL an Unterarm und Handrücken, aber keine Unterschiede an den jeweils gleichen Körperteilen auf beiden Körperseiten. Bei der Behandlung der Haut mit den fünf Salbengrundlagen wurden sehr unterschiedliche Effekte auf den TEWL beobachtet:
Vaselin zeigte erst nach 45 min Inkubation einen Okklusionseffekt mit Erhöhung des TEWL.
Basiscreme bewirkte zwar schon nach 15 min Inkubation eine deutliche Steigerung des TEWL, aber keine weitere Steigerung bei längerer Inkubation; 10 min nach dem Abwischen war der TEWL wieder auf den Ausgangswert gesunken.
Bei HEC-Gel gab es keinen signifikanten Unterschied zwischen 15 min und 45 min Inkubation. Da sich nach 45 min ein fester Film auf der Haut bildet, erschien es ungeeignet, den TEWL zu beeinflussen.
Wasserhaltiges Carbomergel erhöhte den TEWL stark nach 15 min Inkubation. 10 min nach dem Abwischen war der TEWL-Wert nur noch auf dem Handrücken statistisch signifikant erhöht, aber nicht auf dem Unterarm.
Wasserhaltige hydrophile Salbe zeigte sowohl auf dem Handrücken als auch auf dem Unterarm eine statistisch signifikante Erhöhung des TEWL, auch noch 10 min nach dem Abwischen. Somit beeinflusste diese Salbengrundlage die Wasserabgabe der Haut am stärksten.
Diese Studie hat gezeigt, dass die verwendete Methode geeignet ist, mit geringem Aufwand den TEWL zu messen. Die Testreihen mit den mehr oder weniger wasserhaltigen Salbengrundlagen ergaben, dass die Wasserabgaberate der Haut durch extern zugeführtes Wasser stark verändert werden kann.
Literatur [1] Kalia YN, et al. Homogeneous Transport in a Heterogeneous Membrane: Water Diffusion Across Human Stratum Corneum In Vivo. Biophys J 1996;71: 2692 – 2700. [2] Cohen JC, et al. Comparison of closed chamber and open chamber evaporimetry. Skin Res Technol 2009;15:51– 54. [3] Pinnagoda J, et al. Guidelines for transepidermal water loss (TEWL) measurement. A report from the Standardization Group of the European Society of Contact Dermatitis. Contact Dermatitis 1990;22:164 –178. [4] Rogiers V. EEMCO guidance for the assessment of transepidermal water loss in cosmetic sciences. Skin Pharmacol Appl Skin Physiol 2001;14:117 – 128. [5] Junginger HE. Colloidal structures of O/W creams. Pharm Weekblad Sci Ed 1984;6:141 – 149. [6] Wiedersberg S, Leopold CS, Guy RH. Effects of various vehicles on skin hydration in vivo. Skin Pharmacol Physiol 2009;22:128 –130.
Korrespondenzautorin
Tsambika Hahn, Biopharmazie und Pharmazeutische Technologie, Universität des Saarlandes, Campus A4.1, 66123 Saarbrücken, t.hahn@mx.uni-saarland.de

























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.