
- DAZ.online
- DAZ / AZ
- DAZ 37/2010
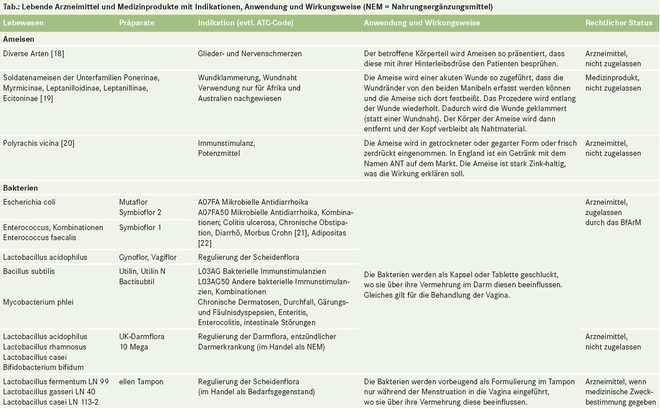
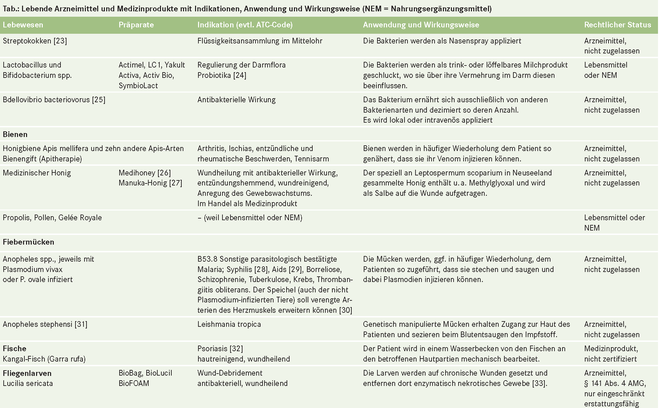
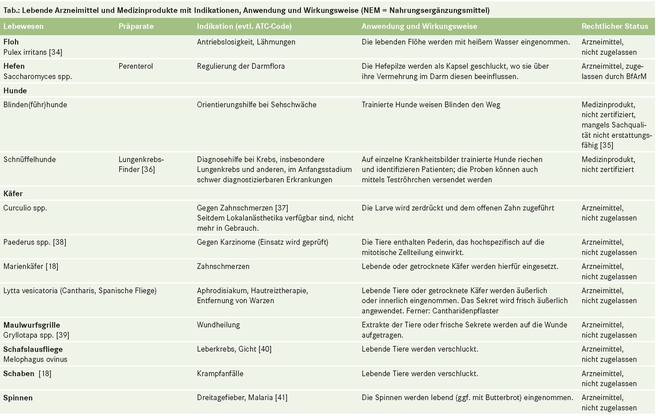
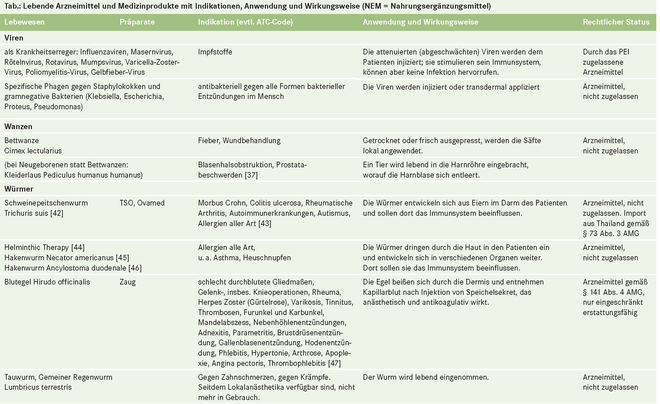
- Lebende Arzneimittel
Arzneimittelrecht
Lebende Arzneimittel
"Arzneimittel sind Stoffe oder Zubereitungen aus Stoffen" heißt es im Arzneimittelgesetz (§ 2 Abs. 1 AMG). Stoffe im Sinne des Gesetzes (§ 3 AMG Abs. 3) sind auch Tiere, z. B. Blutegel (Hirudo officinalis), Schafläuse (Melophagus ovinus) und Fliegenmaden (Lucilia sericata), die im lebenden Zustand angewendet werden [1], oder die Eier des Schweinepeitschenwurms (Trichuris suis) oder Krankheitserreger wie Plasmodien. (Präparate, die auch lebende Zellen, Gewebe oder Organe, aber keine ganzen lebenden Organismen umfassen [2, 3], sind im Folgenden nicht berücksichtigt.)
Lebende Tiere und Mikroorganismen, die zur Heilung von Menschen eingesetzt werden (medizinische Zweckbestimmung gemäß Richtlinie 2001/83/EG oder 93/42/EWG und Leitlinie MEDDEV 2.1/1), können Arzneimittel oder Medizinprodukte sein. Sie sind Arzneimittel, wenn ihre Heilwirkung hauptsächlich auf einem pharmakologischen, immunologischen oder metabolischen Prozess beruht. Abgesehen von Lebendimpfstoffen und einigen mikrobiellen Präparaten sind keine lebenden Arzneimittel in Deutschland zugelassen, wohl aber erhältlich und in steigender Anzahl in der ärztlichen Praxis oder beim Heilpraktiker zu finden.
Das Dilemma dieser Präparate liegt darin, dass eine Zulassung mangels ausreichend wissenschaftlich belegter Wirkung arzneimittelrechtlich kaum begründbar ist. "Wissenschaftsberichte" können gleichwohl nahezu ungehindert solche Therapien "bewerben", solange die Arzneimittel nicht als zulassungspflichtige Fertigarzneimittel (§ 4 Abs. 1 AMG) anzusehen sind, weil sie in Apotheken rezepturmäßig hergestellt und an Verbraucher abgegeben werden.
Die Rechtslage bei Fertigarzneimitteln …
Die Medizin wendet pharmakologisch, immunologisch oder metabolisch wirkende Stoffe als Arzneimittel an. Diese wurden in den vergangenen Jahrhunderten fast ausschließlich vom Apotheker auf ärztliches Rezept individuell angefertigt. Seit Beginn des 20. Jahrhunderts wurden immer mehr Arzneimittel industriell hergestellt. Dies veranlasste den Bundesgesetzgeber erstmals 1961 dazu, den Arzneimittelverkehr bundeseinheitlich zu regeln. Mit dem Contergan-Skandal traten die Schwächen des Arzneimittelgesetzes (AMG), welches kein Zulassungsverfahren für Fertigarzneimittel vorsah, deutlich zutage. Der Gesetzgeber reagierte – nicht zuletzt auch in Erfüllung europarechtlicher Vorgaben – und novellierte das Arzneimittelrecht zum 1.1.1978 grundlegend, indem er die Verkehrsfähigkeit eines Fertigarzneimittels davon abhängig macht, dass zuvor eine Zulassung erteilt wurde, die der pharmazeutische Unternehmer zu beantragen hat. Mit dem Antrag hat er die Qualität, Wirksamkeit und Unbedenklichkeit seines Arzneimittels darzulegen.
Ist ein Arzneimittel zugelassen, gilt es als unbedenklich, solange nicht Erkenntnisse, die nach der Zulassung gewonnen wurden, andere Interpretationen erzwingen. Kommt es gleichwohl zu einem Schaden infolge bestimmungsgemäßer Anwendung des Arzneimittels, greift die arzneimittelrechtliche Gefährdungshaftung gemäß § 84 AMG, sofern die schädigende Wirkung über ein nach den Erkenntnissen der medizinischen Wissenschaft vertretbares Maß hinausgeht oder der Schaden infolge einer nicht den Erkenntnissen der medizinischen Wissenschaft entsprechenden Kennzeichnung, Fachinformation oder Gebrauchsanweisung eingetreten ist. Wenn das jeweilige Arzneimittel prinzipiell geeignet ist, einen Schaden zu verursachen, wird vermutet, dass es diesen Schaden auch verursacht hat.
… und bei Rezepturarzneimitteln
Anders ist die Rechtslage, wenn Arzneimittel als Rezepturarzneimittel abgegeben werden: Pharmazeutischer Unternehmer ist dann der Apotheker, welcher zwar für Fehler des Arzneimittels nach dem Produkthaftungsgesetz sowie nach den allgemeinen Vorschriften der Verschuldenshaftung haftet, aber keinen Wirksamkeitsnachweis erbringen muss. Er stellt das Arzneimittel aufgrund einer Verordnung des Arztes (oder Heilpraktikers) her und ist hierzu sogar in der Regel verpflichtet, solange es sich nicht um ein bedenkliches Arzneimittel i. S. d. § 5 AMG handelt [4].
Der Arzt übernimmt mit seiner Entscheidung für eine bestimmte Arzneimitteltherapie die alleinige (haftungsrechtliche) Verantwortung dafür, dass seine Therapie vertretbar ist. Zu berücksichtigen ist dabei, dass seit Inkrafttreten der 15. AMG-Novelle im Juli 2009 auch der Arzt den Vorschriften des AMG unterliegt und sich u. a. strafbar macht, wenn er bedenkliche Arzneimittel anwendet.
Aus folgenden Gründen bergen lebende Arzneimittel besondere Risiken für den Patienten:
Sie sind per definitionem nicht steril (wären sie steril, wären sie nicht mehr lebend).
Sie sind (weil Lebewesen) unberechenbar, weshalb es besonders schwer nachzuweisen ist, dass sie den gestellten Qualitätsansprüchen genügen.
Dies gilt umso mehr, wenn sie nicht "isoliert" zum Einsatz kommen können, weil sie in Symbiose mit anderen Organismen leben.
So sind beim Blutegel regelmäßig Bakterien im Magen anzutreffen (Aeromonas hydrophila), die in die Blutbahn des Patienten gelangen können [5]. Da Blutegel auch vor der Anwendung Blut zu sich genommen haben, ist ihre Abgabe im Sinne des Transfusionsgesetzes laut Apothekenbetriebsordnung zu dokumentieren und 30 Jahre lang zu archivieren [6]. Auch Fliegenmaden aus der Schweiz, die dort desinfiziert und mit dem Vorbehalt der Unsterilität von einem Tierfutterhändler (ohne behördliche Genehmigung) zur Wundbehandlung angeboten werden [7], werden kaum die arzneimittelrechtlich zu fordernde Qualität vorweisen können.
Allgemein gilt, dass der Einsatz von nicht zugelassenen Fertigarzneimitteln verboten ist [8]. Dabei sind alle Arzneimittel, die von einer Apotheke "im Voraus", also nicht aufgrund eines einzelnen Rezeptes, sondern in Serie für ein Patientenkollektiv hergestellt werden, als Fertigarzneimittel anzusehen [9]. Der Charakter als Einzelrezeptur kann verloren gehen, wenn ein Arzneimittel systematisch beworben wird [10]. Die Voraussetzungen für eine zulassungsfreie defekturmäßige Herstellung von Fertigarzneimitteln sind durch § 21 Abs. 2 Nr. 1 AMG ebenfalls sehr eng gezogen [11].
Qualität lebender Arzneimittel
Die Qualität von Arzneimitteln unterliegt den höchsten rechtlichen und qualitativen Anforderungen, die niedergelegt sind in der Arzneimittel- und Wirkstoffherstellungsverordnung (AMWHV) und im EG-GMP-Leitfaden [12].
Die AMWHV findet "Anwendung auf Betriebe und Einrichtungen, die Arzneimittel oder Wirkstoffe, die zur Herstellung von Arzneimitteln bestimmt sind und die menschlicher oder tierischer oder mikrobieller Herkunft sind", also auch auf alle lebenden Arzneimittel. Sie stellt Anforderungen an ein vorhandenes Qualitätsmanagementsystem (§ 3 AMWHV), an das handelnde Personal (§ 4 AMWHV), an die Betriebsräume und an die verwendete Ausrüstung (§ 5 AMWHV), an die Hygiene (§ 6 AMWHV), an die Lagerung und den Transport (§ 7 AMWHV), an die Tierhaltung (§ 8 AMWHV) sowie weitere der pharmazeutischen Herstellung zugrunde liegende Gegebenheiten. Die Herstellung selbst muss in qualifizierter Umgebung nach validierten Verfahren (§ 13 AMWHV) durchgeführt werden. All diese Schritte sind bei lebenden Arzneimitteln mit besonderen Schwierigkeiten verbunden.
Beispiele
Schweinepeitschenwürmer werden aus dem Kot von Schweinen isoliert und dann zur Eiablage veranlasst. Die Eier werden sodann vom Patienten oral eingenommen. Hygienemaßnahmen und die Validierung des Verfahrens bereiten hier besondere Schwierigkeiten. Die Qualität wäre auch an der Schlupfrate der Eier zu messen – eine sehr schwer überprüfbare Messgröße.
Blutegel werden in der Türkei gesammelt und nach einer Wartephase in Deutschland angewendet. Die Forderungen einer Guten Herstellungspraxis sind hier nicht einfach realisierbar. Gleiches gilt für alle in der Natur gesammelten Organismen wie zum Beispiel Schafsläusen, die an Schafen gesammelt werden.
Auch für die Herstellung solcher Arzneimittel gilt der Annex 1 "Herstellung steriler Arzneimittel" des EG-GMP-Leitfadens, weil sie entweder
oral (fast alle Mikroorganismen wie z. B. Escherichia coli, ganze Tiere wie z. B. Trichuris suis oder Melophagus ovinus) oder
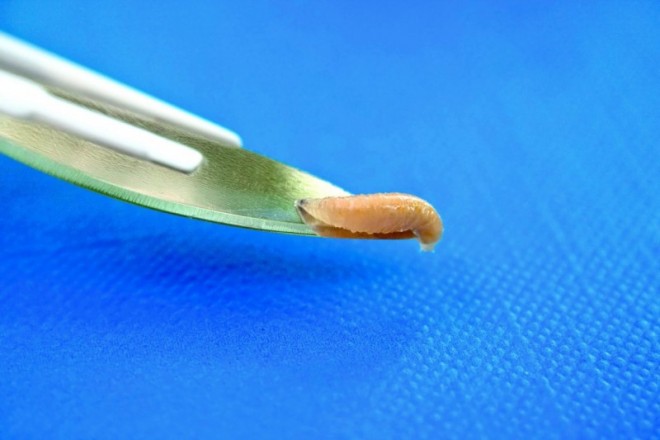
parenteral (Apis mellifera, Anopheles spp., Hirudo officinalis) oder durch Kontakt zu verletzter Haut (Lucilia sericata, Phagen) eingesetzt werden oder
auf andere Weise in den menschlichen Körper eindringen, wie Necator americanus.
Parenteralia und Präparate mit Kontakt zu verletzter Haut müssen steril sein, andere müssen ihre Qualität und Unbedenklichkeit auch mikrobiologisch belegen.
Nach §14 AMWHV sind die Arzneimittel schließlich in allen Schritten der Herstellung unter der Verantwortung des Leiters der Qualitätskontrolle zu prüfen, sodann zu kennzeichnen und nach § 16 AMWHV durch eine sachkundige Person (QP) für die Inverkehrbringung freizugeben.
Populär trotz fehlender Zulassung
Fliegenlarven, Plasmodien-übertragende Fiebermücken, Eier vom Schweinepeitschenwurm oder Phagen gehören nicht zum Standardsortiment deutscher Apotheken und können auch vom kundigen Mediziner in der benötigten Qualität nicht ohne erheblichen Aufwand selbst beschafft werden. Einige dieser Organismen werden von Spezialfirmen hergestellt und vertrieben. Andere sind nur auf dem "schwarzen (Internet-) Markt" erhältlich.
Ob der Apotheker die Produkte spezialisierter Hersteller abgeben darf, hängt von deren Verkehrsfähigkeit ab. In der Regel handelt es sich bei diesen Produkten um Fertigarzneimittel (§ 4 Abs. 1 AMG), die gemäß § 21 AMG der Zulassungspflicht unterliegen. Tatsächlich besitzt jedoch kein lebendes Arzneimittel (außer Mikroorganismen) in Deutschland eine Zulassung.
Es stellt sich die Frage, warum Therapien mit lebenden Arzneimitteln in Deutschland an Popularität gewinnen. Der Grund ist in vielen Fällen der gleiche: Die Patienten leiden unter einer Krankheit, auf welche die Schulmedizin keine Antwort hat, und sie gehen davon aus, dass eine "biologische" Therapie per se ungefährlich ist. So wurden genetisch manipulierte Anopheles zur "Impfung" gegen Leishmaniose vorgeschlagen, oder es werden Borreliose- oder HIV-Patienten mit Malaria infiziert, obwohl die ursprünglich zur Behandlung der (damals unheilbaren) Syphilis eingesetzte "Malariatherapie" (für die Julius Wagner-Jauregg 1927 den Nobelpreis für Medizin erhalten hatte) heute als obsolet gilt.
Auch die Verwendung von Schweinepeitschenwürmern findet zunehmend Anhänger. Medien berichten, dass für das Wohlbefinden eine Wurminfektion von Vorteil sei [13], und wecken bei schwerkranken Patienten irrationale Hoffnungen. Der "Fall" Regividerm, einer als Medizinprodukt vertriebenen Salbe gegen Neurodermitis, zeigt das Problem deutlich auf [14].
Angebot im Internet
Die meisten der in der Tabelle aufgelisteten Arzneimittel sind in Deutschland nicht als Fertigarzneimittel erhältlich und werden doch in teilweise erheblichem Umfang eingesetzt. Je größer der Leidensdruck der Patienten ist, wie zum Beispiel bei Colitis ulcerosa, Borreliose oder Krebs, desto mehr wächst ihre Bereitschaft, solche Arzneimittel via Internet zu bestellen und mit oder ohne ärztliche Unterstützung anzuwenden. Der nach dem deutschen Arzneimittelrecht formulierte Qualitätsstandard ist dann nicht mehr gewährleistet.
Zwar ist die Werbung für nicht zugelassene, aber zulassungspflichtige Arzneimittel gemäß Heilmittelwerbegesetz (§ 3a HWG) und § 8 AMG verboten. Nicht untersagt ist dagegen die Werbung für Rezepturarzneimittel. Zudem sind wissenschaftliche Berichte erlaubt, wobei die Wissenschaftlichkeit aber nicht selten zu wünschen übrig lässt.
Wirksamkeitsnachweis
Einige lebende Arzneimittel werden seit langer Zeit angewendet, sodass vielfältige Erfahrungen und Erfahrungsberichte vorliegen. Moderne klinische Studien sind jedoch selten. Uns sind für alle aufgelisteten höheren Organismen (also ohne die Mikroorganismen) folgende Studien bekannt:
eine Studie zur biochirurgischen Anwendung von Fliegenlarven [15], welche nur eine Teilwirkung (Debridement durch Larven in der Wundbehandlung) belegen konnte, und
eine Studie zu Trichuris suis [16], die hier nicht bewertet werden soll, sowie
- mehrere Studien über Blutegel [17].
Fazit
Aufgrund der hohen Qualitätsansprüche von Arzneimitteln können lebende Arzneimittel grundsätzlich nicht ohne Weiteres in Apotheken, sondern nur von darauf spezialisierten Firmen hergestellt werden. Dies ist uneingeschränkt nur auf der Basis einer Zulassung als Fertigarzneimittel erlaubt. Eine rezepturmäßige Herstellung in der Apotheke wiederum kommt nur in Betracht, wenn der Apotheker selbst substanzielle Herstellungsschritte für die Herstellung des Arzneimittels unternimmt.
Solange weder die Wirkstoffe in Art, Menge und Struktur noch ihre Wirkungsmechanismen bekannt sind und solange weder die sich daraus ableitende Wirksamkeit noch die Unbedenklichkeit klinisch belegt ist, sollten lebende Arzneimittel nur unter medizinischer Kontrolle und ärztlicher Verantwortung als Therapieversuch mit Rezepturarzneimitteln zum Einsatz kommen.
Quellen [1] Kloesel/Cyran: Kommentar zum AMG, § 3 (Stoffbegriff) Nr. 3 Blatt 151. [2] X. Boergen, C. Jäckel, J.-P. Spiegel: Lebende Arzneimittel. Pharma Recht 2008;30:357 – 400. [3] Michael Schmidt: Arzneimittel von Tieren. PTAheute 2010;24:30 – 33. [4] § 17 Abs. 4 ApBetrO; Cyran/Rotta, Kommentar zur Apothekenbetriebsordnung § 17 Rdnr. 485. [5] M. Roth: Ein Tier heilt Tiere – der medizinische Blutegel. ATM-Nachrichten 15:1 – 5; www.blutegel.de/egel/opencms/de/blutegel_de/animals.html [6] Apothekerkammer Nordrhein: Alternative Therapieformen, Rechtliches zu Eigenblutnosoden und Blutegeln in der Apotheke. Kammer im Gespräch 3/2009, S. 11. [7] Entomos AG, www.entomos.ch [8] J.K. Schweim, H.G. Schweim: Arzneimittel, Medizinprodukte und Nahrungsergänzungsmittel – ein Vergleich. DAZ.online, März 2010. [9] LSG Niedersachsen-Bremen, Urteil vom 15.2.2005, Az. L 4 KR 44/01. [10] OLG Köln, Urteil vom 21.3.2003, Az. 6 U 160/02. [11] Vgl. BVerwG, Urt. v. 9.3.1999, Az. 3 C 32/98; BGH, Urt. vom 23.6.2005, Az. I ZR 194/02. [12] Dagmar Krüger: GMP bei der Arzneimittel- und Wirkstoffherstellung. Wissenschaftliche Verlagsgesellschaft Stuttgart 2009. [13] Jörg Blech: Fehlkonstruktion Mensch: Warum wir für die moderne Welt nicht geschaffen sind. Der Spiegel 40/2009; A. Sommer, M. Schaefer: Quarks und Co., Fernsehsendung des WDR vom 13.10.2009, 21:00 – 21:45. [14] Klaus Martens, Karten Klingelhöller: "Heilung unerwünscht. Wie Pharmakonzerne ein Medikament verhindern", Fernsehsendung der ARD vom 21.10.2009; Martin U. Müller: Übler Nachgeschmack, Der Spiegel 44/2009; Doris Uhl: Dick aufgetragen: Der ARD-Film "Heilung unerwünscht". Dtsch. Apoth. Ztg. 2009;149:5014 – 5018. [15] J. C. Dumville, et al. on behalf of the VenUS II team: VenUS II: a randomised controlled trial of larval therapy in the management of leg ulcers. Health Technology Assessment 2009;13(55). DOI: 10.3310/hta13550, www.hta.ac.uk/pdfexecs/summ1355.pdf [16] R. W. Summers, et al.: Trichuris suis therapy for active ulcerative colitis: a randomized controlled trial. Gastroenterology 2005;128(4):1117 – 9; author reply: Gastroenterology 2005;129(2):768 – 9. [17] M. Aurich, D. Koeppen: Eine Anwenderumfrage zur Blutegeltherapie – Auswertung von 171 Falldokumentationen. zkm Zeitschrift für Komplementärmedizin 2009;5:12– 18. [18] www.20min.ch/diashow/diashow.tmpl?showid=29081. [19] www.newworldencyclopedia.org/entry/Army_ant. [20] www.food-insects.com/Vol7%20no2.htm; http://news.bbc.co.uk/2/hi/health/1809450.stm. [21] P. Jungmayr: Mukosale Barrierestörung. Dtsch. Apoth. Ztg. 2009;149:5450. [22] (cae): Essen – Bazillen – Adipositas. Dtsch. Apoth. Ztg. 2009;149:5515. [23] (ral): Bakterien-Spray hilft gegen Flüssigkeit im Ohr. Dtsch. Apoth. Ztg. 2010;150:1396. [24] www.online-academy.ch/content_details.php?sprache=d&aid=38; www.zdf.de/ZDFmediathek/beitrag/video/739762/drehscheibe-am-22.-April-2009#/beitrag/video/739762/drehscheibe-am-22.-April-2009 [25] www.zeit.de/2004/07/M-Saugkiller. [26] www.medihoney.de/sites/home_honig.html. [27] www.newzealandhoneyshop.de. [28] W. Sama, et al.: Distribution of survival times of deliberate Plasmodium falciparum infections in tertiary syphilis patients. Trans. Royal Soc. Trop. Med. Hyg. 2006;100(9); 811 – 6. [29] D.M. Aronoff: Using live pathogens to treat infectious diseases: a historical perspective on the relationship between GB virus C and HIV. Antiviral Ther. 2002;7(2):73 – 80; www.circare.org/malariotherapy.htm. [30] www.20min.ch/diashow/diashow.tmpl?showid=29081. [31] S. Yoshida, H. Watanabe: Robust salivary gland-specific transgene expression in Anopheles stephensi Mosquito. Insect Mol. Biol. 2006;15(4):403– 410; http://news.sciencemag.org/sciencenow/2010/03/researchers-turn-mosquitoes-into.html. [32] http://ecam.oxfordjournals.org/cgi/content/full/3/4/483. [33] H. Heuer, L. Heuer: Seraticin – ein antibiotischer Wirkstoff von Fliegenlarven. Dtsch. Apoth. Ztg. 2010;150:394 f. [34] Kristian Franz Paullini: Heilsame Dreck-Apotheke. Frankfurt am Main 1696, Kapitel II, S. 16; http://diglib.hab.de/drucke/xb-3174/start.htm [35] Bundesanzeiger Nr. 117 vom 29.06.1993; T. Wabnitz: Medizinprodukte als Hilfsmittel in der gesetzlichen Krankenkasse. Springer-Verlag, Berlin, 2009; Urteil des BSG vom 25.02.1981, Az. 5a/5 RKn 35/78. [36] Lungen-Krebs-Finder, Darwin GmbH; www.lungen-krebs-finder.de [37] Königlicher Gerichtsamtmann Keferstein: Über den unmittelbaren Nutzen der Insekten. Maring’sche Buchhandlung, Erfurt 1827. [38] www.forces.gc.ca/health-sante/wn-qn/adv-avi/Paederus-eng.asp [39] www.carstens-stiftung.de/nachwuchs/promotionsfoerderung/abstracts/nhk/zimmer.pdf [40] Paullini (wie [34]), Kapitel XXX, S. 269f. [41] Paullini (wie [34]),Kapitel II, S. 284; www.ent.orst.edu/burgettm/ent300_lecture21.htm [42] P. Bager, et al.: Trichuris suis ova therapy for allergic rhinitis: a randomized, double-blind, placebo-controlled clinical trial. J. Allergy Clin. Immunol. 2010;125(1):123-30.e1-3. Epub 2009 Oct 3. [43] www.ovamed.org [44] www.nytimes.com/2008/07/01/health/research/01prof.html [45] A. Reddy, B. Fried: An update on the use of helminths to treat Crohn‘s and other autoimmunune diseases. Parasitol. Res. 2009;104(2):217-21. [46] www.tagesanzeiger.ch/leben/heuschnupfen/Auf-den-Wurm-gekommen/story/13704365 [47] www.blutegel.de
Autoren
Apothekerin Heike Heuer und Dr. Lutz Heuer, Am Krausberg 31, 41542 Dormagen
Dr. jur. Valentin Saalfrank, Berrenrather Str. 393, 50937 Köln




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.