
- DAZ.online
- DAZ / AZ
- DAZ 49/2010
- Ernährung bei Krebs
Ernährung aktuell
Ernährung bei Krebs
Die Inzidenz bösartiger Erkrankungen liegt im Kindes- und Jugendalter bei 12 bis 14 Neuerkrankungen/100.000 Kinder/ Jahr. Besonders häufig treten Leukämien und Lymphome sowie Tumoren des zentralen Nervensystems auf. Im Rahmen dieser Krebserkrankungen können bereits vor der Diagnosestellung, während der Therapie sowie nach Therapieende ernährungsmedizinische Besonderheiten oder Probleme auftreten. Mit einer Häufigkeit von acht bis 40 Prozent werden zum Zeitpunkt der Diagnosestellung bereits nutritive Mangelzustände festgestellt.
Verschiedene Untersuchungen haben gezeigt, dass das Vorhandensein derartiger Malnutritionen selbst sowie die Folgen und Komplikationen der Malnutrition die Prognose der Krebserkrankung insgesamt verschlechtern [1].
Risikofaktoren für eine Mangelernährung
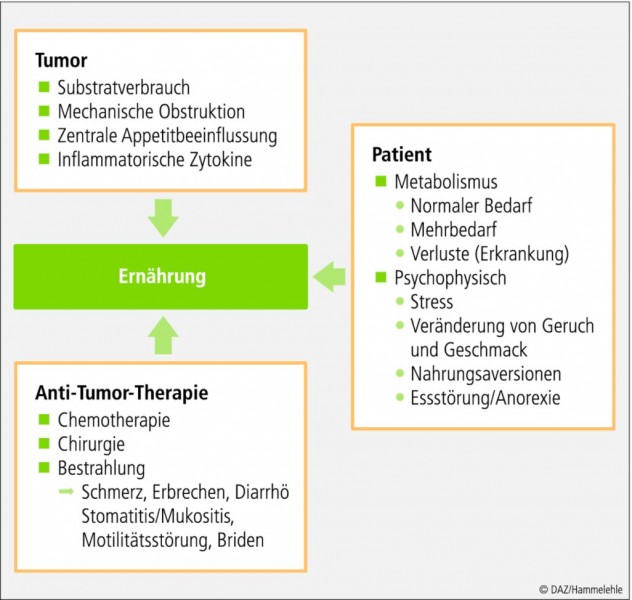
Für pädiatrisch-onkologische Patienten lässt sich das Risiko einer möglichen Mangelernährung auf drei Bereiche und deren Wechselwirkungen zurückführen (siehe Abbildung). Dies sind die Tumorerkrankung selbst, die Folgen der Antitumortherapie sowie der metabolische Bedarf bzw. Mehrbedarf des Patienten und psychophysische Faktoren. Im Hinblick auf die Deckung des Substratbedarfs und -verbrauchs des Tumorgewebes stellen gerade schnellwachsende Tumoren bzw. metastasierte Erkrankungen ein erhöhtes Risiko dar [2]. Dazu gehören insbesondere die im Kindes- und Jugendalter häufig auftretenden Krebsarten.
Eine Schlüsselrolle für tumorbedingte metabolische Veränderungen scheinen Zytokine zu spielen [2]. Besonders wichtig sind in diesem Zusammenhang IL-1, IL-6, IFN-γ und TNF-α [5, 6]. Über sie werden eine vermehrte Lipolyse, ein gesteigerter Proteinabbau sowie eine vermehrte Umwandlung von Aminosäuren aus diesem Abbau zu Glucose – dem Hauptsubstrat für das Tumorwachstum – vermittelt. Es wird weiterhin vermutet, dass durch Zytokine die hypothalamische serotoninerge Neurotransmission gesteigert wird, was eine verminderte Nahrungsaufnahme zur Folge hat.
Empfehlungen zur Verbesserung der NahrungszufuhrInappetenz
Übelkeit/Erbrechen
Mukositis
Verändertes Geschmacksempfinden
Quelle: [2] |
Ein spezielles Ernährungsproblem bei krebskranken Kindern ist das sogenannte dienzephale Syndrom. Typischerweise tritt es bei Kleinkindern oder Säuglingen mit Tumoren im Bereich des Hypothalamus bzw. Chiasma opticus auf. Betroffene zeigen oft keine oder lediglich eine sehr diskrete neurologische Symptomatik wie Nystagmus. Auch sind diese Kinder meist lebhaft und motorisch sehr aktiv und zeigen eine scheinbar adäquate Energieaufnahme. Dennoch können sie eine Gedeihstörung entwickeln, die schließlich die wegweisende Diagnostik einleitet. Bislang ist der Pathomechanismus, der zu dieser speziellen Problematik führt, ungeklärt.
Neben der Tumorerkrankung selbst spielen auch die Folgen der Tumortherapie eine tragende Rolle bei der Entwicklung von Malnutritionen. Viele Chemotherapeutika führen zu Übelkeit und Erbrechen oder verursachen eine schmerzhafte Mukositis, die – vor allem bei Schädigung der Dünndarmmukosa – eine Malabsorption hervorrufen kann. Eine weitere Komplikation der Chemotherapie können intestinale Motilitätsstörungen sein, die bis zu einem Subileus bzw. Ileus führen können. Erbrechen, Dysphagie und Mukositis können durch eine Strahlentherapie noch verstärkt werden.
Auch psychophysische Aspekte sind relevant, die zu einer geringeren Nahrungsaufnahme durch den Patienten führen. Wird das therapiebedingte Erbrechen mit der vorangegangenen Nahrungsaufnahme in Verbindung gebracht, kann ein Prozess des "Lernens am Misserfolg" aktiviert werden, der dazu führt, dass Nahrungsaufnahme vermieden wird. Es ist zudem möglich, dass die Therapie Veränderungen im Geruchs- und Geschmackssinn verursacht und zuvor gern Gegessenes nicht mehr schmeckt. Auch kann die Belastung bzw. der Stress, der durch die schwere Erkrankung entsteht, reaktiv zu einer geringeren Nahrungsaufnahme führen. Somit ist aus Sicht der Eltern und anderen Betreuungspersonen eine möglichst normale oder gar "bessere" Ernährung als vor der Erkrankung ein für die Gesundung des betroffenen Kindes wichtiges Kriterium. Allerdings kann auf der Interaktionsebene eine weitere relevante Belastungssituation entstehen, wenn das Kind essen soll, aber nicht will [2].
Folgen der Mangelernährung
Liegt eine Mangelernährung vor, hat dies Folgen für den weiteren Krankheitsverlauf. Insbesondere eine Protein-Energie-Malnutrition (PEM) und die daraus resultierende Kachexie können diesen maßgeblich beeinflussen. Eine PEM ist mit verschiedentlichen Folgen verbunden. Noch bevor eine Gewichtsabnahme beobachtet wird, nimmt durch Muskelabbau die Muskelkraft ab. Dabei ist nicht nur die Skelettmuskulatur, sondern auch die Atemmuskulatur betroffen. Die Skelettmuskelatrophie schränkt Betroffene in ihrer Leistung ein und kann bis zur Inaktivität führen. Viele Autoren konnten zudem nicht nur bei Erwachsenen, sondern auch bei Kindern einen signifikanten Zusammenhang zwischen erhöhten Infektionsraten und reduziertem Ernährungsstatus beobachten. So wurde bei mangelernährten onkologischen Kindern eine signifikant höhere Infektionsrate mit Pneumocystis carinii als bei normal ernährten Vergleichspatienten festgestellt. Auch wurden als Folgen der Mangelernährung eine verringerte Chemotherapietoleranz und ein inadäquater Stoffwechsel von Chemotherapeutika gefunden. Darüber hinaus sind die Langzeitprognosen bei Patienten mit nicht metastasierten soliden Tumoren schlechter. Ein schlechter Ernährungsstatus führt zudem zu Therapieverzögerungen, Dosisreduktionen und psychologischen Problemen und setzt schließlich die Lebensqualität herab [1].
Beurteilung des Ernährungsstatus
Im Rahmen der Ernährungsanamnese sind der Remissionsstatus der Krebserkrankung, die abgelaufene und geplante Therapie, die Gewichtsveränderung und das Längenwachstum im Zeitquerschnitt, aber auch die Gewichtsentwicklungen und Längen der Eltern zu berücksichtigen. Um die tatsächliche Nahrungsaufnahme objektiv erfassen zu können, ist es ratsam, kontinuierlich ein Ernährungsprotokoll zu führen [8]. Durch die Erfassung des Ernährungsverhaltens werden auch Änderungen im Essverhalten frühzeitig erkennbar und ermöglichen therapeutische Intervention. Klinische Zeichen einer Mangelernährung sind zudem Blässe, zurückzuführen auf einen Eisen-, Folsäure- oder Vitamin-B12 -Mangel, vermehrte Blutungsneigung (Vitamin K) sowie Akrodermatitis enteropathica und gestörte Wundheilung durch Zinkmangel [2].
Bei der körperlichen Untersuchung sollte das Augenmerk vor allem auf vorliegenden Fettreserven, der Muskelmasse, Eiweißmangelödemen und Zeichen der Mukositis liegen. Um anthropometrische Daten zu erheben, sollte das Gewicht und die Körpergröße häufig und regelmäßig erhoben und auf die Perzentilenkurven, die für das Kindes- und Jugendalter angewendet werden, übertragen werden. Weitere Indikatoren zur Körperzusammensetzung können durch Fettfaltenmessung und technische Messungen zur Körperzusammensetzung erhoben werden. So gibt die dual-energy x-ray absorptiometry (DEXA) wichtige Hinweise über die Art und Entwicklung des Ernährungszustands des Patienten. Bei sehr großen Tumoren sollte der Ernährungsstatus anhand der Fett- und Muskelreserven unabhängig vom Gesamtgewicht beurteilt werden [8].
Erfassung des Ernährungsstatus
Quelle: [2] |
Ernährungstherapie
Bei der Ernährungstherapie steht die orale Ernährung im Vordergrund. Die Nahrungsmittelauswahl wird dabei einerseits durch Vorsichtsmaßnahmen hinsichtlich einer Immunsuppression eingeschränkt, andererseits durch die Nebenwirkungen der Chemotherapie erschwert. Besonders Jugendliche nehmen die veränderte Geschmacksempfindung als sehr belastend wahr. Insgesamt können die Komplikationen dazu führen, dass die orale Nahrungszufuhr nicht ausreicht [1].
Formen der Ernährungstherapie
Quelle: [2] |
Auf das Wohlergehen der Kinder wirkt sich positiv aus, wenn sie ihre gewohnte Kost in einer vertrauten Umgebung, etwa zu Hause, erhalten können. Es sollte eine ausgewogene Kost, mit Lebensmitteln, die dem Kind schmecken, empfohlen werden. Falls eine erhebliche Unterernährung vorliegt, kann die Nahrung mit hochkalorischen Ernährungskomponenten, beispielsweise mit hochkalorischer Trinknahrung ergänzt werden [8]. Diese Trinknahrungen ermöglichen, sofern die Dosierung bedarfsgerecht erfolgt, eine komplette Versorgung mit Mikro- und Makronährstoffen [2]. Zudem kann die orale Nahrungsaufnahme verbessert werden, indem das Essen auf mehrere kleine Mahlzeiten verteilt wird sowie kühle bzw. gekühlte Speisen und Nahrungsmittel mit geringer Geruchsentwicklung angeboten werden. Bei Mukositis sollten zudem weiche und nicht-reizende Lebensmittel ausgewählt werden. Bei einer geschädigten Mundschleimhaut sollte ein lokales Anästhetikum eingesetzt werden. In Zeiten einer emetogenen Therapie ist es sinnvoll, keine Lieblingsspeisen anzubieten, um gelernte Aversionen zu vermeiden [8]. Des Weiteren müssen insbesondere in Phasen mit starker Immunsuppression hygienische Richtlinien eingehalten werden, um das Risiko durch Nahrung eine Infektionserkrankung zu erwerben gering zu halten [2]. Allerdings konnte kein infektionsprophylaktischer Effekt für bakterienreduzierte Diäten gezeigt werden. Bezogen auf die empfohlene Energiemenge sollten Kinder im Vorschulalter 90 bis 120 kcal/kg KG und ältere Kinder 50 bis 80 kcal/kg KG erhalten. Bei stark untergewichtigen Kindern muss individuell entschieden werden, ob weitere Maßnahmen getroffen werden, je nachdem, ob sich das Kind in Therapie oder austherapiert im Endstadium der Erkrankung befindet [8]. Bei Kindern mit ausgeprägtem Appetitmangel und Untergewicht, bei Vigilanzverminderung oder bei schweren Schluckstörungen können nasogastrale oder nasoduodenale Ernährungssonden eingesetzt werden. Sog. "Perkutane endoskopische Gastrostomie-(PEG)-Sonden sind vorzuziehen, wenn eine langfristige Lösung geschaffen werden muss.
Indikationen der Ernährungstherapie
|
Aufgrund der Komplikationsmöglichkeiten und der Lehrmeinung, dass eine enterale Nahrungsaufnahme physiologischer wirkt, ist diese in der Regel einer parenteralen Ernährung vorzuziehen [8, 9]. Doch bei sehr stark untergewichtigen Kindern, die etwa wegen einer schweren Mukositis gar keine oder nur sehr wenig Nahrung enteral aufnehmen und für die eine Nahrungssonde keine Alternative ist, kann eine parenterale Ernährung erwogen werden. Kinder erhalten im Rahmen der Chemotherapie oft einen permanenten zentralen Venenkatheter, der chirurgisch implantiert wird, so dass die technischen Voraussetzungen oftmals schon gegeben sind. Es konnte gezeigt werden, dass sich onkologische Patienten von den direkten Folgen einer intensiven Chemotherapie oder ausgedehnten Operation kurzfristig durch parenterale Ernährung schneller erholen. Allerdings muss betont werden, dass bislang kein Nachweis für einen Nutzen für die Überlebenswahrscheinlichkeit vorliegt und ein erhöhtes Risiko für Infektionen und andere Nebenwirkungen besteht. Auch wird ein wachstumsbeschleunigender Effekt auf Krebszellen diskutiert, vor allem wenn eine parenterale Ernährung ohne zytostatische Therapie erfolgt. Bei Kindern wurde dies jedoch noch nicht gezeigt [8].
Spezielle Nahrungsbestandteile
Speziell für Magnesium besteht bei Kindern unter Chemotherapie mit Platinderivaten wie Cisplatin und Carboplatin ein erhöhter Bedarf. Daher wird dieser Mikronährstoff bei diesen Kindern über den basalen Bedarf hinaus substituiert. Außerdem scheint bei Krebspatienten häufig ein Mangel an Glutamin vorzuliegen. Seit Langem wird daher ein möglicher Vorteil durch zusätzliche Glutamingaben diskutiert, allerdings konnten Studien bei Kindern diesen Zusammenhang nicht bestätigen. Schließlich ist noch unklar, welche pharmakologische Bedeutung appetitsteigernde Medikamente wie Corticosteroide, Anabolika, Insulin, Wachstumshormon sowie Zytokininhibitoren haben [8].
Empfehlungen zur Nahrungsmittelhygiene bei immunsupprimierten Patienten
Quelle: [2] |
Übergewicht bei krebskranken und geheilten Kindern
Es kann bei einigen Kindern mit bestimmten ZNS-Tumoren, bei Kindern, die etwa wegen einer akuten lymphatischen Leukämie Kortikosteroide erhalten und bei vielen Kindern, die von einer Leukämie geheilt wurden, ein erhebliches Übergewicht beobachtet werden [4]. Es werden dafür verschiedene Faktoren wie Bewegungsarmut und anhaltende Insulinresistenz diskutiert. Bei diesen Kindern ist eine Ernährungsberatung hinsichtlich kalorienarmer Ernährung und Lebensmitteln wichtig. Auch sollte die hormonelle Situation abgeklärt werden [8].
Literatur [1] Kronberger, M. (2007): Ernährungsproblematik krebskranker Kinder und Jugendlicher. Monatsschr Kinderheilkd 9 – 155:822 – 828.[2] Buderus, S. & Lentze, M. J. (2006): Ernährung – Supportivtherapie in der pädiatrischen Hämatologie und Onkologie. In: Gadner, H. et al. (Hrsg): Pädiatrische Hämatologie und Onkologie. Springer, Berlin.[3] Schmid, I. et al. (2007): Ernährungsstatus krebskranker Kinder während der Chemotherapie – Keine signifikante Mangelernährung. Monatsschr Kinderheilkd 1 – 155:35-39.[4] Didi, M. et al. (1995): High incidence of obesity in young adults after treatment of acute lymphoblastic leukaemia in childhood. J Pediatr 127:63 – 67.[5] Argiles J. et al. (2003) Cytokines in the pathogenesis of cancer cachexia. Curr Opinion Clin Nutr Metab Care 6:401 – 406.[6] Laviano A. et al. (2003) Improving food intake in anorectic cancer patients. Curr Opinion Clin Nutr Metab Care 6:421– 426.[7] Pedron C. et al (2000) Short-term follow-up of the nutritional status of children undergoing autologous peripheral blood stem cell transplantation. Pediatr Hematol Oncol 17:559 – 566.[8] Beck, J. (2005): Ernährungssituation und Ernährungsmöglichkeiten krebskranker Kinder. In: Jochum, F. (Hrsg.): Infusionstherapie und Diätetik in der Pädiatrie. 298 – 304. Springer, Berlin.[9] Schmid, L. et al. (2005): Wann ist eine Ernährungstherapie bei krebskranken Kindern sinnvoll? Aktuelle Ernaehr Med; 30:124 – 129.
Autorin Katja Aue, M. Sc. Ökotrophologie katja_aue@web.de





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.