
- DAZ.online
- DAZ / AZ
- DAZ 36/2011
- Immunmodulator Ipilimumab...
Arzneimittel und Therapie
Immunmodulator Ipilimumab als neuer Therapieansatz
Das maligne Melanom, auch schwarzer Hautkrebs genannt, ist die aggressivste und am schwersten zu behandelnde Form der kutanen Tumore mit hohem Metastasierungsrisiko. Es entsteht aus den Melanozyten in der Basalschicht der Epidermis und manifestiert sich überwiegend an der Haut. Selten sind Augen, Hirn- oder Schleimhäute betroffen. 80% der malignen Melanome treten an Körperstellen auf, die normalerweise bekleidet sind. Sie entstehen aber auch am behaarten Kopf, unter Finger- und Fußnägeln sowie an den Fußsohlen. Auf den ersten Blick kann ein malignes Melanom harmlosen Nävi ähneln. Symptome wie Juckreiz oder Blutungen sind selten.
Schlechte Prognose beim fortgeschrittenen Melanom
In frühen Stadien ist das maligne Melanom zumeist heilbar. Derzeit werden dank guter Früherkennungsmaßnahmen etwa 90% der malignen Melanome als Primärtumor ohne erkennbare Ausbreitung diagnostiziert. Im fortgeschrittenen Stadium führt das metastasierte maligne Melanom zu einer ungünstigen Prognose mit hoher Sterblichkeitsrate und ist für etwa 80% der Mortalität an Hauttumoren verantwortlich. Charakteristisch ist die maligne Transformation der pigmentbildenden Hautzellen (Melanozyten), die vor allem in den tiefen Hautschichten, in der mittleren Schicht des Auges sowie in einigen inneren Organen vorkommen. Im Gegensatz zu den meisten soliden Tumorerkrankungen ist das metastasierte Melanom keine Erkrankung des fortgeschrittenen Alters. Häufig sind auch jüngere sowie Patienten im mittleren Alter betroffen.
Neue Hoffnung auf ein längeres Leben
Patienten mit einem fortgeschrittenen Melanom haben nach Diagnosestellung eine durchschnittliche Überlebensrate von sechs bis neun Monaten. Das neue Immuntherapeutikum Ipilimumab ist seit mehr als dreißig Jahren die erste und bislang einzige Therapie zur Behandlung des nicht-resezierbaren oder metastasierten Melanoms, die eine signifikante Verbesserung des Gesamtüberlebens bewirkt, so das Resümee der Experten Prof. Dr. Andreas Mackensen, Prof. Dr. Axel Hauschild und Prof. Dr. Dirk Schadendorf auf einer Presseveranstaltung von BristolMyers Squibb in Berlin zum metastasierten Melanom. Nach ein und zwei Jahren kann ein anhaltendes Überleben beobachtet werden. So zeigte das innovative Immuntherapeutikum in einer randomisierten doppelblinden Phase-III-Studie die Steigerung des 1- und 2-Jahres-Überlebens von 25% auf 46% bzw. von 14% auf 24%. Einige der Patienten waren sogar noch nach drei bis vier Jahren am Leben.
Monoklonaler Antikörper Ipilimumab
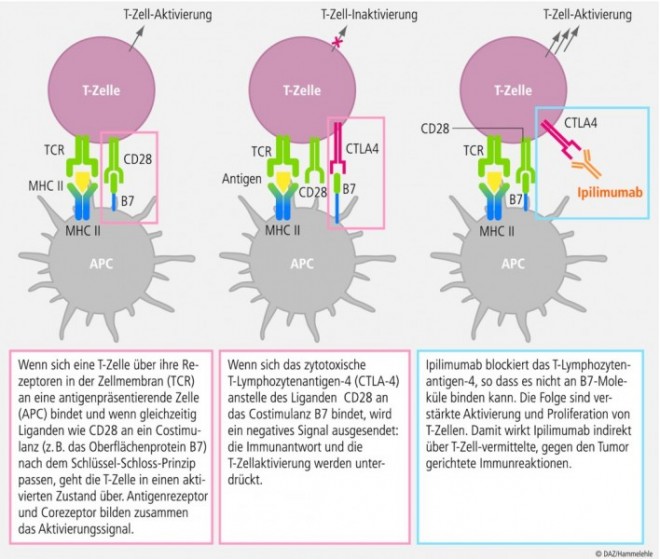
Mit dem Einsatz von Ipilimumab wird ein innovativer Therapieansatz im Bereich der Immuntherapie beschritten. Der Therapieansatz der Immunmodulation mit Ipilimumab basiert auf dem natürlichen Abwehrmechanismus des Körpers. Dabei reagiert das Immunsystem auf viele Krebserkrankungen nachweislich mit einer Immunantwort. Der Körper erkennt bösartig veränderte Zellen und aktiviert sein Abwehrsystem, um sie zu bekämpfen und unschädlich zu machen. Ipilimumab ist ein vollständig humanisierter, monoklonaler IgG1κ-Anti-CTLA-4 (Cytotoxic T-Lymphocyte Antigen-4)-Antikörper mit indirekter antitumoraler Wirkung. Der monoklonale Antikörper ist das erste bei einer Tumorerkrankung zugelassene Immuntherapeutikum, das gegen das CTLA-4-Antigen gerichtet ist, welches bei der Regulation der körpereigenen Immunreaktion eine zentrale Rolle spielt. Es blockiert die immuninhibitorische Wechselwirkung zwischen CTLA-4 und seinen Liganden (CD80/CD86), was mit einer verstärkten Aktivierung und Proliferation von T-Zellen verbunden ist. Ipilimumab verstärkt somit die körpereigene T- Zell-vermittelte Immunantwort und kann indirekt gegen immunogene Tumore wirken.
Therapieschema nicht vorzeitig unterbrechen
Das Immuntherapeutikum besitzt ein einfaches Dosierungsschema. Das empfohlene Induktionsregime sieht vier intravenöse Infusionen mit 3 mg/kg Körpergewicht über einen Zeitraum von 90 Minuten verabreicht alle drei Wochen vor. Bei guter Verträglichkeit sollten die Patienten das gesamte Induktionsregime mit vier Dosen erhalten, unabhängig davon, ob neue Läsionen auftreten oder bestehende Areale weiter wachsen. Die Beurteilung des Tumoransprechens auf Ipilimumab sollte erst nach Abschluss des Behandlungszyklus erfolgen, wie Hauschild betonte. Bei der Mehrheit der Responder kommt es zu einer langsamen, stetigen Abnahme der Tumorlast. Bei manchen Patienten werden aber verzögerte Therapieantworten beobachtet, die erst nach anfänglicher Tumorprogression erreicht werden. Man geht davon aus, dass aufgrund der Infiltration des Tumors mit T-Zellen dieser zunächst zu wachsen scheint, bevor er kleiner wird.
Immunbedingte Nebenwirkungen beachten
Ipilimumab ist ein humanisierter monoklonaler Antikörper, der nicht mithilfe von Cytochrom-P450-Enzymen (CYPs) oder anderen Enzymen des Arzneimittelmetabolismus abgebaut wird und der voraussichtlich keine inhibitorische oder induktorische Wirkung auf die CYPs oder andere Enzyme des Arzneimittelmetabolismus hat. Daher sind keine pharmakokinetischen Arzneimittelinteraktionen zu erwarten.
Vor Einleitung und vor jeder erneuten Gabe von Ipilimumab müssen sowohl die Leberwerte mittels Leberfunktionstests als auch die Schilddrüsenwerte analysiert werden. Zusätzlich müssen die Patienten während der Behandlung auf Anzeichen oder Symptome von immunvermittelten Nebenwirkungen einschließlich Diarrhö und Kolitis untersucht werden. Ipilimumab kann aufgrund der T-Zell-Aktivierung und -Proliferation zu schweren und tödlichen unerwünschten Reaktionen führen. Diese Nebenwirkungen sind immunvermittelt und können jedes Organsystem betreffen, wobei am häufigsten eine Enterokolitis, Hepatitis, Dermatitis (einschließlich toxische epidermale Nekrolyse), Neuropathie und Endokrinopathie auftreten. Die meisten dieser Reaktionen zeigen sich während der Behandlung. Ein kleiner Teil entwickelt sich jedoch Wochen bis Monate nach Absetzen von Ipilimumab. Da sich die immunbedingten Nebenwirkungen von denen, die unter einer Chemotherapie und zielgerichteten ("target") Substanzen zu beobachten sind, unterscheiden, müssen sie anders behandelt werden. Eine Dosisreduktion wird nicht empfohlen. Aufgrund von Nebenwirkungen ausgelassene Dosen dürfen nicht nachgeholt werden. Bei schweren immunbedingten Nebenwirkungen kommen hochdosierte Corticosteroide zum Einsatz, auch kann der Abbruch der Therapie notwendig werden.
Steckbrief: IpilimumabHandelsname: Yervoy Hersteller: Bristol-Myers Squibb, München Einführungsdatum: 1. August 2011 Zusammensetzung: 1 Durchstechflasche mit 10 ml bzw. 40 ml Infusionslösungskonzentrat enthält 50 mg bzw. 200 mg Ipilimumab. Sonstige Bestandteile: Trometamolhydrochlorid (2-Amino-2-hydroxymethyl-1,3-propandiol-hydrochlorid), Natriumchlorid, Mannitol (E 421), Pentetsäure (Diethylen-triaminpentaessigsäure), Polysorbat 80, Natriumhydroxid (zum Einstellen des pH-Werts), Salzsäure (zum Einstellen des pH-Werts), Wasser für Injektionszwecke. Packungsgrößen, Preise und PZN: 1 Durchstechflasche mit 10 ml, 5262,83 Euro, PZN 8869134; 1 Durchstechflasche mit 40 ml, 20757,68 Euro, PZN 8869140. Stoffklasse: Antineoplastische Mittel, monoklonale Antikörper. ATC-Code: L01XC11. Indikation: Zur Behandlung von fortgeschrittenen (nicht resezierbaren oder metastasierten) Melanomen bei Erwachsenen, die bereits zuvor eine Therapie erhalten haben. Dosierung: Das empfohlene Induktionsregime für Ipilimumab liegt bei 3 mg/kg, intravenös über einen Zeitraum von 90 Minuten, alle drei Wochen für insgesamt vier Dosen. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile. Nebenwirkungen: Diarrhö, Ausschlag, Pruritus, Müdigkeit, Übelkeit, Erbrechen, verminderter Appetit, Bauchschmerzen. Wechselwirkungen: Keine Anwendung systemischer Glucocorticoide vor Behandlungsbeginn; nach Beginn können systemische Glucocorticoide oder andere Immunsuppressiva eingesetzt werden, um immunvermittelte Nebenwirkungen zu behandeln. Patienten, die einer gleichzeitigen antikoagulativen Behandlung bedürfen, sollten engmaschig überwacht werden. Warnhinweise und Vorsichtsmaßnahmen: Ipilimumab verstärkt die Immunabwehr und wird mit entzündlichen Nebenwirkungen aufgrund einer erhöhten oder übermäßigen Immunaktivität in Verbindung gebracht; es kann zu immunvermittelten Nebenwirkungen führen, die schwerwiegend bis lebensbedrohlich sein können; für die Behandlung kann eine systemische hochdosierte Therapie mit Glucocorticoiden zusammen mit oder ohne andere Immunsuppressiva erforderlich sein. Die Aktivierung der Immunantwort kann sich störend auf eine immunsupprimierende Therapie auswirken. Ipilimumab sollte bei Patienten mit schweren aktiven Autoimmunerkrankungen, bei denen eine weitere Immunaktivierung möglicherweise lebensgefährlich sein kann, vermieden werden. Bei anderen Patienten mit Autoimmunerkrankungen in der Vorgeschichte sollte es mit Vorsicht angewendet werden. |
Optimale Behandlungserfolge sicherstellen
Schadendorf betonte, wie wichtig eine umfangreiche Aufklärung hinsichtlich möglicher immunvermittelter Nebenwirkungen ist, da bei sorgfältiger Überwachung diese frühzeitig erkannt und bei adäquater Reaktion erfolgreich behandelt werden können. Unabdingbar ist deshalb eine engmaschige ärztliche Kontrolle ab Behandlungsbeginn sowie das Befolgen eines Behandlungsalgorithmus bei auftretenden Reaktionen, so die einhellige Auffassung der Experten. Um optimale Therapieerfolge mit dem Antikörper zu erzielen, sollte die Durchführung und Überwachung der Behandlung in der Hand eines erfahrenen Spezialisten der Onkologie liegen. Dabei sind onkologische Zentren, die jährlich große Fallzahlen an Patienten mit dem Antikörper behandeln, nach Expertenmeinung die beste Option.
Ausblick
Das für 2012 angekündigte Update der interdisziplinären Hauttumor-Leitlinien der Deutschen Dermatologischen Gesellschaft (DDG) und der Deutschen Krebsgesellschaft (DKG) bezieht Ipilimumab als neue Therapieempfehlung bei Patienten mit metastasiertem Melanom im Stadium IV ein. Dabei handelt es sich um die erste S3-Leitlinie zum Melanom und zur Prävention von Hauttumoren.
Außerdem wird Ipilimumab derzeit auch bei Tumorfrühstadien, in verschiedenen Dosierungen und Regimen sowie in unterschiedlichen Kombinationen mit anderen Wirkstoffen untersucht. Überdies wird die Bedeutung von Ipilimumab bei der Therapie anderer Tumortypen wie Prostata- und Lungenkrebs erforscht.
Apothekerin Gode Meyer-Chlond




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.