
- DAZ.online
- DAZ / AZ
- DAZ 43/2011
- Malaria-Impfstoff auf der...
Malaria
Malaria-Impfstoff auf der Zielgeraden?
Damit könnte diese Vakzine weit über das hinausgehen, was das eigentliche Ziel eines Impfstoffs ist, nämlich einen Menschen vor einer Infektionskrankheit zu schützen. Sie könnte als Prototyp beispielgebend sein für die Entwicklung von Impfstoffen gegen viele andere Protozoen, die nicht nur in Schwellen- und Entwicklungsländern Probleme bereiten, sondern auch in Ländern Mitteleuropas. Aus Griechenland sind nämlich in diesem Jahr bereits acht autochthone, also nicht über eine Reise in Endemiegebiete eingeschleppte, Malariafälle aufgetreten. Es könnte also sein, dass bereits ein Erregerreservoir von – in diesem Fall – Plasmodium vivax auf dem Peleponnes existiert.
Die Bedrohung
Malaria ist eine akute fiebrige Krankheit, deren Symptome nach einer Inkubationszeit von 7 bis 15 Tagen, bei der Malaria quartana sogar von bis 40 Tagen auftreten (Tab. 1). Allerdings sind die ersten Beschwerden mit Fieber, Kopf- und Gliederschmerzen und allgemeinem Krankheitsgefühl zunächst eher uncharakteristisch und werden daher zum Teil als grippaler Infekt oder Magen-Darm-Infektion fehldiagnostiziert. Bei der gefährlichsten Form, der Malaria tropica, besteht häufig zusätzlich eine Thrombopenie, und es kann zu einer Splenomegalie und einer Hepatomegalie kommen. In 20% der nichtbehandelten Nichtimmunen verläuft diese Malaria-Art tödlich.
Die Malaria tritt in den tropischen und subtropischen Regionen aller Kontinente – außer Australien und der Antarktis – auf, so dass knapp die Hälfte der Weltbevölkerung in einem Risikogebiet lebt. Die meisten Erkrankungs- und Todesfälle sind jedoch im Sub-Sahara-Gebiet Afrikas zu finden. Gemäß den Zahlen der Weltgesundheitsorganisation WHO waren 2009 weltweit ca. 225 Millionen Malariafälle mit ungefähr 781.000 tödlichen Verläufen zu verzeichnen. Die meisten Todesopfer waren bei afrikanischen Kindern zu beklagen. Damit sind die Erkrankungszahlen und Todesfälle im Vergleich zum Jahr 2000 mit 233 Millionen Erkrankungen und 985.000 Toten immerhin leicht rückläufig.
Tab. 1: Humanpathogene Plasmodium-Arten und einige Charakteristika der Krankheit | ||||
Erreger |
P. falciparum |
P. vivax |
P. ovale |
P. malariae |
Inkubationszeit [Tage] |
7 bis 15 |
12 bis 18 |
18 bis 40 |
|
Krankheit |
Malaria tropica |
Malaria tertiana |
Malaria quartana |
|
Rhythmus der Fieberschübe [h] |
selten rhythmische Wechselfieber |
48 h, meist mit nachmittäglichen Schüttelfrostepisoden und Fieber um 40°C, das nach 3 bis 4 Stunden auf Normalwerte sinkt |
72 h |
|
Zeitdauer für Rückfälle nach Erstinfektion [Jahre] |
– |
2 Jahre |
5 Jahre |
bis zu 40 Jahre |
Anteil an den 2010 in D gemeldeten Fällen* [%] |
83% |
8% |
2% |
3% |
| *insgesamt 617 Fälle; bei 596 (97%) wurde der Erreger genauer spezifiziert | ||||
In Deutschland erfasst das Robert-Koch-Institut alljährlich ca. 600 Malaria-Erkrankungen, die überwiegend von Reisen nach Afrika, aber auch beispielsweise nach Indien mitgebracht werden.
Verursacher der Malaria sind Parasiten der Gattung Plasmodium , von denen vier Vertreter humanpathogen sind: P. falciparum, P. vivax, P. malariae und P. ovale. P. falciparum und P. vivax sind die am weitesten verbreiteten Vertreter. Seit einigen Jahren wurden vereinzelt Fälle einer Infektion mit P. knowlesi beobachtet, die eigentlich nur Affen befällt und in Waldregionen Südostasiens vorkommt.
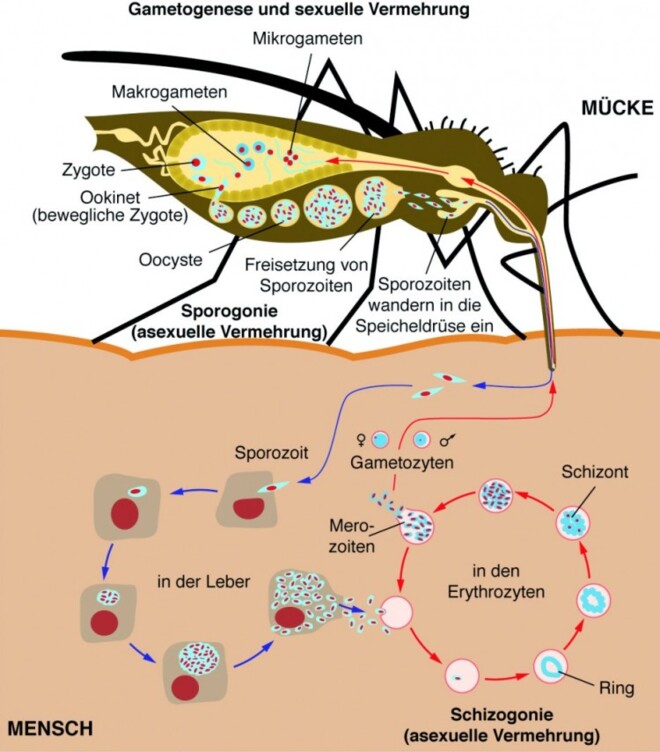
Übertragen werden die Parasiten durch den Stich einer blutsaugenden, weiblichen Stechmücke der Gattung Anopheles. Dabei gelangen mit dem Speichel der Mücke sogenannte Sporozoiten der Plasmodien in die menschliche Blutbahn. Somit haben diese intrazellulären Parasiten zwei unterschiedliche Wirte, in denen sie jeweils einen Teil ihres Entwicklungszyklus durchlaufen.
Der Entwicklungszyklus der Plasmodien
Die Sporozoiten aus dem Speichel der Stechmücke gelangen mit dem Blut des infizierten Menschen in die Leber, wo sie Leberparenchymzellen befallen (Abb. 1). Hier teilt und entwickelt sich ein Sporozoit zu einem sogenannten Gewebeschizonten, der schließlich die gesamte Leberzelle ausfüllt. Dieser Zeitraum wird auch als präerythrozytäre Phase bezeichnet, während der keinerlei Krankheitssymptome auftreten.
Jeder Gewebeschizont ist im reifen Zustand angefüllt mit 10.000 bis 30.000 sogenannten Merozoiten, die nach Ruptur der Leberparenchymzelle freigesetzt und in die Blutbahn entlassen werden. Bei der Malaria tropica bleiben danach keinerlei Parasiten mehr in der Leber, während bei der Malaria tertiana einige Gewebeschizonten zu einer Art Ruhestadium in Form von Hypnozoiten differenzieren, die eventuell erst nach Monaten oder Jahren wieder zu Merozoit-haltigen Schizonten differenzieren und einen Rückfall verursachen.
In der Blutbahn heften sich die Merozoiten an Erythrozyten und entwickeln sich innerhalb einer Vakuole über ein Ringstadium zu reifen erythrozytären Schizonten, aus denen bei der Lyse des Erythrozyten wiederum neue Merozoiten freigesetzt werden, die erneut Erythrozyten befallen. Dieses Entwicklungsstadium wird auch als erythrozytäre Phase bezeichnet, während der es zu den typischen Krankheitssymptomen kommt.
Einige Merozoiten differenzieren in den Erythrozyten zu geschlechtlichen Formen, wobei Makro- und Mikrogameten entstehen. Wird nun dieser menschliche Wirt erneut von einer Anopheles -Mücke gestochen, nimmt die Stechmücke zusammen mit dem Blut auch die Mikro- und Makrogameten auf. Im Magen vereinigen sich die Gameten zu einer Zygote, die als Ookinet die Magenwand durchdringt und in der Hämolymphe eine Oozyste bildet, aus der dann erneut tausende Sporozoiten hervorgehen. Die Sporozoiten wandern in die Speicheldrüse und können beim nächsten Stich einen neuen humanen Wirt infizieren.
Warum war/ist die Impfstoffentwicklung gegen Plasmodium so schwer?
Plasmodien sind zwar Einzeller, gehören aber zu den tierischen Organismen und sind Eukaryonten mit einem deutlich komplexeren Aufbau als Bakterien oder gar Viren, gegen die ja bereits zum Teil recht erfolgreich geimpft werden kann. Dazu kommt, dass sich der Parasit im Menschen überwiegend intrazellulär befindet und sich dadurch den direkten Angriffen des Immunsystems entziehen kann. Zusätzlich unterliegen die möglichen Antigene einer zu großen Variabilität, so dass die immunologischen Waffen eventuell nur kurzfristig nutzbar sind.
Seit 2002 ist das Genom und auch das Proteom von Plasmodium falciparum aufgeklärt. Demnach hat der Parasit ein Genom von insgesamt 22,8 x 106 Basenpaare, die auf 14 Chromosomen verteilt sind. Drei hochvariable Genfamilien wurden in Plasmodium falciparum gefunden, die jeweils eine größere Anzahl Gene und zusätzlich noch Pseudogene und Genfragmente enthalten. Bei der Transkription kann nun munter zwischen den verschiedenen Genen, Pseudogenen und Genfragmenten hin und her gewechselt werden, so dass sehr unterschiedliche Proteine entstehen. Dummerweise sind das just Oberflächenproteine, die in die Membran der Parasiten oder der infizierten Zellen eingelagert werden, und die eigentlich Erkennungsstrukturen für Antikörper sein könnten. Durch diese Varianz entziehen sich jedoch die Parasiten der Erkennung und dem Angriff durch das Immunsystem.
Aus den Genomdaten wurde abgeleitet, dass 5268 offene Leserahmen existieren und entsprechende Proteine exprimiert werden könnten, von denen allerdings ungefähr 60% keinerlei Sequenz-Ähnlichkeiten zu Proteinen aus anderen Organismen haben. Bei der Proteom-Analyse, also der Untersuchung der tatsächlich exprimierten Proteine, konnten 2415 zuverlässig identifiziert werden, die in den verschiedenen Entwicklungsstadien des Parasiten exprimiert werden. Nur 152 Proteine waren in allen Stadien nachweisbar. Von den 1049 in Sporozoiten gefundenen Proteinen kommen 513 ausschließlich in diesem Stadium vor und von den 839 identifizierten Merozoiten-Proteinen sind 204 Stadium-exklusiv. Welche Proteine wären aber gute Antigene, um damit eine nachhaltige Immunität zu induzieren? Bei insgesamt 439 Proteinen wurde eine Transmembrandomäne identifiziert oder ein Signal zur Anheftung eines Glycosylphosphatidylinositol (GPI)-Ankers zur Fixierung in der Membran gefunden. Diese Proteine sind also extrazellulär lokalisiert und interessante, mögliche Antigene.
Wie es scheint, ist das menschliche Immunsystem tatsächlich in der Lage, sich halbwegs erfolgreich gegen die Malaria zu schützen, sieht man doch bei Personen, die sich längere Zeit in Endemiegebieten aufhalten, eine Semi-Immunität. Offensichtlich wird bei diesen Menschen die exponentielle Vermehrung der Merozoiten über Antikörper und CD4+ -T-Effektorzellen in Schach gehalten und so auch die Krankheitssymptome gemildert. Transferiert man IgG-Moleküle aus dem Blut der semi-immunen Patienten in nicht-immune Probanden, sind die Empfänger auch partiell geschützt. Allerdings richtet sich der Schutzmechanismus nur gegen das erythrozytäre Stadium. Die Infektion der Leberzelle findet trotzdem ungehindert statt.
Die vielversprechende Impfstoff-Formulierung RTS,S/AS01
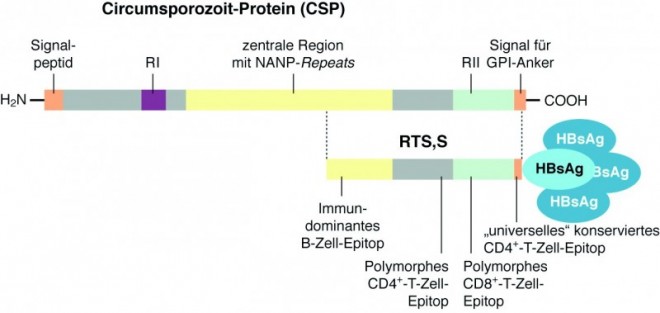
Kürzlich wurden die ersten Zwischenergebnisse einer groß angelegten Phase-III-Studie mit dem Impfstoff RTS,S/AS01 veröffentlicht [NEJM, 18. 10. 2011]. Hinter dem Kürzel RTS,S verbirgt sich ein Virus-ähnliches Teilchen, das vom Hepatitis-B-Oberflächenantigen HBsAg gebildet wird. Ein Viertel der rekombinant hergestellten HBsAg-Menge ist ein Fusionsprotein mit einem Teil des Plasmodium-falciparum -Oberflächenproteins Circumsporozoit-Protein CSP.
CSP ist normalerweise über einen GPI-Anker am C-Terminus in die Zellmembran des Sporozoiten eingelagert, wird also während der präerythrozytären Phase exprimiert und exponiert. Das 412 Aminosäuren lange Protein besteht aus einer charakteristischen zentralen Region, in der die Aminosäurefolge NANP mehr als 40x wiederholt vorkommt (Abb. 2). Die Enden des Proteins bestehen aus zum Teil konservierten, zum Teil auch sehr variablen Regionen. In der N-terminalen Region befindet sich neben einem Signalpeptid, das für das Ausschleusen des Proteins aus der Zelle verantwortlich ist, auch eine Region RI, die an Heparinsulfat-Proteoglycane binden kann. Über die Bindung an entsprechende Proteoglycane des Kapillarsystems der Leber, scheint CSP wichtig für das Eindringen der Sporozoiten in das Lebergewebe und schließlich auch in die Leberzelle zu sein.
In der C-terminalen Region befindet sich neben dem Signal für das Anheften des GPI-Ankers noch eine Thrombospondin-ähnliche Region RII. Auch RII heftet sich an Heparinsulfat-Proteoglycane und ist ebenfalls verantwortlich für das Eindringen des Parasiten in die Leberzelle.
Für den Impfstoff RTS,S wurde nur der CSP-Genbereich hergenommen, der für die Aminosäuren 207 bis 395 codiert, und mit dem HBsAg-Gen fusioniert. Damit umfasst der Anteil aus dem Parasiten noch 19 NANP-Wiederholungen und den gesamten C-Terminus mit der Thrombospondin-ähnlichen Region, allerdings ohne den hydrophoben GPI-Anker. Dieses CSP-Fragment liefert gleich mehrere Epitope für das Immunsystem: die NANP-Repeats stellen ein immundominantes B-Zell-Epitop dar und im flankierenden C-Terminus finden sich drei T-Zell-Epitope. Und man hat in den verschiedenen Tests auch gesehen, dass RTS,S eine leichte CD4+ -T-Zellantwort induziert, die sogar mit einem gewissen Schutz vor einer Infektion korreliert, eine signifikante CD8+ -T-Zellantwort scheint allerdings nicht ausgelöst zu werden.
Die Hefe Saccharomyces cerevisiae macht aus dem Fusionsgen das Impfantigen RTS, das sich dann mit freiem Hepatitis-B-Antigen (S) spontan zu Virus-ähnlichen Partikeln zusammenlagert. Diese Partikel können besonders gut die Antigene, also das CSP-Fragment, dem T-Zell-Kompartiment des Immunsystems präsentieren.
Zusätzlich ist im Impfstoff der Phase-III-Studie noch das Adjuvans AS01 enthalten, das eine liposomale Suspension mit den beiden Immunstimulanzien MPL und QS21 darstellt. Beim Monophosphoryl-Lipid-A-Molekül MPL handelt es sich um die entgiftete Variante des Lipopolysaccharids (LPS) des gramnegativen Bakteriums Salmonella minnesota. Dieses Adjuvans ist beispielsweise auch im zugelassenen Papillomvirus-Impfstoff Cervarix® enthalten. QS21 ist ein natürliches Saponin aus der Borke des südamerikanischen Baumes Quillaja saponaria. Die Kombination AS01 induziert nicht nur eine starke humorale, sondern auch eine starke zelluläre Immunantwort, wobei vor allem TH 1-Zellen stimuliert werden.
Vielversprechende Ergebnisse der Phase-III-Studie
Nachdem die ersten klinischen Studien mit RTS,S sehr erfolgversprechend ausgefallen waren, wurde 2009 eine große Phase-III-Studie gestartet. In insgesamt 11 Zentren in 7 afrikanischen Ländern im Malaria-Hochrisikogebiet wurden 15.460 Säuglinge und Kleinkinder aus den beiden Altersgruppen 6 bis 12 Wochen (6537) und 5 bis 17 Monate (8923) in die randomisierte, kontrollierte und doppelblinde Impfstudie eingeschlossen. Jede Altersgruppe wurde in drei Studienarme unterteilt: In einem Arm erhielten die Kinder zunächst drei intramuskuläre Impfungen mit RTS,S/AS01 im Abstand von einem Monat sowie eine Booster-Impfung 18 Monate nach der dritten Impfdosis. Der zweite Studienarm sah die drei RTS,S/AS01-Impfdosen ohne Booster-Impfung vor und der dritte Studienarm umfasste die Kontrollgruppe, die eine andere Vakzine erhielt. Bei den Kleinkindern war die Vergleichsimpfung eine Tollwut-Impfung, bei den Säuglingen eine Konjugat-Vakzine gegen Meningokokken Serogruppe C.
14 Monate nach der ersten Impfung wurden nun die Daten der ersten 6000 Probanden aus der Gruppe der 5 bis 17 Monate alten Kleinkinder analysiert. Allerdings konnten nur die Daten von 4296 Kinder einbezogen werden. Einen Monat nach der dritten Impfdosis hatten 99,9% der Kleinkinder aus der RTS,S/AS01-Gruppe einen signifikanten Antikörpertiter gegen CSP. Es zeigte sich, dass bei den mit RTS,S geimpften Kindern weniger Episoden einer klinischen Malaria auftraten als in der Kontrollgruppe, woraus sich ein Impfschutz von 55% ermitteln ließ. Der Schutz vor dem Auftreten einer schweren Malaria war in dieser Altersgruppe jedoch mit 47% noch etwas schlechter. In der Gesamtschau beider Altersgruppen zeigte sich sogar, dass der Schutz vor einer schweren Malaria nur bei 35% lag. Und der Impfschutz nahm am Ende der 12-monatigen Beobachtungszeit im Vergleich zum Beginn noch ab. Zudem traten in der RTS,S/AS01-Gruppe deutlich mehr Fälle einer Meningitis und von Fieberkrämpfen auf als in der Kontrollgruppe.
Es bleibt abzuwarten, wie die Ergebnisse aus der jüngeren Altersgruppe ausfallen und wie die Booster-Impfung die Schutzwirkung beeinflusst. Je nachdem, wie diese Ergebnisse ausfallen, wird es sich zeigen, ob frühestens im Jahr 2015 ein RTS,S/AS01-Impfstoff auf dem Markt verfügbar sein wird.
Welche Impfstoffansätze gibt es noch?
RTS,S in Kombination mit verschiedenen Adjuvanzien ist der derzeit am weitesten entwickelte Impfstoffkandidat. Und hier hat sich das Adjuvans AS01 im Vergleich zu anderen Verstärkern als besonders reaktiv gezeigt, was sich dann auch in stärkeren Impfreaktionen niederschlug. Durch die verschiedenen Entwicklungsstadien von Plasmodium falciparum sind allerdings theoretisch noch andere Angriffsmöglichkeiten denkbar. Und es werden bereits unterschiedlichste Antigene in klinischen Studien getestet.
Präerythrozyten-Stadium. Sicherlich ist das Präerythrozyten-Stadium ein sehr interessantes Ziel: Zu diesem Zeitpunkt sind noch relativ wenige Parasiten im Körper, und sie befinden sich zunächst auch extrazellulär. So wundert es nicht, dass auch versucht wurde, CSP direkt, oder mit anderen Adjuvanzien oder auch mithilfe von Adenovirus-basierten Systemen als Antigen zu applizieren. Eine sehr komplexe Strategie wurde mit einem "Prime-Boost"-Ansatz gewählt. Hier wurden zwei unterschiedliche rekombinante virale Vektoren, nämlich das Schimpansen-Adenovirus AdCh63 und das modifizierte Vacciniavirus Ankara (MVA) im Abstand von 6 Wochen appliziert. Beide codieren für ME.TRAP, ein Transgen, das aus dem Thrombospondin-related adhesive protein (TRAP) in Fusion mit einem Multi-Epitop-Peptid (ME) besteht. TRAP ist neben CSP ein zweites dominantes Sporozoiten-Oberflächenprotein. ME trägt mehrere B-Zell-, CD4+ - und CD8+ -Epitope. In Mäusen konnte dadurch ein guter Schutz und eine vergleichsweise starke CD8+ -T-Zellantwort erzielt werden. Diese aktivierten CD8+ -T-Zellen sollen dann gezielt die infizierten Leberzellen attackieren und frühzeitig eliminieren.
Mithilfe eines Polyepitops sollen auch in einer anderen Phase-Ia-Studie T-Zellen mobilisiert werden, allerdings wird hier nur die codierende DNA per Elektroporation appliziert. Das eigentliche Antigen wird dann vom Körper selbst hergestellt.
Und schließlich wird in Form von lebend-attenuierten Sporozoiten auch eine klassische Impfstoffherstellung getestet – man kennt ja einige lebend-attenuierte Vakzinen von den viralen Impfstoffen.
Erythrozytäre Phase. Auf den Merozoiten findet man einige Proteine auf der Oberfläche, die als spezifische Antigene in Studien eingesetzt werden: AMA1 (apical membrane antigen 1), EBA-175 (erythrocyte-binding antigen -175), GLURP (glutamate-rich protein), MSP1, MSP2, MSP3 (merozoite surface protein 1 bis 3) und SERA5 (serine-repeat antigen 5). Diese Proteine werden rekombinant in Bakterien oder als synthetische Peptide hergestellt, mit verschiedenen Adjuvanzien versetzt oder über virale Vektoren appliziert. Auch der "Prime-Boost"-Ansatz mit rekombinanten AdCh63 und MVA, Kombinationen verschiedener Merozoiten-Antigene untereinander oder zusammen mit Sporozoiten-Antigenen werden getestet. Allerdings laufen hierfür bisher nur Phase-I- und/oder Phase-II-Studien – immerhin laut "Malaria Vaccine Rainbow Table" der WHO insgesamt 16 – , und es bleibt abzuwarten, ob einer oder mehrere dieser Impfstoffe den Schritt zu Phase-III-Studien schaffen.
Moskito-Stadium. Ein interessanter Vakzinierungsansatz liegt in der Blockade des Übertragungsweges. Hierbei wird mit einem Protein immunisiert, das spezifisch für Gameten, Zygote oder Ookinet sind. Die Idee dahinter ist, dass nach Bildung der spezifischen Antikörper diese Moleküle zusammen mit den Gameten von der blutsaugenden Stechmücke aufgenommen werden. Im Darm der Stechmücke würden die Antikörper an ihre Antigene binden und die weitere Parasitenentwicklung blockieren. Damit wäre eine Möglichkeit gegeben, auch in den Stechmücken gegen die Parasiten vorzugehen. Allerdings müssten für eine effiziente Parasitenbekämpfung wirklich alle möglicherweise betroffenen Menschen immunisiert sein und einen ausreichend hohen Antikörpertiter aufweisen. Nur dann könnte sichergestellt sein, dass die Plasmodien-Entwicklung im Moskitodarm wirklich blockiert wird. Dummerweise hat der Geimpfte selbst jedoch keinen Schutzeffekt durch die Immunisierung, es sei denn, das Gameten-spezifische Protein wird mit einem Sporozoiten- oder Merozoiten-spezifischen Antigen kombiniert.
Fazit und Ausblick
Der Erfolg mit RTS,S/AS01 ist relativ: Ein ca. 50%iger Schutz ist eben nur ein halber Schutz. Dies kann aber im Vergleich zu den bisherigen Bemühungen, einen Malaria-Impfstoff zu entwickeln, sehr wohl als Durchbruch gewertet werden. Hierzulande hätte ein entsprechender – sagen wir – Masern-Impfstoff keinerlei Chance auf Zulassung! Aber man muss gerechterweise auch zugestehen, dass Plasmodium eine ganz andere Pathogen-Klasse darstellt als Bakterien oder Viren. Und selbst bei diesen relativ einfach aufgebauten Bakterien und Viren gibt es oft noch etliche Probleme zu überwinden. Plasmodien sind hingegen nicht nur Eukaryonten. Sie durchlaufen auch einen äußerst komplexen Entwicklungszyklus, innerhalb dessen sie häufig intrazellulär vorliegen.
So ist ein 50%iger Schutz vor klinisch manifester Malaria eigentlich auch gar nicht so schlecht, allerdings auch nicht gut genug, um den Vorgaben der Malaria Vaccine Technology Roadmap von 2006 gerecht zu werden. Hierin wird für 2015 ein Impfstoff angestrebt, der einen mehr als 50%igen Schutz vor schwerer Malaria und Tod bietet und der länger als ein Jahr schützt.
Aber bis 2015 sind es ja auch noch 4 Jahre. Vielleicht klappt es bis dahin mit einem Kombinationsimpfstoff gegen verschiedene Entwicklungsstadien. Erst 2025 soll dann laut Roadmap das Ziel erreicht sein, mit einem Impfstoff einen Schutz vor klinisch manifesterer Malaria von mindestens 80% zu erreichen, der länger als vier Jahre besteht.
Eines erkennt man aber auch an der Malaria-Impfstoffforschung: Durch die genaue Kenntnis des parasitären Entwicklungszyklus, durch die Aufklärung der Genome des Menschen, der Anopheles -Mücke und der Plasmodien sind mittlerweile so viele potenzielle Antigene bekannt, dass sehr kreativ daraus Impfstoffkandidaten zusammengesetzt werden können. Zusätzlich stehen mittlerweile sehr unterschiedliche und sehr potente Adjuvanzien zur Verfügung, die sehr gezielt das Immunsystem unterstützen können.
Es besteht also Hoffnung darauf, dass die Malaria zukünftig in Schach gehalten werden kann, allerdings wird sie vorläufig wohl nicht ausgerottet werden. Daher bleiben konventionelle Maßnahmen, z. B. die sehr umfassende und kostenlose Bereitstellung von Moskito-Netzen äußerst wichtig. Dies hat mit Sicherheit dazu beigetragen, dass die Malaria-Fälle in den letzten Jahren leicht rückläufig sind. Und es zeigt, dass auch relativ einfache Mittel Wirkungen zeigen können. Bis zur weltweiten Ausrottung ist es allerdings noch lange hin, momentan stecken wir mitten in den Maßnahmen auf dem Weg dahin (Abb. 3). Ein wichtiger Schritt könnte jetzt mit der Impfstoffformulierung RTS,S/AS01 gemacht worden sein.
Literatur
Autoren
Prof. Dr. Theo Dingermann, Dr. Ilse Zündorf
Institut für Pharmazeutische Biologie,
Goethe-Universität Frankfurt a.M.,
Max-von-Laue-Str. 9, 60438 Frankfurt






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.