
- DAZ.online
- DAZ / AZ
- DAZ 10/2012
- Depotarzneiformen für ...
UniDAZ
Depotarzneiformen für Proteine und Peptide
Injizierbare Implantate aus natürlichem β‑Glucan mit PEG oder Dextran
EditorialLiebe Leserinnen, liebe Leser! Der Siegerbeitrag des diesjährigen UniDAZ-Wissenschaftspreises ging aus einer Diplomarbeit hervor, die im Rahmen eines Kooperationsprojektes des Instituts für Pharmazeutische Technologie der Universität des Saarlandes mit der neuseeländischen University of Auckland angefertigt wurde. Dies ist bemerkenswert, weil es eine seltene Ausnahme ist. Um Nachwuchswissenschaftler frühzeitig zum Austausch mit internationalen Fachkollegen anzuregen, bietet die Diplomprüfungsordnung der Universität des Saarlandes die Möglichkeit, den praktischen Teil der Diplomarbeit an einer ausländischen Hochschule anzufertigen. Eingereicht wird die Diplomarbeit dabei am Ende, wie bei rein deutschen Projekten auch, an der Universität des Saarlandes. So erhalten die Studenten die einmalige Möglichkeit, den Erwerb eines deutschen Diploms mit einem mehrmonatigen Aufenthalt an einer ausländischen Hochschule zu verbinden. Ihre UniDAZ-Redaktion |
Verabreichung therapeutischer Proteine und Peptide
Proteine und Peptide spielen in der Abwehr von Krankheiten eine wichtige Rolle. Der gentechnologische Fortschritt hat zu einem Anstieg in der Entwicklung therapeutischer Proteine und Peptide geführt, jedoch gilt es, zahlreiche Herausforderungen zu überwinden, damit diese Moleküle ihren Zielort im Körper erreichen können.
Proteine und Peptide sind gegenüber enzymatischem Abbau und schneller Clearance aus dem Blutkreislauf anfällig, daher sind häufige Injektionen in vielen Fällen unumgänglich, was wiederum zu hohen Kosten und schlechter Patientenakzeptanz führt [1, 2]. Dementsprechend sind parenterale Systeme, die eine verzögerte Freisetzung von Proteinen und Peptiden bewirken, erwünscht.
Parenterale Depotarzneiformen mit verlängerter Wirkstofffreigabe
Die Entwicklung neuer injizierbarer Systeme zur verzögerten Wirkstofffreigabe hat über die letzten Jahre viel Aufmerksamkeit auf sich gezogen. Bei diesen Systemen kann die Freisetzung des Wirkstoffs durch die Einbettung in Wirkstoffträger gesteuert werden.
Einige Schwierigkeiten, die bei der Verwendung der parenteralen Wirkstoffträgersysteme Emulsionen, Liposomen, Mizellen und Mikrosphären auftreten können, sollen an dieser Stelle nur kurz angesprochen werden.
Emulsionen werden weit verbreitet für Injektionen genutzt, sind aber aufgrund von Stabilitätsproblemen ungeeignet für eine verzögerte Wirkstofffreisetzung [3].
Nachteile von Liposomen sind eine hohe Clearance, Stabilitätsprobleme und eine geringe Wirkstoffbeladungseffizienz, während Mizellen zum Zerfall in einzelne Ketten neigen, wodurch die Gefahr von "Dose Dumping" wächst [3].
Auch bei Mikrosphären ist die Fähigkeit, Wirkstoff aufzunehmen, begrenzt. Ihre Herstellung ist zudem ein komplexes, mehrstufiges Verfahren, das schwierig vom Labor- auf den Produktionsmaßstab zu übertragen ist [4].
Systeme, die eine einfache und bequeme Anwendung mit hoher Reliabilität gewährleisten, findet man im Bereich der Implantate [5], die in zwei Gruppen, feste und injizierbare Implantate, eingeteilt werden können. Während feste Implantate ex vivo hergestellt werden, nehmen injizierbare Implantate erst in vivo ihre feste Form an.
Feste Implantate
Konventionelle Implantate (Profact® Depot, Zoladex®) sind meist durch Schmelzextrusion oder -verpressung hergestellte Polymerstäbchen, in die der Wirkstoff eingebettet ist [4]. Dank gut kontrollierbarer Herstellungsprozesse zeigen feste Implantate häufig sehr gut reproduzierbare Wirkstofffreisetzungen [5].
Unvorteilhaft ist die Tatsache, dass chirurgische Eingriffe oder das Verwenden großer Hohlnadeln zur Implementierung des festen Implantates notwendig sind und daraus eine niedrige Akzeptanz durch den Patienten sowie ein Infektionsrisiko resultieren können [6, 7]. Erhöhte Prozesstemperaturen während der Extrusion können zudem thermolabile Arzneistoffe inaktivieren. Außerdem kann es bei niedrigem Wirkstoffgehalt zu einer Verteilung und damit zu Konzentrationsschwankungen kommen [4].
Injizierbare Implantate
Injizierbare Implantate sind abbaubare, spritzbare Formulierungen, die subkutan oder intramuskulär als Flüssigkeit injiziert werden und im Körper aufgrund verschiedener Mechanismen ein Gel bilden [3, 6]. Da das injizierbare Implantat mit einer konventionellen Spritze verabreicht werden kann und sich mit der Zeit von selbst auflöst, sind keine chirurgischen Eingriffe notwendig, wodurch die Infektionsgefahr sinkt [7].
Durch die Gelbildung bewirken injizierbare Implantate eine verzögerte Freisetzung des Wirkstoffs, wodurch die Compliance steigt und die Gesamtkosten sinken.
Da injizierbare Implantate den Wirkstoffspiegel im Blut konstant halten, tragen sie auch zur Medikamentensicherheit bei [8].
Injizierbare Implantate sind aus den genannten Vorteilen daher besonders für die verzögerte Freisetzung von empfindlichen Protein- und Peptidtherapeutika interessant.
Injizierbare Implantate werden bereits für die Verabreichung von Protein- und Peptidwirkstoffen eingesetzt, z. B. das Eligard® -System, das den Wirkstoff Leuprorelin, ein GnRH-Analogon, freisetzt [5] und bei Prostatakrebs eingesetzt wird.
Zudem kommen injizierbare Implantate beim Gewebeersatz [9, 10], bei kosmetischen Operationen [11] und als langwirksames Verhütungsmittel, z. B. als Dreimonatsspritze mit dem Gestagen Medroxyprogesteronacetat [12], zum Einsatz.
Wichtige Eigenschaften eines Polymers im Hinblick auf seine Tauglichkeit als Formulierung für ein injizierbares Implantat sind
- Bioabbaubarkeit,
- Biokompatibilität,
- schnelle Gelbildung,
- niedrige Viskosität und
- kurze Aushärtezeit [13, 14].
β‑Glucan
(1→3)(1→4)-β‑Glucan ist ein Zellwandpolysaccharid, das in Bakterien, Pilzen, Hefe, Algen sowie im Endosperm und Aleurons von Getreidearten wie Gerste, Hafer, Roggen und Weizen zu finden ist [15]. Tabletten mit β‑Glucan als Wirkstoffträger wurden bereits im Hinblick auf ihre In-vitro-Freisetzung untersucht und zeigten eine verzögerte Wirkstofffreisetzung [16].
Allerdings wurde β‑Glucan unseres Wissens noch nicht auf seine Eignung für injizierbare Implantate getestet.
Gelbildung durch Zweiphasensysteme
Eine Veränderung der Temperatur, des pH-Wertes, der Ionenkonzentration oder des Lösemittels kann häufig einen Sol‑Gel-Phasenübergang eines Polymers bewirken [17, 18]. Sollte dies nicht der Fall sein, besteht eine weitere Möglichkeit zum Gelübergang in der Bildung eines Zweiphasensystems [3].
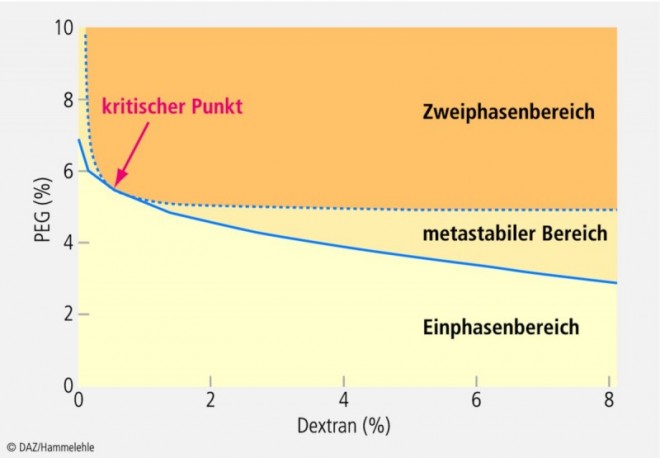
In ternären Systemen, die sich aus zwei verschiedenen wasserlöslichen Polymeren, wie z. B. Dextran und Polyethylenglykol (PEG), sowie Wasser in bestimmten Verhältnissen zusammensetzen, kann man die Bildung von Zweiphasensystemen beobachten [19, 20] (Abb. 1).
Zweiphasensysteme treten auf, wenn bestimmte Grenzkonzentrationen der Polymere überschritten werden. Dieser Prozess hängt unter anderem von der Art des Polymers, dem Molekulargewicht sowie der Zugabe von Ionen ab [21].
Derzeit setzt man Zweiphasensysteme unter anderem für die Herstellung von Dextran-Mikrosphären ein [19], jedoch fanden Zweiphasensysteme bisher noch keinen Einsatz in der Herstellung injizierbarer Implantate.
Fokus der Diplomarbeit
Das Ziel dieser Arbeit war die Untersuchung des Gelbildungsmechanismus von β‑Glucan-Formulierungen im Hinblick auf deren Eignung als injizierbares Implantat.
Zuerst wurde der Einfluss verschiedener Parameter, wie z. B. der β‑Glucan-Konzentration in der Formulierung, des pH-Wertes, der Ionenkonzentration, der Temperatur und der Zugabe der Polymere Dextran und PEG, auf die Gelbildung getestet. Hierzu wurden die Viskosität und der Gelcharakter ausgewählter Formulierungen mittels oszillierendem Rheometer untersucht. Messungen mit dem Texture Analyser lieferten Ergebnisse über Geleigenschaften und Spritzbarkeit der Formulierungen. Schlussendlich wurde die In-vitro-Freisetzung eines Modell-Arzneistoffes von ausgesuchten Formulierungen durchgeführt, um die Fähigkeiten der verzögerten Wirkstofffreisetzung zu prüfen. Die genutzten Methoden werden im Folgenden nur kurz beschrieben. Für genauere Informationen verweisen wir die Leser auf die kürzlich veröffentlichte Publikation der Autoren [22].
Einfluss der β‑Glucan-Konzentration und der Temperatur auf die Gelbildung
Je höher die β‑Glucan-Konzentration, desto stärker der Gelcharakter der Formulierungen (Abb. 2). 2,4% β‑Glucan war die am höchsten konzentrierte Formulierung, die noch keinen Gelcharakter aufwies, aber noch eine gute Spritzbarkeit gewährleistete. Daher wurden Formulierungen mit β‑Glucan in einer Konzentration von 2,4% sowie 1,5%, die in Vortests gute Ergebnisse zeigten, als Ausgangsmaterialien für weitere Experimente ausgewählt.
Wie von β‑Glucan als nichtionischer Substanz erwartet wurde, bewirkte eine Änderung des pH-Wertes oder die Zugabe von Ionen keine Gelbildung.
Ein Temperaturanstieg über 45 °C resultierte in einer Verflüssigung der 2,4% β‑Glucan-Formulierung, wohingegen sich die 1,5% β‑Glucan-Formulierung als temperaturunabhängig erwies. Demzufolge konnte auch ein Temperaturanstieg nicht zur Gelbildung verwendet werden.
Da auch bei niedrigeren Temperaturen keine deutliche Änderung der Gelstruktur beobachtet werden konnte, sollte eine zur Stabilisierung der Proteine notwendige Lagerung im Kühlschrank keine Veränderung der Gelstruktur bewirken.
Zweiphasensysteme – Einfluss der Dextran- und PEG-Konzentration
Zwei β‑Glucan-Formulierungen wurden mit Dextran und PEG in verschiedenen Verhältnissen gemischt, um herauszufinden, welche Konzentrationen die beste Gelbildung bewirken. Die Fließindices wurden sofort und 15 Minuten nach dem Mischen gemessen. Der Fließindex N ist von dem Potenzgesetz für Flüssigkeiten abgeleitet und ein Maß für das Fließverhalten der Formulierung [23]. Höhere β‑Glucan-Polymer-Konzentrationen führten nach 15 Minuten erwartungsgemäß zu höher viskosen Gelen (mit niedrigeren N-Werten; Tab. 1).
Tab. 1: Fließindices (N) von Zweiphasensystemen mit β-Glucan (1,5% oder 2,4%) und PEG oder Dextran | ||||
Formulierung |
1,5% β-Glucan |
2,4% β-Glucan |
||
0 min |
15 min |
0 min |
15 min |
|
β-Glucan
(Referenz) |
0,990 ± 0,078 |
0,990 ± 0,078 |
0,997 ± 0,019 |
0,997 ± 0,019 |
β-Glucan + PEG (1:1) |
0,970 ± 0,392 |
0,748 ± 0,331 |
0,647 ± 0,146 |
0,573 ± 0,058 |
β-Glucan + PEG (1:2) |
0,627 ± 0,131 |
0,276 ± 0,408 |
0,633 ± 0,051 |
0,190 ± 0,220 |
β-Glucan + PEG (1:3) |
0,619 ± 0,626 |
0,240 ± 0,363 |
0,624 ± 0,070 |
0,096 ± 0,103 |
β-Glucan + Dextran (1:1) |
0,905 ± 0,019 |
1,070 ± 0,201 |
0,981 ± 0,041 |
0,997 ± 0,014 |
β-Glucan + Dextran (1:2) |
1,044 ± 0,015 |
1,010 ± 0,009 |
0,954 ± 0,028 |
0,828 ± 0,025 |
β-Glucan + Dextran (1:3) |
1,006 ± 0,036 |
1,125 ± 0,020 |
0,862 ± 0,186 |
0,720 ± 0,247 |
Nach Zugabe von PEG war die Gelbildung viel schneller und kompakter als nach Zugabe von Dextran. Eine Erklärung hierzu könnte die unterschiedliche Struktur und folglich Wasseraffinität der beiden Polymere liefern: Dextran ähnelt strukturell dem β‑Glucan, während PEG eine gänzlich andere Struktur aufweist. Aufgrund seiner höheren Wasseraffinität könnte PEG dem β‑Glucan das gebundene Wasser entziehen, was zu einer rascheren und dichteren Gelbildung führt.
Die Formulierungen 2,4% β‑Glucan mit 7,2% Dextran (Verhältnis 1:3) und 1,5% β‑Glucan mit 4,5% PEG (Verhältnis 1:3) zeigten eine sehr gute Gelbildung (in Tab. 1 hervorgehoben). Sie wurden daher durch Messung der mechanischen Eigenschaften und der In-vitro-Freisetzung einer Modellsubstanz weitergehend evaluiert.
Injizierbarkeit der Zweiphasensysteme
Zehn Minuten nach Zumischen der Polymere PEG bzw. Dextran zur β‑Glucan-Formulierung musste bei beiden Systemen deutlich mehr Kraft aufgewendet werden, um die Formulierung aus der Spritze zu befördern. Nach 30 Minuten konnten die Formulierungen nicht mehr ausgedrückt werden, weil die verfestigten Gele die Nadel verstopft hatten. Um eine Verstopfung zu vermeiden, sollten die Formulierungen folglich innerhalb von 10 Minuten nach Mischen injiziert werden.
Mechanische Eigenschaften der Zweiphasensysteme
Nach Zugabe von Dextran oder PEG nahmen erwartungsgemäß die Härte und Anhaftungsneigung der Systeme deutlich zu. Die β‑Glucan-PEG-Formulierung wies 24 Stunden nach dem Mischen eine signifikant höhere Härte als das β‑Glucan-Dextran-System auf, was wiederum auf die höhere Wasseraffinität des PEG zurückgeführt werden könnte.
Nach Injektion in den Körper würde das β‑Glucan-PEG-System folglich schneller ein festes Implantat formen, was im Hinblick auf die Arzneimittelsicherheit günstig zu bewerten ist.
In-vitro-Freisetzung der Zweiphasensysteme
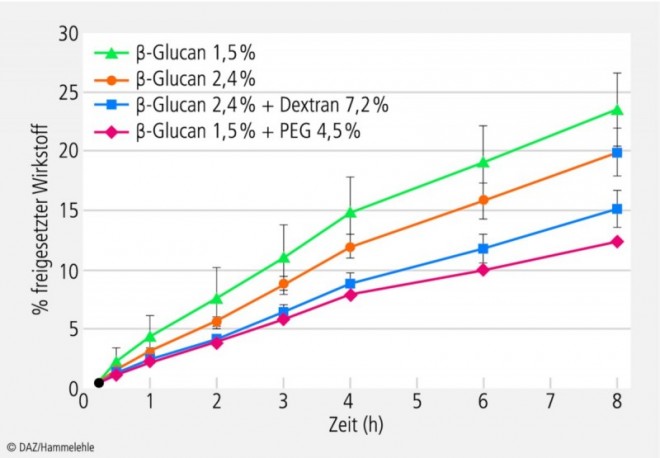
In-vitro-Freisetzungsprofile der Systeme wurden mit der Modellsubstanz Natriumfluorescein mittels Franz-Diffusionszelle erstellt (Abb. 3). Bei der Referenzformulierung 1,5% β‑Glucan ohne Polymerzusatz wurde die schnellste Freisetzung beobachtet (23,5% in 8 Stunden), während von dem β‑Glucan-PEG-System nur etwa die Hälfte dieser Menge (12,3% in 8 Stunden) freigesetzt wurde; diese Formulierung erwies sich somit als die beste, um die Wirkstofffreisetzung zu verzögern.
Fazit
Diese Studie evaluierte den Nutzen eines natürlich vorkommenden Polymers, β‑Glucan, im Hinblick auf seine Eignung für die Bildung injizierbarer Implantate.
Ein bioabbaubares injizierbares Implantat, das eine verzögerte Freisetzung von Protein- und Peptidtherapeutika bietet, könnte die Patientenakzeptanz beachtlich verbessern, die Gesamttherapiekosten senken und die Infektionsgefahr verringern.
Als entscheidende Einflussfaktoren auf die Gelbildung stellten sich die β‑Glucan-Konzentration und die Zugabe von weiteren Polymeren zum System heraus. Der Einfluss des pH-Wertes und der Ionen war hingegen vernachlässigbar.
Die Zugabe der Polymere Dextran und PEG führte zu der Bildung von Zweiphasensystemen, die als vielversprechendste Methode betrachtet wurde, um eine schnelle Gelbildung und ein Gel ausreichender Härte zu erhalten.
Ein zusätzlicher Vorteil dieser Systeme ist, dass Polymere wie PEG in der Lage sind, die native Struktur von Proteinen zu stabilisieren [19].
Für die praktische Anwendung der Zweiphasensysteme könnte eine Zweikammerspritze eingesetzt werden, wobei die β‑Glucan-Formulierung in die eine und PEG oder Dextran in die andere Kammer gefüllt werden würde. Durch Anstechen der beiden Kammern könnten somit die beiden Komponenten kurz vor der Injektion gemischt werden. Wie in den Spritzbarkeitstests gezeigt wurde, ist es wichtig, die Injektion innerhalb von 10 Minuten nach dem Mischen der beiden Komponenten durchzuführen, um ein Verstopfen der Injektionsnadel zu vermeiden.
Die 1,5% β‑Glucan-Formulierung mit 4,5% PEG (Verhältnis 1:3) erwies sich wegen folgender Eigenschaften als die vielversprechendste Formulierung: schnelle Gelbildung mit hoher Härte, hohe Viskosität kurz nach dem Mischen und stark verzögerte In-vitro-Freisetzung des Modellarzneistoffes.
Zudem weist 1,5% β‑Glucan als Ausgangsmaterial gegenüber 2,4% β‑Glucan die Vorteile der Temperaturunabhängigkeit und der einfachen Spritzbarkeit auf.
Die untersuchten Zweiphasensysteme stellen daher einen Erfolg versprechenden Ansatz für injizierbare Implantate zur verzögerten Freisetzung von Proteinen und Peptiden dar und sollten weiter evaluiert werden.
Ausblick
Im Rahmen dieser Studie wurden der Einfluss der Polymerkonzentration, Temperatur, Ionen, des pH-Wertes sowie die Bildung von Zweiphasensystemen mit Dextran und PEG untersucht und evaluiert, jedoch könnten auch andere Parameter eine Rolle in der Gelbildung spielen.
Weiterführende Studien könnten daher z. B. folgende Aspekte untersuchen:
In dieser Studie wurde ein wässriger Rohextrakt (β‑Glucan-Konzentration 80 – 90%) genutzt. Die Verunreinigungen könnten einen Einfluss auf die Geleigenschaften haben, daher sollte der Einfluss der Quelle des Polymers sowie des Herstellungs- und Aufreinigungsprozesses auf die Geleigenschaften und In-vitro-Freisetzungscharakteristika untersucht werden.
In dieser Studie wurde untersucht, welchen Einfluss das Verhältnis β‑Glucan zu PEG bzw. Dextran hat, jedoch wurde der Einfluss verschiedener Molekulargewichte des Polymers noch nicht evaluiert.
Der momentane Herstellungsprozess der Formulierungen beinhaltet zahlreiche Schritte, die zu Variationen der Formulierung führen könnten und zudem zeitintensiv sind, wie z. B. die Zugabe des Polymers zu der Ausgangsdispersion und die Homogenisierung der Mischung. Weitere Studien zur Entwicklung praktischerer, idealerweise bereits gebrauchsfertiger Formulierungen, z. B. einer gefriergetrockneten Mischung, die durch Wasserzugabe aktiviert wird, sind folglich notwendig.
Es muss ein geeigneter Sterilisationsprozess der Formulierung entwickelt werden, der sich vor allem bei 2,4% β‑Glucan aufgrund seiner Temperaturabhängigkeit schwierig gestalten könnte.
Nach erfolgreicher Absolvierung von Präformulierungsstudien könnten sich In-vivo-Experimente zuerst an Tieren und dann an Menschen anschließen, um das In-vivo-Freisetzungsprofil des Arzneistoffes sowie die Toxizität und Dosis-Wirkungs-Beziehungen zu untersuchen.
Literatur
[1] Cleland JL, et al. Emerging protein delivery methods. Curr Opin Biotechnol 2001;12(2):212 – 219.[2] Cho KY, et al. In Situ Micro-Sized Gel-Forming Injectable Implant Using Biodegradable Amphiphilic Graft Copolymer. Macromol Biosci 2007;7(6):784 – 788.
Autorin
Simone Jacobs studierte von 2005 bis 2009 Pharmazie an der Universität des Saarlandes in Saarbrücken. Ihre Diplomarbeit im Fach Pharmazeutische Technologie schloss sie im Sommer 2011 ab. Gegenwärtig promoviert sie am Deutschen Institut für Ernährungsforschung (DIfE) in Potsdam im Bereich der molekularen Epidemiologie und absolviert parallel dazu in Teilzeit ein Masterstudium in Epidemiologie an der Berliner Charité.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.