
- DAZ.online
- DAZ / AZ
- DAZ 26/2013
- Vierfach-Power gegen Aids
Arzneimittel und Therapie
Vierfach-Power gegen Aids
In Deutschland leben derzeit etwa 73.000 Aids-Patienten, 2011 lag die Zahl der Neuerkrankungen bei 2700. Zur Therapie einer HIV-Infektion stehen inzwischen über 20 Arzneimittel zur Verfügung. "Aufgrund der Resistenzproblematik des HI-Virus sowie der Nebenwirkungen einiger Substanzen ist jedoch die Entwicklung weiterer Wirkstoffe nötig", erklärte Prof. Dr. Georg M. N. Behrens, Hannover, auf einer von der Gilead Sciences GmbH unterstützten Pressekonferenz im Rahmen des Deutsch-Österreichischen Aids-Kongresses am 13. Juni 2013 in Innsbruck.
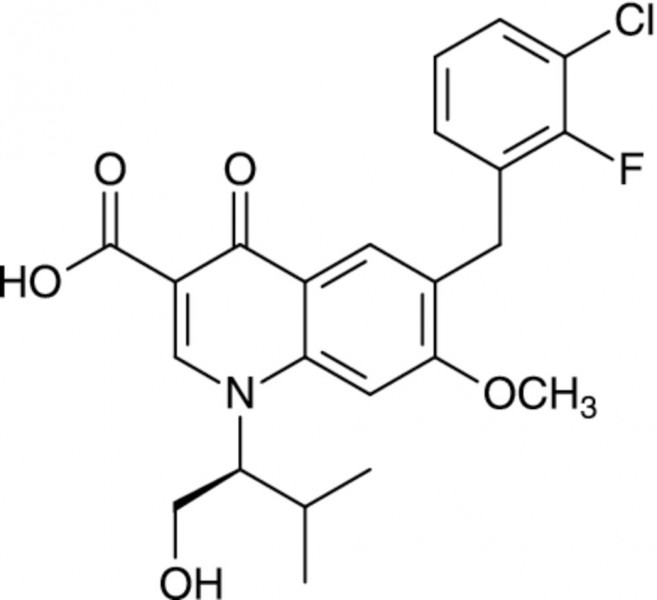
Neuer Integrasehemmer Elvitegravir
Als derzeit modernste Klasse antiretroviraler Substanzen gelten die HIV-Integrase-Strangtransfer-Inhibitoren, auch als Integrasehemmer bezeichnet. Sie blockieren ein aus 288 Aminosäuren bestehendes Schlüsselenzym im Vermehrungszyklus der HI-Viren. Mit der mithilfe der Reversen Transkriptase aus der RNA synthetisierten Virus-DNA bildet die Integrase im Zytoplasma einen Präintegrationskomplex, der in den Zellkern des CD4+-T-Lymphozyten geschleust wird. Dort bindet die Integrase an die Wirts-DNA und katalysiert das Einfügen des viralen DNA-Strangs (Strangtransfer). Integraseinhibitoren hemmen die Aktivität des Enzyms durch Wechselwirkung mit zweiwertigen Kationen im katalytischen Zentrum. 2007 wurde mit Raltegravir (Isentress®) der erste Integrasehemmer in Kombination mit anderen antiretroviralen Wirkstoffen zur Behandlung einer HIV-1-Infektion zugelassen.
Nur einmal tägliche Einnahme
Während Raltegravir zweimal täglich eingenommen werden muss, wird ein großer Vorteil des neu entwickelten Wirkstoffes Elvitegravir in der nur einmal täglichen Einnahme gesehen. Dies ermöglicht eine Verabreichung im Rahmen von Single-Tablet-Regimen, das heißt fixen Kombinationen mit anderen antiretroviralen Wirkstoffen. Da für viele HIV-Patienten die regelmäßige und lebenslange tägliche Einnahme der verordneten Medikamente eine große Herausforderung darstellt, können Single-Tablet-Regime zur Verbesserung der Adhärenz beitragen.
Cobicistat ist ein selektiver Inhibitor der CYP3A-Unterfamilie, er hat selber keine antivirale Aktivität.
In Stribild® ist Elvitegravir mit Cobicistat, Emtricitabin und Tenofovir-Disoproxilfumarat kombiniert. Cobicistat wird zur Boosterung eingesetzt: Es hat selbst keine Wirkung gegen HI-Viren, sondern ist ein starker CYP3A-Inhibitor sowie ein schwacher CYP2D6-Inhibitor und hemmt damit den Abbau von Elvitegravir. Der nukleosidische Reverse-Transkriptase-Inhibitor Emtricitabin ist bereits zur Behandlung der HIV-Infektion bei Erwachsenen und Kindern zugelassen (Emtriva®), der nukleotidanaloge Hemmstoff der Reversen Transkriptase Tenofovir-Disoproxilfumarat (Viread®) steht seit 2002 zur Verfügung. Eine Kombination der beiden Wirkstoffe ist als Truvada® in der HIV-Therapie etabliert. Stribild® wird zur Behandlung der Infektionen mit dem Humanen Immundefizienzvirus 1 (HIV-1) bei Erwachsenen angewendet, die nicht antiretroviral vorbehandelt sind oder bei denen HIV-1 keine Mutationen aufweist, die bekanntermaßen mit Resistenzen gegen einen der antiretroviralen Wirkstoffe von Stribild® assoziiert sind.
EinnahmehinweiseStribild® sollte einmal täglich zum Essen eingenommen werden. Die Filmtablette darf nicht zerkaut oder zerteilt werden. Verglichen mit dem Nüchternzustand bewirkte die Einnahme von Stribild® zu einer leichten Mahlzeit (20% Fett) oder zu einer fettreichen Mahlzeit (50% Fett) eine höhere systemische Verfügbarkeit von Elvitegravir und Tenofovir. Die Cobicistat-Exposition blieb von einer leichten Mahlzeit unbeeinflusst, und obwohl es nach einer fettreichen Mahlzeit zu einem leichten Rückgang der Cmax und AUC kam, wurde hinsichtlich seiner pharmakologisch verstärkenden Wirkung auf Elvitegravir kein Unterschied beobachtet. Wird die Einnahme von Stribild® um bis zu 18 Stunden gegenüber der gewohnten Einnahmezeit versäumt, sollte sie so bald wie möglich zum Essen nachgeholt und das gewohnte Einnahmeschema fortgesetzt werden. Wird die Einnahme um mehr als 18 Stunden versäumt und es fast Zeit für die nächste Dosis ist, sollte die versäumte Dosis nicht nachgeholt, sondern das gewohnte Einnahmeschema fortgesetzt werden. Erbricht der Patient innerhalb von einer Stunde nach der Anwendung, sollte er eine weitere Tablette einnehmen. |
Nichtunterlegenheit gezeigt
In den beiden Zulassungsstudien GS-102 und GS-103 wurde die neue Viererkombination mit zwei anderen First-line-Regimen verglichen: einem Single-Tablet-Regime bestehend aus Efavirenz, Emtricitabin und Tenofovir-Disoproxilfumarat (Atripla®) sowie einem Regime bestehend aus mit Ritonavir geboostertem Atazanavir (Reyataz®) plus Emtricitabin und Tenofovir-Disoproxilfumarat (Truvada®). In die beiden randomisierten, doppelblinden, aktiv kontrollierten Phase-III-Studien wurden 700 nicht vorbehandelte Patienten eingeschlossen. Primärer Studienendpunkt war die Nicht-Unterlegenheit der neuen Viererkombination gegenüber den Vergleichsregimen (Nachweis über den Anteil an Patienten mit einer Viruslast unter der Nachweisgrenze von 50 Kopien/ml). Nach 48 Wochen erreichten in der FDA-Snapshot-Analyse der Studie GS-102 unter Atripla® 84% der Patienten eine Viruslast < 50 Kopien/ml, unter Stribild® waren es 88%. In der Studie GS-103 erreichten 87% der Vergleichskombination-Patienten nach 48 Wochen dieses Therapieziel, unter Stribild® 90%. Auch nach 96 Wochen zeigt die integrierte Analyse beider Studien keine Unterschiede in der Effektivität zwischen den drei Therapieregimen in Bezug auf Viruslast und CD4-Zellzahl zu Studienbeginn. Die Wirkung von Stribild® setzte schnell ein – bereits nach vier Wochen erreichten in den Zulassungsstudien 60% der Patienten eine Viruslast unter der Nachweisgrenze.
Frühe NutzenbewertungWie alle neu zugelassenen Arzneimittel wird auch Stribild® ein frühes Nutzenbewertungsverfahren nach § 35a SGB V durchlaufen, um die Preisbildung und damit die Erstattungsfähigkeit durch die gesetzliche Krankenversicherung (GKV) zu regeln. Beginn des Verfahrens war am 15. Juni 2013, am 16. September 2013 wird die Nutzenbewertung veröffentlicht und das schriftliche Stellungnahmeverfahren eröffnet, mit einer Beschlussfassung ist Anfang Dezember 2013 zu rechnen. Die Zeitpläne zur Nutzenbewertung von neuen Arzneimitteln können im Internet eingesehen werden (Stribild®: www.g-ba.de/informationen/nutzenbewertung/72/), ebenso die Dokumentationen bereits abgeschlossener Verfahren. |
Komedikation berücksichtigen
In allen Studien wurden die Behandlungen gut vertragen, die Abruchraten wegen Nebenwirkungen waren gering. Zu den in den Studien als sehr häufig klassifizierten Nebenwirkungen zählen gastrointestinale Symptome (Diarrhö, Erbrechen, Übelkeit), Kopfschmerzen, Schwindelgefühl sowie Hautausschlag. Die gastrointestinalen Beschwerden klangen in der Regel innerhalb der ersten zwei Wochen ab. Stribild® sollte nicht gleichzeitig mit folgenden Wirkstoffen eingenommen werden, da schwerwiegende Ereignisse oder ein Verlust des virologischen Ansprechens möglich sind:
- Alpha-1-Adrenozeptor-Antagonisten: Alfuzosin
- Antiarrhythmika: Amiodaron, Chinidin
- Antikonvulsiva: Carbamazepin, Phenobarbital, Phenytoin
- Antimykotika: Rifampicin
- Ergotaminderivate: Dihydroergotamin, Ergometrin, Ergotamin
- pflanzliche Präparate: Johanniskraut
- HMG-CoA-Reduktasehemmer: Lovastatin, Simvastatin
- Neuroleptika: Pimozid
- PDE-5-Hemmer: Sildenafil zur Behandlung der pulmonalen arteriellen Hypertonie
- Sedativa/Hypnotika: Midazolam (oral), Triazolam
Zu beachten ist, dass die CYP450-Hemmung von Cobicistat bei einer Komedikation, die über das gleiche Enzymsystem metabolisiert wird, zu erhöhten Plasmakonzentrationen führen kann. Cobicistat hemmt die tubuläre Kreatininsekretion und führt zu einem erhöhten Serumkreatinin-Spiegel. So können die Konzentrationen von Betablockern und Calciumantagonisten bei gleichzeitiger Anwendung erhöht sein. Hier wird eine enge klinische Überwachung empfohlen, eventuell muss die Dosis reduziert werden.
Steckbrief: ElvitegravirHandelsname: Stribild Hersteller: Gilead Sciences GmbH Einführungsdatum: 17. Juni 2013 Zusammensetzung: 1 Filmtablette enthält 150 mg Elvitegravir, 150 mg Cobicistat, 200 mg Emtricitabin und 245 mg Tenofovirdisoproxil (entsprechend 300 mg Tenofovirdisoproxilfumarat bzw. 136 mg Tenofovir). Sonstige Bestandteile: Jede Tablette enthält 10,9 mg Lactose (als Monohydrat), Tablettenkern: Croscarmellose-Natrium, Hyprolose, Lactose-Monohydrat, Magnesiumstearat (Ph.Eur.), Mikrokristalline Cellulose, Siliciumdioxid, Natriumdodecylsulfat: Filmüberzug: Indigocarmin, Aluminiumsalz (E 132), Macrogol, Poly(vinylalkohol), Talkum (E 553b), Titandioxid (E 171), Eisen(III)-hydroxid-oxid × H2 O (E 172). Packungsgröße, Preis und PZN: 30 (N2) Filmtabletten, 1444,73 Euro, PZN 04704011; 3 x 30 (N3) Filmtabletten, 4257,19 Euro, PZN 04704028. Stoffklasse: Antiinfektiva zur systemischen Anwendung, antivirale Mittel zur systemischen Anwendung, direkt wirkende antivirale Mittel: ATC-Code: J05AR09 Indikation: Elvitegravir wird zur Behandlung der Infektion mit dem Humanen Immundefizienzvirus 1 (HIV-1) bei Erwachsenen im Alter von 18 Jahren und darüber angewendet, die nicht antiretroviral vorbehandelt sind oder bei denen HIV-1 keine Mutationen aufweist, die bekanntermaßen mit Resistenzen gegen einen der drei antiretroviralen Wirkstoffe von Stribild® assoziiert sind. Dosierung: Einnahme einer Tablette mit 150 mg Elvitegravir, 150 mg Cobicistat, 200 mg Emtricitabin und 245 mg Tenofovirdisoproxil einmal täglich zum Essen. Gegenanzeigen: Überempfindlichkeit gegen die Wirkstoffe. Nebenwirkungen: Die am häufigsten gemeldeten Nebenwirkungen, für die ein Zusammenhang mit Stribild® als möglich oder wahrscheinlich erachtet wurde, waren Übelkeit (16%) und Diarrhö (12%). Wechselwirkungen: Da Stribild® Elvitegravir, Cobicistat, Emtricitabin und Tenofovirdisoproxilfumarat enthält, können alle Wechselwirkungen, die für die einzelnen Wirkstoffe ermittelt wurden, auch unter Stribild® auftreten. Elvitegravir gilt als mäßiger Induktor und hat das Potenzial, CYP2C9 und/oder induzierbare UGT-Enzyme zu induzieren; daher kann es die Plasmakonzentration von Substraten dieser Enzyme verringern. Elvitegravir wird durch CYP3A und in geringem Ausmaß auch durch UGT1A1 metabolisiert. Es wird angenommen, dass Arzneimittel, die die CYP3A-Aktivität induzieren, die Clearance von Elvitegravir steigern, was zu einer verringerten Plasmakonzentration und damit zu einem Verlust der therapeutischen Wirkung sowie zu einer Resistenzentwicklung führen kann. Die gleichzeitige Anwendung von Stribild® und Arzneimitteln, die hauptsächlich durch CYP3A metabolisiert werden, kann zu erhöhten Plasmakonzentrationen dieser Arzneimittel führen. Daher ist die gleichzeitige Anwendung mit anderen Arzneimitteln, wie Amiodaron, Chinidin, Cisaprid, Pimozid, Alfuzosin und Sildenafil kontraindiziert. Ebenso ist die gleichzeitige Anwendung von Stribild® und verschiedenen Arzneimitteln, die CYP-3A induzieren (z. B. Johanniskraut, Rifampicin, Carbamazepin, Phenobarbital und Phenytoin) kontraindiziert, da die Plasmakonzentrationen von Cobicistat und Elvitegravir signifikant herabgesetzt sein kann. Die Plasmakonzentration von Elvitegravir ist bei gleichzeitiger Anwendung von Antazida infolge lokaler Komplexbildung im Gastrointestinaltrakt und nicht aufgrund von Veränderungen des gastrischen pH-Werts verringert. Es wird empfohlen, Stribild® und Antazida mit mindestens vier Stunden Abstand einzunehmen. Warnhinweise und Vorsichtsmaßnahmen: Bei Patienten mit einem Risiko für eine Nierenfunktionsstörung sollte eine häufigere Überwachung der Nierenfunktion erwogen werden. Bei Patienten mit einer Kreatinin-Clearance unter 70 ml/min sollte keine Therapie mit Stribild® eingeleitet werden. |
QuelleFachinformation Stribild®, Stand Mai 2013.
Apothekerin Dr. Claudia Bruhn




















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.