
- DAZ.online
- DAZ / AZ
- DAZ 16/2014
- Bedrohung durch Ebola
Infektiologie
Bedrohung durch Ebola?
Extrem ansteckend und keine Impfung oder Therapie in Sicht
Heimtückische Nano-Fäden …
Ebola-Viren wurden 1976 entdeckt und gehören zusammen mit Marburg- und Cueva-Viren zur Familie der Filoviridae, deren Mitglieder eine ca. 970 nm (sogar bis 14.000 nm) lange, filamentöse Struktur mit einem konstanten Durchmesser von 80 nm aufweisen. Das Programm dieser Viren wird von einer 18 bis 19 kb langen Negativ-Strang-RNA kodiert, das heißt die RNA muss in der Wirtszelle erst in eine komplementäre RNA umgeschrieben werden, die dann als mRNA für die Bildung neuer Virus-Proteine dienen kann. Auf der RNA ist die Information für sieben virale Proteine abgelegt: das Nucleoprotein NP, die viralen Proteine VP35 (P), VP40 (M), VP30 sowie VP24, die RNA-Polymerase L und das Glykoprotein GP.
In der Hüllmembran, die von der Wirtszelle stammt, ist nur das Glykoprotein als virales Protein eingelagert, das einerseits für die Bindung des Virus an die Zellen des Wirts verantwortlich ist, andererseits als antigene Determinante und Virulenzfaktor fungiert. Aufgrund der unterschiedlichen Ausprägung des Glykoproteins auf der Oberfläche werden Ebola-Viren in die Arten Bundibugyo (BDBV), Zaire (EBOV), Reston (RESTV), Sudan (SUDV) und Taï Forest (TAFV) eingeteilt. Für die bisher aufgetretenen größeren Ebola-Ausbrüche in Afrika wurden bisher nur BDBV, EBOV und SUDV verantwortlich gemacht, während RESTV und TAFV bisher noch keine nennenswerten Infektionen im Menschen verursacht haben. Bei der jetzigen Endemie in Guinea wurde in den Patienten-Proben EBOV nachgewiesen.
… mit einem interessanten Oberflächenprotein
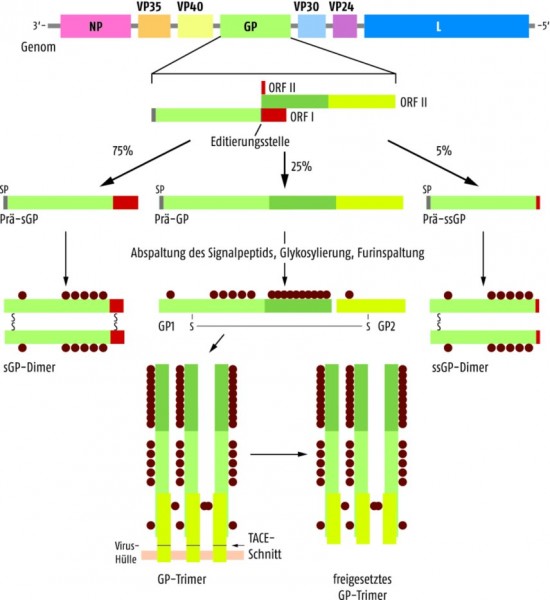
Das Glykoprotein ist in vielerlei Hinsicht bemerkenswert: der GP-Gen-Abschnitt dient als Vorlage für insgesamt vier unterschiedlich lange Proteine, die durch RNA-Editieren und posttranslationale Modifikation gebildet werden (siehe Abb. 1). Nur ca. 25% des Proteins, das vom GP-Gen translatiert wird, ist tatsächlich die membranständige Variante. Zu 70% wird nur der Leserahmen ORF I abgelesen, der dann ein verkürztes, sezerniertes Glykoprotein (sGP) liefert. Dieses sGP wird posttranslational geschnitten und glykosyliert und liegt im Serum des Patienten als Homodimer vor. Wird jedoch während der Transkription in einem Sequenzabschnitt der mRNA mit sieben Adenosinresten noch ein weiteres Adenosin eingefügt, kommt Leserahmen ORF II zum Tragen und es entsteht das komplette Glykoprotein, das nach Glykosylierung und Prozessierung in die Untereinheiten GP1 und GP2 als Homotrimer in die Virusmembran integriert wird. Als weitere, mögliche Proteinvariante kann das membranständige Glykoprotein noch über das Tumornekrosefaktor-α-Converting-Enzym (TACE) geschnitten und somit von der Virus-Oberfläche „abrasiert“ werden. Bei ca. 5% der GP-Translationsdurchgänge werden an der kritischen Oligo-A-Sequenz sogar zwei Nukleotide in die mRNA eingefügt. Daraus resultiert dann im Leserahmen ORF III ein ebenfalls sezerniertes, verkürztes, dimeres ssGP.
Erstaunlicherweise beobachtet man bei einer Virus-Vermehrung in Zellkultur fast nur Virus-Partikel, die kaum GP-Fragmente sezernieren, sondern überwiegend membranständiges Glykoprotein exprimieren. In Patienten sieht das jedoch anders aus. Hier vermehren sich vor allem Virus-Partikel, die relativ viel verkürztes Glykoprotein bilden und sezernieren. Mittlerweile geht man davon aus, dass die löslichen Glykoproteine dazu dienen, die neutralisierenden Antikörper im infizierten Organismus abzufangen – ein Vorgang, der als „antigene Subversion“ bezeichnet wird und mehr ist, als nur eine „passive“ Bindung an die Antikörper. Durch diesen Mechanismus entzieht sich das Virus dem Angriff durch das Immunsystem.
Die Ebola-Infektion
Über die stark glykosylierte GP1-Domäne kann das Ebola-Virus an Lectine auf verschiedenen Zellen binden und sie infizieren. So vermag sich das Virus an Makrophagen und dendritischen Zellen, dann aber auch an Fibroblasten und Endothelzellen in unterschiedlichen Organen anzuheften. Nach dem Anheften an die Wirtszelle wird das Virus über Endozytose aufgenommen. Dabei aktiviert das Ebola-Virus über Proteine der Tyro3/Axl/Mer (TAM)-Familie der Rezeptor-Tyrosin-Kinasen die Phosphoinositid-3-Kinase (PI3K) und bewirkt so seine Internalisierung in die Zelle in Form von Endosomen. Interessanterweise verhindern Inhibitoren der PI3K und nachgeschalteter Enzyme eine Infektion in Zellkulturversuchen, was Hoffnung auf zukünftige Behandlungsmöglichkeiten gibt.
Innerhalb der Endosomen kommt es durch die Protease Cathepsin L zu einer Prozessierung des Glykoproteins, was nach einer Konformationsänderung zur Fusion der viralen Hüllmembran mit der Endosomenmembran führt. Benötigt wird dafür zusätzlich das endosomale/lysosomale Membranprotein Niemann-Pick C1 (NPC1), dessen Inhibition vor einer Infektion durch verschiedene Viren, u.a. auch Ebola-Viren schützen könnte. Auch eine spezifische Hemmung von Cathepsin L verhindert eine Infektion durch Ebola- und auch andere Viren. Vielversprechende kleine Moleküle, die zukünftig eingesetzt werden könnten, wurden bereits über High-Throughput-Screenings identifiziert.
Liegt das Nucleocapsid im Zytoplasma vor, kann die virale RNA-Polymerase das Virus-Genom transkribieren. Virale Proteine werden gebildet und neue Virus-Partikel zusammengebaut. Durch Lyse der Wirtszelle werden die neuen Virionen freigesetzt und können einen neuen Infektionszyklus starten.Nach einer Inkubationszeit von zwei bis 21 Tagen beginnen zunächst eher unspezifische Symptome wie Fieber, Kopf- und Muskelschmerzen, Konjunktivitis, Pharyngitis und Übelkeit. Ab dem 5. bis 7. Krankheitstag treten bei den meisten Patienten Schleimhautblutungen auf – das charakteristische Erscheinungsbild des viralen hämorrhagischen Fiebers. Recht häufig ist eine Oligurie oder Anurie bis hin zum Nierenversagen zu beobachten. Bisher können die Patienten nur symptomatisch behandelt werden. Ribavirin zeigt keine Wirksamkeit bei den Filoviren. Da gerade in den Endemiegebieten oftmals keine ausreichende Möglichkeit zur intensivmedizinischen Betreuung vorhanden sind, ist die Letalität mit 50 bis 90% äußerst hoch. Ein Impfstoff gegen das Ebola-Virus existiert bisher nicht.
Wie groß ist die Ansteckungsgefahr?
Als natürliches Reservoir der Viren werden Flughunde, aber auch Primaten und Nagetiere vermutet. Durch Kontakt mit Exkrementen oder Körperflüssigkeiten infizierter Tiere können die Viren auch auf den Menschen übertragen werden. Anschließend ist die Ansteckungsgefahr bei direktem Kontakt mit Körperflüssigkeiten eines Erkrankten recht groß. Bis zu 61 Tage nach Überstehen einer Erkrankung können Viren im Blut und Speichel nachgewiesen werden, so dass in diesem Zeitraum immer noch ein erhöhtes Infektionsrisiko, beispielsweise auch bei Sexualkontakt, besteht. Ein besonderes Risiko besteht für Pflegepersonal, vor allem dann, wenn es sich in den Anfangsphasen der Infektion nicht über die Möglichkeit einer Ebola-Virusinfekton bewusst ist und ohne entsprechende Schutzmaßnahmen die Kranken versorgt. Auch diejenigen Personen, die die Verstorbenen für die Bestattung vorbereiten, haben ein erhöhtes Ansteckungsrisiko. Die wichtigsten Maßnahmen sind deshalb eine Isolierung der Infizierten und besondere Schutzvorkehrungen für Kontaktpersonen.
Besteht eine Gefahr für Europa?
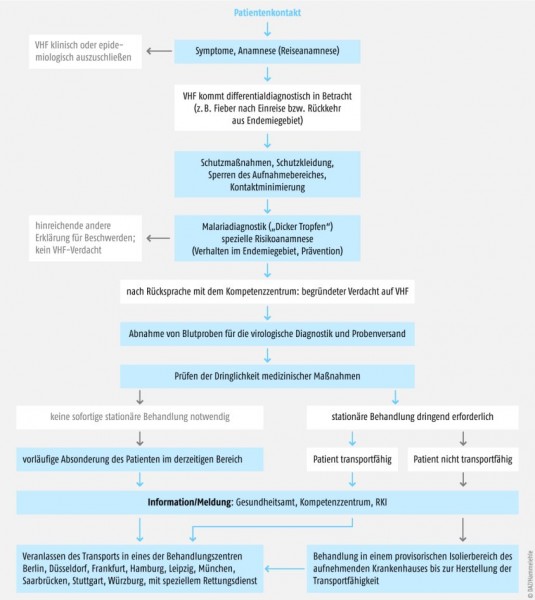
Bisher empfiehlt die WHO weder ein Reise- noch ein Handelsverbot für Guinea. Solange Afrika-Reisende in der betroffenen Region nicht mit Körperflüssigkeiten von infizierten Menschen oder Tieren in Kontakt kommen, besteht keinerlei Ansteckungsgefahr. Sollte es allerdings zu einer entsprechenden Exposition gekommen sein, sollten die Betroffenen sehr aufmerksam bezüglich erster Anzeichen einer Infektion beobachtet werden. Gerade weil die ersten Symptome der Erkrankung eher unspezifisch sind, dürfen sie nicht übersehen werden. Allerdings muss eine andere Ursache für diese Symptome wie z.B. Malaria, Typhus abdominalis, Rickettsiosen oder andere Auslöser eines viral hämorrhagischen Fiebers (z.B. Lassa-Virus, Hanta-Virus, Krim-Kongo-Virus, Dengue-Virus) ausgeschlossen werden (siehe Abb. 2).
Für den Fall, dass ein Mitreisender im Flugzeug mit Ebola-Viren infiziert war, empfiehlt das European Center for Disease Prevention and Control die für den Bereich des entsprechenden Sitzplatzes zuständigen Crewmitglieder, Reinigungspersonal sowie die unmittelbar benachbart sitzenden Passagiere (+/- 1 Sitzplatz) nur dann genauer zu beobachten, wenn bereits während des Fluges Symptome aufgetreten sind oder innerhalb von 21 Tagen nach dem Flug die Infektion bestätigt werden konnte. Bislang ist allerdings noch nie ein derartiger Fall aufgetreten.
Die sichere Diagnose einer Ebola-Virusinfektion kann nur über den labordiagnostischen Nachweis der Viren in einem Speziallabor der biologischen Sicherheitsstufe 4 erfolgen. In Deutschland gibt es zwei entsprechende Diagnostiklabore an der Philipps-Universität Marburg und am Bernhard-Nocht-Institut in Hamburg. Aus dem Blut können die Viren während der akuten Krankheitsphase mittels PCR, Virus-Anzucht oder elektronenmikroskopischer Untersuchungen, oder über den Nachweis von spezifischen Antikörpern (IgM, IgG) mittels Immunfluoreszenz (IF), ELISA, Neutralisationstest (NT) bestimmt werden. Da gerade über das Blut eines Infizierten eine hohe Ansteckungsgefahr besteht, muss einerseits natürlich die Abnahme der Probe unter entsprechenden Sicherheitsvorkehrungen durchgeführt werden, und andererseits muss auch die Probe gesichert versendet werden. Vor dem Versand der Proben muss das Diagnostiklabor kontaktiert werden, um die Proben anzumelden und die Versandmodalitäten abzustimmen. Durch das Europäische Übereinkommen zur internationalen Beförderung gefährlicher Güter auf der Straße (ADR) ist auch der Versand von Ebola-Diagnostik- oder -Verdachtsproben geregelt und erfolgt als Gefahrengut Klasse 6.2 Kategorie A („ansteckungsgefährlicher Stoff, der in einer solchen Form befördert wird, dass er bei einer Exposition bei sonst gesunden Menschen oder Tieren eine dauerhafte Behinderung oder eine lebensbedrohende oder tödliche Krankheit hervorrufen kann“) mit der Kennzeichnung UN2814.
Fazit
Eine Infektion mit Ebola-Viren ist eine sehr ernst zu nehmende Erkrankung. Leider gibt es bisher nur die Möglichkeit einer symptomatischen Behandlung. Die derzeitige Ebola-Endemie in Guinea muss genau beobachtet und eine weitere Ausbreitung durch geeignete Schutz- und Quarantänemaßnahmen – auch unter Mithilfe entsprechender Spezialisten der WHO – möglichst unterbunden werden. Die Gefahr, dass Ebola-Viren auch in andere Länder und nach Europa kommen, besteht, ist aber derzeit recht gering.
Quelle
Cook JD, Lee JE. The Secret Life of Viral Entry Glycoproteins: Moonlighting in Immune Evasion. PLoS Pathogens (2013) 9; e1003258.
Mohan GS et al. Antigenic Subversion: A Novel Mechanism of Host Immune Evasion by Ebola Virus. PLoS Pathogens (2012) 8; e1003065.
Elshabrawy HA et al. Identification of a Broad-Spectrum Antiviral Small Molecule against Severe Acute Respiratory Syndrome Coronavirus and Ebola, Hendra, and Nipah Viruses by Using a Novel High-Throughput Screening Assay. J. Virol. (2014) 88; 4353–4365.
Hofmann-Winkler H et al. Host Cell Factors in Filovirus Entry: Novel Players, New Insights. Viruses (2012) 4; 3336–3362.
Hunt CL et al. Filovirus Entry: A Novelty in the Viral Fusion World. Viruses (2012) 4; 258–275.
Rapid Risk Assessment – Outbreak of Ebola haemorrhagic fever in Guinea. http://ecdc.europa.eu
Risk assessment guidelines for diseases transmitted on aircraft – PART 2: Operational guidelines for assisting in the evaluation of risk for transmission by disease. http://ecdc.europa.eu
Übersicht Ebola-Fieber / Marburg-Fieber. Informationen des Robert Koch-Instituts, www.rki.de
Informationen zu Ebola in Guinea. Informationen des Robert Koch-Instituts, www.rki.de
Ebola virus disease: background and summary. www.who.int
West Africa - Ebola virus disease. www.who.int






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.