
- DAZ.online
- DAZ / AZ
- DAZ 22/2014
- Wenn sich alles dreht
Medizin
Wenn sich alles dreht
Diagnose und Therapie von Schwindelsyndromen
Der benigne periphere paroxysmale Lagerungsschwindel (BPPV) ist mit knapp 17,1% die häufigste Ursache vor dem phobischen Schwankschwindel (15,0%), gefolgt von der Gruppe zentraler vestibulärer Schwindelsyndrome, überwiegend bei vaskulären, entzündlichen (multiple Sklerose) und degenerativen Erkrankungen des Hirnstamms oder Kleinhirns (12,3%). Die vestibuläre Migräne ist mit 11,4% die häufigste Ursache spontan auftretender episodischer Schwindelattacken. Weitere häufige Diagnosen sind Morbus Menière (10,1%) und Neuritis vestibularis (8,3%). Zusammen machen diese sechs Erkrankungen etwa 70% aller Schwindelsyndrome aus.
Grundvoraussetzung jeder Behandlung beim Leitsymptom Schwindel ist eine korrekte Diagnose. Die Behandlung der verschiedenen Schwindelsyndrome umfasst medikamentöse, physikalische, operative und psychotherapeutische Maßnahmen (Übersicht in [2, 14, 33]). Die verschiedenen Pharmakagruppen lassen sich mit den „acht As“ zusammenfassen: Antivertiginosa, Antikonvulsiva, Antidepressiva, Antiphlogistica, Antimenière, Antimigränosa, Aminopyridine als Kaliumkanalblocker sowie Acetyl-DL-Leucin als neues Therapieprinzip. Antivertiginosa sind nur zur kurzzeitigen symptomatischen Behandlung indiziert. Sie sollen nur zur rein symptomatischen Behandlung eingesetzt und nicht länger als drei Tage gegeben werden, da sie die sogenannte zentrale vestibuläre Kompensation verlangsamen und Suchtpotenzial besitzen. Eine Übersicht über die Wirkstoffe, die zur kausalen Therapie der einzelnen Schwindel- und Nystagmusformen gegeben werden, zeigt Tabelle 1.
Im Folgenden werden die häufigsten Schwindelsyndrome und deren aktuelle Therapie dargestellt. Es wird auch auf die Behandlung von Kleinhirnerkrankungen, die mit Schwindel, Scheinbewegungen der Umgebung (sog. Oscillopsien) oder Nystagmus einhergehen, eingegangen, da es hier neue Therapieoptionen gibt. Abschließend werden auch Perspektiven mit derzeit durchgeführten klinischen Studien aufgezeigt.
Wie sieht die aktuelle Behandlungssituation von Patienten mit Schwindel aus?
Trotz der o.g. Fortschritte in der Pharmakotherapie sieht die Behandlung von Patienten mit Schwindel heute leider häufig immer noch anders aus: Es werden meist unwirksame Substanzen und zwar gleich in hoher Zahl und in Kombination verordnet (Tabelle 2). Hier ist zu betonen, dass Ginkgo biloba, HAES, Pentoxyfillin oder homöopathische Ansätze nicht wirksam sind. Darüber hinaus verzögern solche „Behandlungsstrategien“ die korrekte Diagnosestellung und die Einleitung einer wirklich wirksamen Behandlung und verlängern so auch noch das Leiden der Betroffenen.
Was sind die Gründe für diese Fehl- und Überversorgung der Patienten? Erstens, in vielen Fällen bleibt die Diagnose unklar, obwohl sich heute in 90% der Fälle nach sorgfältiger Erhebung der Anamnese und körperlichen Untersuchung eine korrekte Diagnose stellen lässt. Nach einer aktuellen Studie, die auf Daten der Kassenärztlichen Vereinigung Bayern beruht, war z.B. die häufigste Diagnose bei Patientinnen ein sogenannter postmenopausaler Schwindel, den es unserer Auffassung nach gar nicht gibt [24]. Zweitens wird oft eine symptomatische Behandlung versucht, ohne dass diese wirksam ist. Zudem ist sie auch noch mit hohen Kosten verbunden ist (Tabelle 2).
!Ergo: Erst die korrekte Diagnose stellen und dann den Patienten spezifisch behandeln mit regelmäßigen Kontrollen der Verträglichkeit und Wirksamkeit der Therapie.
Die häufigsten Schwindelsyndrome und deren spezifische Therapie
Peripherer vestibulärer Schwindel
Dieser geht vom Gleichgewichtsorgan oder dem Gleichgewichtsnerv aus. Funktionell lassen sich drei Formen peripherer vestibulärer Störungen mit typischen Symptomen und klinischen Zeichen differenzieren:
- der chronische beidseitige Ausfall des Nervus vestibularis bzw. der Vestibularorgane (bilaterale Vestibulopathie),
- der akute einseitige Ausfall (akute Neuritis vestibularis),
- paroxysmale pathologische Erregung oder Hemmung des Nervus vestibularis bzw. der Vestibularorgane (z.B. Benigner peripherer paroxysmaler Lagerungsschwindel (BPPV), Morbus Menière, Vestibularisparoxysmie).
Im Folgenden sollen Anamnese, Befund und aktuelle Therapie der fünf häufigsten peripher vestibulären Schwindelformen dargestellt werden.
Benigner peripherer paroxysmaler Lagerungsschwindel (BPPV)
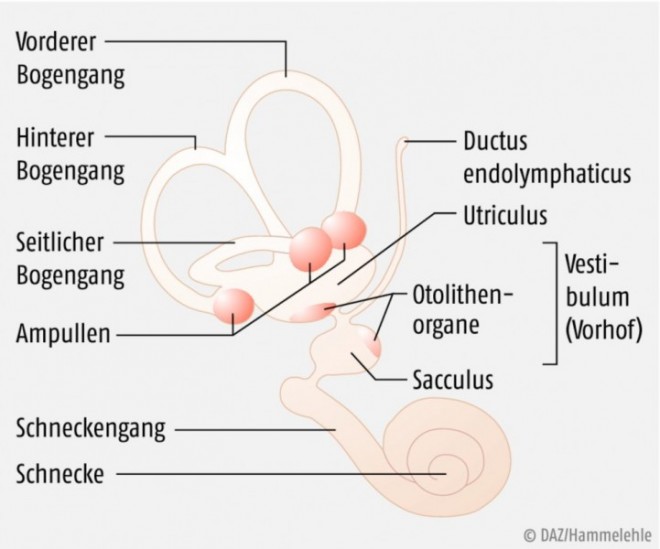
Der benigne periphere paroxysmale Lagerungsschwindel entsteht in den meisten Fällen durch eine sogenannte Kanalolithiasis, das heißt sich frei in einem Bogengang bewegende, von der Macula utriculi (ein kleines neuroepitheliales Gewebefeld im Utriculus; s. Abb. 1) stammende Otokonien (mikroskopisch kleine Körnchen aus Calciumcarbonat sowie organischen Komponenten).
Leitsymptom sind Sekunden dauernde, zum Teil heftige Drehschwindelattacken, die durch Kopf- oder Körperlageänderung gegenüber der Schwerkraft (Umdrehen oder Aufrichten im Bett, Hinlegen oder Bücken) ausgelöst werden. Der benigne periphere paroxysmale Lagerungsschwindel kann von der Kindheit bis zum Senium auftreten; die jährliche Inzidenz nimmt mit dem Lebensalter zu. In 95% der Fälle bleibt die Ätiologie unklar. Die häufigsten Ursachen sind Schädelhirntraumen, Zustand nach Neuritis vestibularis („postinfektiöser BPPV“: bei 15% aller Patienten mit Neuritis vestibularis Wochen nach der akuten Entzündung) und längere Bettlägerigkeit. Ferner besteht ein Zusammenhang mit Morbus Menière und vestibulärer Migräne. Schließlich wurden beim „idiopathischen benignen peripheren paroxysmalen Lagerungsschwindel“ relativ häufiger eine Osteopenie, Osteoporose und/oder erniedrigte Vitamin-D-Serumkonzentrationen beschrieben [16]. Etwa 90% aller Fälle gehen vom posterioren Bogengang, 10% vom horizontalen Bogengang aus. Diagnostisch beweisend ist bei diesem Subtyp ein nach Kopflagerung in der Ebene des betroffenen Bogengangs zum unten liegenden Ohr rotierende und zur Stirn schlagende erschöpfliche Lagerungsnystagmus.
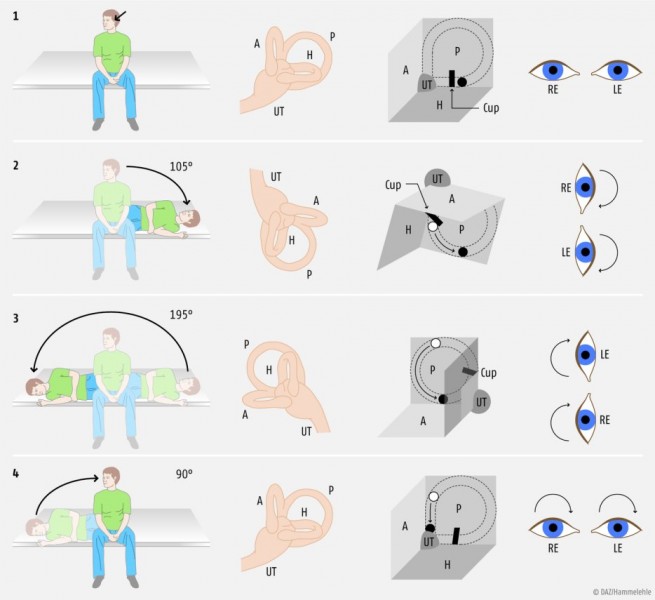
Therapie. Therapie der Wahl sind die sog. Befreiungsmanöver. Die Erfolgsraten der Befreiungsmanöver nach Semont (Abb. 2) oder der sog. Repositionsmanöver nach Epley liegen nach mehrmaliger Behandlung bei über 95% (Übersicht in [2]). Bei starker Übelkeit sollten 30 Minuten vor Beginn der Befreiungsmanöver Antivertiginosa (z.B. Dimenhydrinat, Tab. 1) verabreicht werden. Die meisten Patienten können nach sorgfältiger Anleitung durch Demonstration und Bildmaterial die Befreiungsmanöver auch allein erfolgreich zu Hause als Selbstbehandlung durchführen (Frequenz und Dauer der therapeutischen Manöver: dreimal morgens, dreimal mittags, dreimal abends über meist drei Tage); dabei ist insbesondere auf eine korrekte Kopfhaltung zu achten. Die klinische Erfahrung zeigt, dass die Patienten meist erst nach einigen Tagen beschwerdefrei werden. Anschließend kommt es durch die Reposition der Otokonien auf den Utriculus [4] zu einem über viele Tage anhaltenden Schwankschwindel im Sinne eines Otolithenschwindels; über diese zu erwartende Komplikation sollten die Patienten aufgeklärt werden.
Neuritis vestibularis
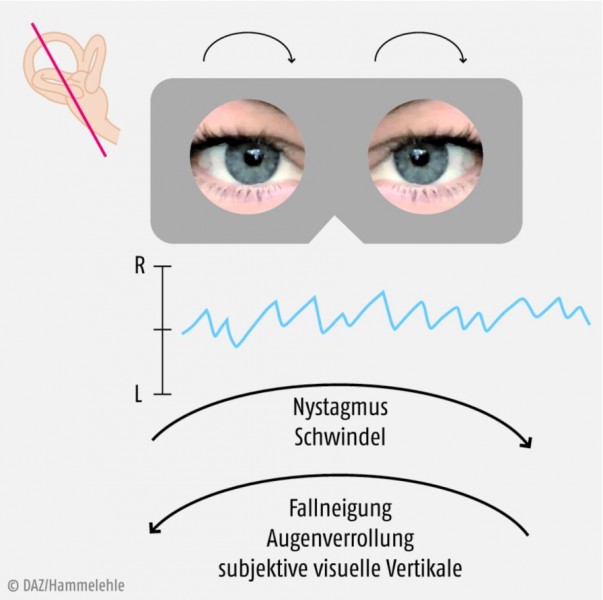
Die Neuritis vestibularis entsteht wahrscheinlich durch Reaktivierung einer latenten Virusinfektion des Vestibularganglions mit Herpes-simplex-Virus Typ I, die zu einem inkompletten einseitigen rein vestibulären Labyrinthausfall führt. Hauptsymptome sind ein akut einsetzender, über viele Tage anhaltender heftiger Drehschwindel mit Scheinbewegungen der Umgebung (Oszillopsien) und Übelkeit, ein horizontal rotierender Spontannystagmus zur nicht-betroffenen Seite sowie eine Gangabweichung und Fallneigung zur betroffenen Seite (Abb. 3). Der Kopfimpulstest zeigt eine Funktionsstörung des vestibulo-okulären Reflexes bei Drehung zum betroffenen Ohr; die kalorische Prüfung bestätigt die Unter- oder Unerregbarkeit des horizontalen Bogengangs.
Therapie. Bei schwerer Übelkeit und Brechreiz können innerhalb der ersten Tage zur symptomatischen Therapie Antivertiginosa verabreicht werden, die jedoch bei längerer Gabe die zentrale Kompensation des peripheren Vestibularisausfalls verzögern. Eine prospektive, randomisierte, placebokontrollierte Studie mit 141 Patienten zeigte, dass eine Monotherapie mit Methylprednisolon zu einer signifikanten Verbesserung der Erholung der peripheren vestibulären Funktion führte [35]. Diese Befunde wurden durch eine weitere Studie bestätigt [17]. In einer Cochrane-Analyse wird dieser Trend einen Monat nach Erkrankung zwar auch gesehen, allerdings aus Mangel an einer ausreichenden Zahl von Studien dazu keine allgemeine Behandlungsempfehlung für Corticosteroide gegeben [10]. Die Wirksamkeit einer Physiotherapie mit dynamischen Übungen zur Gleichgewichtsregulation und Blickstabilisation zur Verbesserung der zentralen vestibulo-spinalen Kompensation ist durch eine prospektive, randomisierte, kontrollierte klinische Studie [28] und eine Cochrane-Analyse [12] belegt. Es liegen bislang keine entsprechenden klinischen Studien zur Verbesserung der zentralen Kompensation durch Medikamente vor; derzeit wird eine vom BMBF (Bundesministerium für Bildung und Forschung) geförderte Studie zur Untersuchung des Effektes von Betahistin auf die zentrale Kompensation durchgeführt (BETAVEST).
Morbus Menière
Die typischen Attacken des Morbus Menière sind durch rezidivierenden, Minuten bis Stunden anhaltenden Drehschwindel mit einseitiger Hörminderung, Tinnitus und Ohrdruckgefühl gekennzeichnet. Gelegentlich gehen eine Verstärkung des Ohrgeräuschs, des Ohrdrucks oder eine Hörminderung dem Schwindel voraus. Ätiologie und Pathophysiologie des Morbus Menière sind trotz vieler Untersuchungen bislang nicht sicher geklärt. Der pathognomonische histopathologische Befund ist ein Endolymphhydrops, d.h. eine Aufweitung des Endolymphschlauchs. Die Attacken entstehen wahrscheinlich durch eine Öffnung drucksensitiver Kationenkanäle und/oder die Ruptur der Endolymphmembran mit einer Erhöhung der Kaliumkonzentration im Perilymphraum, was zunächst zu einer Erregung, dann zu einer Depolarisation der Axone führt.
Therapie. Schwindel, Übelkeit und Erbrechen können akut symptomatisch mit Antivertiginosa (Tab. 1) gemindert werden. Positive Effekte einer prophylaktischen Therapie zur Reduzierung der Attackenfrequenz wurden bislang für die transtympanale Instillation von Gentamicin und von Steroiden sowie die hoch dosierte, lang dauernde Gabe von Betahistin publiziert (Übersicht in [2, 33]). Die Wirkung von Gentamicin beruht auf einer direkten Schädigung von vestibulären Typ-I-Haarzellen. Es liegen zwei prospektive, doppelblinde, randomisierte, kontrollierte Studien vor, die eine Wirksamkeit gezeigt haben [22, 27] und die durch eine Cochrane-Analyse gestützt werden [23]. Die Gefahr der Behandlung mit Aminoglykosiden liegt in der möglichen Hörschädigung. Die transtympanale Gabe von Glucocorticoiden wird vermehrt durchgeführt, obwohl bislang nur eine methodisch einwandfrei durchgeführte klinische Studie vorliegt, die einen positiven Effekt gezeigt hat [11]. Darüber hinaus konnte in einer randomisierten kontrollierten prospektiven Studie gezeigt werden, dass bei schwer behandelbaren Attacken die Gabe von kleinen Dosen Gentamicin intratympanal mit 93% eine deutlich bessere Reduktion der Schwindelattacken bewirkt als die intratympanale Dexamethason-Gabe mit 61% [5].
Metaanalysen belegen, dass Betahistin – ein schwacher H1-Agonist und stärkerer H3-Antagonist – einen prophylaktischen Effekt auf die Attackenfrequenz des Morbus Menière hat. In einer Anwendungsbeobachtung bei 112 Patienten konnte nachgewiesen werden, dass eine Höherdosierung mit dreimal 48 mg/d Betahistin vor allem bei Langzeitanwendung über ein Jahr der üblichen Dosierung von dreimal 24 mg/d signifikant überlegen ist [29]. In Einzelfällen erfolgte auch eine allmähliche Dosissteigerung bis auf 480 mg/d [20] oder gar 1200 mg/d.
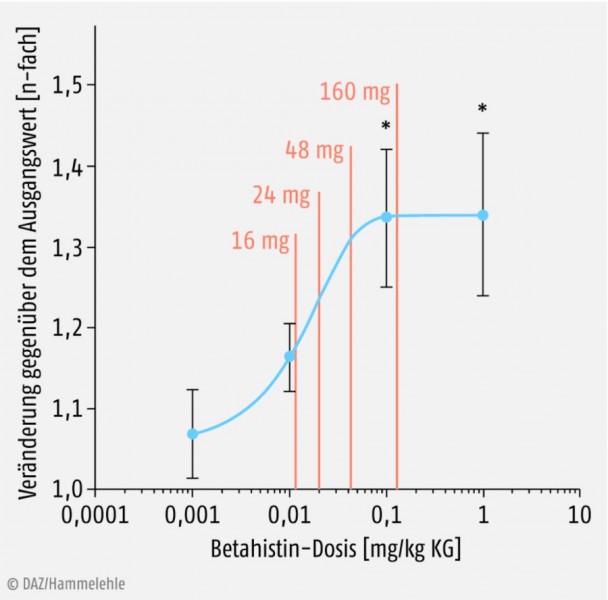
Als Wirkmechanismus wird auf der Basis aktueller tierexperimenteller Studien eine dosisabhängige Verbesserung der Durchblutung des Innenohrs angenommen (Abb. 4) [15]. Derzeit wird eine prospektive randomisierte placebokontrollierte multizentrische Dosisfindungsstudie zur Untersuchung des prophylaktischen Effekts von Betahistin-Dihydrochlorid auf die Attackenfrequenz und die vestibuläre und audiologische Funktion durchgeführt (BEMED, gefördert durch das BMBF).
Vestibularisparoxysmie
Analog der Trigeminus-Neuralgie entsteht die Vestibularisparoxysmie wahrscheinlich durch hirnstammnahe neurovaskuläre Kompression des VIII. Hirnnervs [1, 34] durch ephaptische Fehlschlüsse teilweise demyelinisierter Axone. Typisch für die Vestibularisparoxysmie sind kurze, Sekunden bis wenige Minuten dauernde Dreh- oder selten Schwankschwindelattacken mit oder ohne Ohrsymptome (Tinnitus und Hörminderung), die sich häufig durch längere Hyperventilation provozieren lassen [1, 13]. Bei Verdacht lässt sich durch die hoch auflösende MRT des Hirnstamms mit CISS-Sequenz in über 95% ein Gefäß-Nerv-Kontakt im Austrittsbereich des VIII. Hirnnervs nachweisen [13, 34]; bei gesunden Kontrollen findet sich dieser in etwa 60%, so dass diese Untersuchung nicht spezifisch ist.
Therapie. Bei mehr als zwei Attacken pro Monat ist ein Therapieversuch mit Carbamazepin in niedriger Dosis von 200 bis 600 mg/d sinnvoll und auch diagnostisch verwertbar [44, 46]. Bei Unverträglichkeit stehen alternativ Phenytoin oder Valproinsäure zur Verfügung. Bislang liegen aber für keine dieser Substanzen prospektive randomisierte kontrollierte Studien vor.
Zentrale vestibuläre Syndrome
Zentrale vestibuläre Syndrome entstehen überwiegend durch Läsionen der vestibulären Bahnen, die von den Vestibulariskernen im kaudalen Hirnstamm sowohl zum Cerebellum als auch zum Thalamus und vestibulären Kortex ziehen. Weitere Ursachen können eine Schädigung des Kleinhirns oder in seltenen Fällen eine pathologische Erregung sein. In Bezug auf die Ätiologie stehen im Vordergrund: Infarkt, Blutung, Tumor, multiple Sklerose oder degenerative Hirnerkrankungen. Hier richtet sich die Therapie nach der Grunderkrankung, die nicht Gegenstand dieser Arbeit ist.
Zentrale vestibuläre Störungen im Rahmen bestimmter Okulomotorikstörungen wie des Downbeat- und Upbeatnystagmus treten in Form von Attacken bei der Episodischen Ataxie Typ 2 sowie bei der häufigen vestibulären Migräne auf. Deren aktuelle Therapien sollen hier dargestellt werden.
Vestibuläre Migräne
Die häufige vestibuläre Migräne ist in Bezug auf die Attackenfrequenz und -dauer (meist Minuten bis eine Stunde, aber auch bis zu Tagen) sowie die Symptome in Form von Dreh- oder Schwankschwindelattacken mit und ohne Kopfschmerz und vestibulären und/oder okulomotorischen Störungen das Chamäleon unter den episodischen Schwindelformen. Bei der vestibulären Migräne überwiegen Schwindelattacken [19]. Die Diagnose ist einfach, wenn die Attacken von Kopfschmerz gefolgt sind oder eine positive Familien- oder Eigenanamnese für andere Migräneformen bestehen. Die Diagnose ist schwieriger, wenn Kopfschmerzen und andere Migränesymptome fehlen (bei ca. 30% der Betroffenen [8]). Es ist eine diagnostische Hilfe, dass bei mehr als 60% der Patienten mit vestibulärer Migräne auch im attackenfreien Intervall leichte zentrale Augenbewegungsstörungen wie Blickrichtungsnystagmus, sakkadierte Blickfolge oder ein zentraler Lagenystagmus vorliegen. Während einer Attacke werden oft eine Stand- und Gangunsicherheit mit pathologischem Nystagmus und Lagenystagmus beobachtet, die entweder einer zentralen oder peripheren vestibulären Dysfunktion zugeordnet werden können.
Therapie. Bislang fehlen prospektive kontrollierte Therapiestudien. Trotzdem wurden in Analogie zur Behandlung der Migräne ohne Aura die gleichen Prinzipien angewendet, die sich bislang in der Behandlung der Attacken und für die Migräneprophylaxe bewährt haben. Mittel der ersten Wahl bei der Migräneprophylaxe ist die Gabe von Betablockern (z.B. Metoprololsuccinat 50 bis 100 (200) mg/d) für die Dauer von sechs Monaten. Alternativen sind Topiramat oder Valproinsäure, für die bislang auch nur Anwendungsbeobachtungen mit kleineren Fallzahlen vorliegen. Derzeit findet eine prospektive randomisierte placebokontrollierte multizentrische Studie zur Untersuchung des prophylaktischen Effekts von Metoprolol auf die Attackenfrequenz statt (PROVEMIG, gefördert durch das BMBF).
Cerebelläre Ataxien: Aminopyridine, Acetyl-DL-Leucin und Chlorzoxazone
Cerebelläre Ataxien sind durch Störungen der Extremitätenmotorik, des Sprechens, der Okulomotorik sowie des Gehens und Stehens gekennzeichnet. In der Mehrzahl handelt es sich um chronisch progrediente neurodegenerative Erkrankungen entweder hereditär oder sporadisch. Cerebelläre Ataxien führen im Krankheitsverlauf meist zu erheblichen Beeinträchtigungen der Funktionsfähigkeit und Lebensqualität. Die Prävalenz liegt bei etwa 20/100.000 [18]. Nüchtern oder ernüchtert betrachtet, gab es bislang keine wirklich wirksame symptomatische oder gar kausale Pharmakotherapie cerebellärer Ataxien. Einzige Behandlungsmaßnahme war intensive Physiotherapie. Zur symptomatischen Behandlung cerebellärer Ataxien gibt es aber neue pharmakologische Ansätze:
- Kaliumkanalblocker: 4-Aminopyridin,
- Aktivator von Calcium-aktivierten Kaliumkanälen: Chlorzoxazone und
- modifizierte Aminosäure, die sich in die Zellmembran einlagert: Acetyl-DL-Leucin.
Pharmakotherapiestudien bei Schwindelsyndromen
Derzeit am Deutschen Schwindelzentrum durchgeführte prospektive placebokontrollierte Pharmakotherapiestudien bei verschiedenen Schwindelsyndromen. Es handelt sich jeweils um „investigator initiated trials“ (IITs).
Periphere vestibuläre Syndrome
1) Vestibularisparoxysmie Carbamazepin vs. Placebo
2) Neuritis vestibularis Betahistin (144 mg/d vs. Placebo)
BETAVEST (zentr. Kompensation)
3) M. Menière Betahistin
(48 mg/d vs. 144 mg/d vs. Placebo)
BEMED („last patient out“: 23.11.2013!)
4) BPPV Vitamin D vs. Placebo
Zentrale vestibuläre Syndrome
5) episodische Ataxie 2 Fampyra vs. Acetazolamid
vs. Placebo EAT-2-TREAT
6) vestibuläre Migräne Beloc-Zok (95 mg/d vs. Placebo)
PROVEMIG
7) cerebelläre Gangstörungen Fampyra vs. Placebo
FACEG
1–6 Gefördert vom Bundesministerium für Bildung und Forschung (BMBF)
Aminopyridine (Kaliumkanalblocker) bei Episodischer Ataxie Typ 2, Downbeat-Nystagmus und cerebellärer Gangataxie
Die episodischen Ataxien sind autosomal dominante Erkrankungen mit mindestens sieben verschiedenen Typen. Die häufigste Form ist die episodische Ataxie Typ 2 (EA 2), die durch rezidivierende, meist Stunden anhaltende Attacken mit Schwindel und Ataxie gekennzeichnet ist. Diese werden durch körperliche Aktivität, Stress oder Alkohol ausgelöst. Im Intervall finden sich bei über 90% der Patienten deutliche zentrale Okulomotorikstörungen, im Besonderen ein Downbeat-Nystagmus. Ursache der Episodischen AtaxieTyp 2 sind Mutationen im sog. CACNA1A-Gen des PQ-Calciums.
Die Wirksamkeit von 4-Aminopyridin ist in einer prospektiven randomisierten placebokontrollierten Studie nachgewiesen worden: In einer Dosierung von dreimal 5 mg pro Tag führt dieser Kaliumkanalblocker zu einer signifikanten Abnahme der Attackenfrequenz und Verbesserung der Lebensqualität [30]. Die niedrige Dosierung wurde von den Patienten gut vertragen; wichtigste Kontraindikation ist eine verlängerte QT-Zeit. Als Wirkmechanismus wird eine Normalisierung der irregulären Entladung cerebellärer Purkinjezellen postuliert. Die Retardform des 4-Aminopyridin ist ebenfalls gut wirksam und verträglich [7] und wird derzeit in einer placebokontrollierten Studie (auch im Vergleich zu Acetazolamid) untersucht (EAT-2-TREAT).
Die häufigste Nystagmusform ist der Downbeat-Nystagmus, der meist auf einer Funktionsstörung des Flocculus beruht. Leitsymptom sind Schwankschwindel, Gangunsicherheit und unscharfes Sehen (Oszillopsien). Bereits 2003 wurde gezeigt, dass 3,4-Diaminopyridin zu einer signifikanten Abnahme der Intensität des Downbeat-Nystagmus führt [31]. In einer aktuellen placebokontrollierten Studie ließ sich ein positiver Effekt auf die Intensität und posturale Stabilität nachweisen [6]. Auch hier ist die Retardform wirksam. Wirkmechanismus ist wahrscheinlich eine erhöhte Freisetzung von GABA und damit eine Hemmung vestibulärer Neurone.
Schließlich wurden die Effekte von 4-Aminopyridin bei cerebellären Gangstörungen unterschiedlicher Ätiologie mittels differenzierter Ganganalyse untersucht. 4-Aminopyridin führte zu einer signifikanten Abnahme der Gangvariabilität und damit der Sturzgefahr [25]; diese Befunde werden derzeit im Rahmen einer placebokontrollierten Studie (FACET) näher untersucht.
Chlorzoxazone bei Downbeat-Nystagmus
Chlorzoxazone ist ein unspezifischer Aktivator bestimmter Calcium-aktivierter Kaliumkanäle. Diese Substanz wird in den USA „over the counter“ zur Behandlung von Muskelkrämpfen eingesetzt. In Tiermodellen der Episodischen Ataxie Typ 2 (sog. „Tottering mouse“) war ein positiver Effekt auf die Attackenfrequenz gefunden worden. Auf der Basis dieser Daten wurde die Substanz bei Patienten mit cerebellärem Downbeat-Nystagmus untersucht. Chlorzoxazone (3 x 500 mg pro Tag) führte zu einer signifikanten Abnahme der Intensität und Verbesserung der Standregulation [9]. Dieses Medikament ist eine Alternative zum 4-Aminopyridin, insbesondere wenn bei Patienten Herzrhythmusstörungen vorliegen.
Acetyl-DL-Leucin bei cerebellärer Ataxie
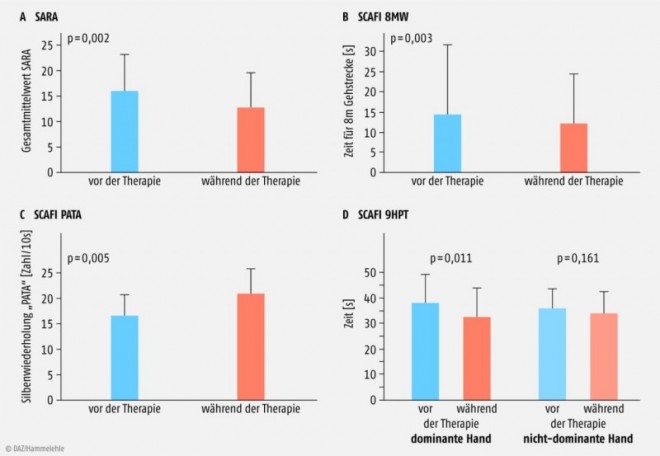
Seit 1957 wird die modifizierte Aminosäure Acetyl-DL-Leucin in Frankreich zur symptomatischen Behandlung von Schwindel eingesetzt. Basierend auf Einzelbeobachtungen wurde die Wirkung dieses Präparates in einer Dosierung von 5 g pro Tag bei 13 Patienten mit cerebellärer Ataxie unterschiedlicher Ätiologie gegeben. Nach einer Woche fand sich eine signifikante und klinisch relevante Verbesserung in allen eingesetzten Ataxie-Scores (sog. SARA und SCAFI; Abb. 5); parallel dazu verbesserte sich die Lebensqualität [32]. Das Medikament wurde sehr gut vertragen. Es wird postuliert, dass diese Substanz offensichtlich durch Einlagerung in die Zellmembran und Interaktion mit Phospholipiden zu einer Normalisierung des Membranpotenzials führt. Diese Befunde müssen erst in einer placebokontrollierten multizentrischen Studie bestätigt werden.
Perspektiven
Für eine Reihe vestibulärer und cerebellärer Erkrankungen (z.B. Morbus Menière, Vestibularisparoxysmie, vestibuläre Migräne, episodische Ataxie Typ 2) fehlen immer noch prospektive placebokontrollierte Studien. Aus diesem Grunde werden derzeit am Deutschen Schwindelzentrum die im Kasten dargestellten Studien „investigator initiated trials“ (IITs) durchgeführt, die vom Bundesministerium für Bildung und Forschung (BMBF) unterstützt werden. Schon für die nähere Zukunft sind damit wesentliche Fortschritte bei der Pharmakotherapie von Schwindelsyndromen zu erwarten.
Literatur
[1] Brandt T, Dieterich M (1994) Vestibular paroxysmia: vascular compression of the eighth nerve? Lancet 343:798-799
[2]Brandt T, Dieterich M, Strupp M (2012) Vertigo - Leitsymptom Schwindel. Springer Medizin, Heidelberg
[3] Brandt T, Steddin S, Daroff RB (1994) Therapy for benign paroxysmal positioning vertigo, revisited. Neurology 44:796-800
[4] Bremova T, Bayer O, Agrawal Y, Kremmyda O, Brandt T, Teufel J, Strupp M (2013) Ocular VEMPs indicate repositioning of otoconia to the utricle after successful liberatory maneuvers in benign paroxysmal positioning vertigo. Acta Otolaryngol 133:1297-1303
[5] Casani AP, Piaggi P, Cerchiai N, Seccia V, Franceschini SS, Dallan I (2012) Intratympanic treatment of intractable unilateral Meniere disease: gentamicin or dexamethasone? A randomized controlled trial. Otolaryngol Head Neck Surg 146:430-437
[6] Claassen J, Spiegel R, Kalla R, Faldon M, Kennard C, Danchaivijitr C, Bardins S, Rettinger N, Schneider E, Brandt T, Jahn K, Teufel J, Strupp M, Bronstein A (2013) A randomised double-blind, cross-over trial of 4-aminopyridine for downbeat nystagmus--effects on slowphase eye velocity, postural stability, locomotion and symptoms. J Neurol Neurosurg Psychiatry 84:1392-1399
[7] Claassen J, Teufel J, Kalla R, Spiegel R, Strupp M (2013) Effects of dalfampridine on attacks in patients with episodic ataxia type 2: an observational study. J Neurol 260:668-669
[8] Dieterich M, Brandt T (1999) Episodic vertigo related to migraine (90 cases): vestibular migraine? J Neurol 246:883-892
[9] Feil K, Claassen J, Bardins S, Teufel J, Krafczyk S, Schneider E, Schniepp R, Jahn K, Kalla R, Strupp M (2013) Effect of chlorzoxazone in patients with downbeat nystagmus: a pilot trial. Neurology 81:1152-1158
[10] Fishman JM, Burgess C, Waddell A (2011) Corticosteroids for the treatment of idiopathic acute vestibular dysfunction (vestibular neuritis). Cochrane Database Syst RevCD008607
[11] Garduno-Anaya MA, Couthino De TH, Hinojosa-Gonzalez R, Pane-Pianese C, Rios-Castaneda LC (2005) Dexamethasone inner ear perfusion by intratympanic injection in unilateral Meniere‘s disease: a two-year prospective, placebo-controlled, double-blind, randomized trial. Otolaryngol Head Neck Surg 133:285-294
[12] Hillier SL, McDonnell M (2011) Vestibular rehabilitation for unilateral peripheral vestibular dysfunction. Cochrane Database Syst Rev 2:CD005397
[13] Hufner K, Barresi D, Glaser M, Linn J, Adrion C, Mansmann U, Brandt T, Strupp M (2008) Vestibular paroxysmia: diagnostic features and medical treatment. Neurology 71:1006-1014
[14] Huppert D, Strupp M, Muckter H, Brandt T (2011) Which medication do I need to manage dizzy patients? Acta Otolaryngol 131:228-241
[15] Ihler F, Bertlich M, Sharaf K, Strieth S, Strupp M, Canis M (2012) Betahistine exerts a dose-dependent effect on cochlear stria vascularis blood flow in Guinea pigs in vivo. PLoS One 7:e39086
[16] Jeong SH, Kim JS, Shin JW, Kim S, Lee H, Lee AY, Kim JM, Jo H, Song J, Ghim Y (2013) Decreased serum vitamin D in idiopathic benign paroxysmal positional vertigo. J Neurol 260:832-838
[17] Karlberg ML, Magnusson M (2011) Treatment of acute vestibular neuronitis with glucocorticoids. Otol Neurotol 32:1140-1143
[18] Klockgether T (2012) Sporadic adult-onset ataxia of unknown etiology. Handb Clin Neurol 103:253-262
[19] Lempert T, Olesen J, Furman J, Waterston J, Seemungal B, Carey J, Bisdorff A, Versino M, Evers S, Newman-Toker D (2013) [Vestibular migraine: diagnostic criteria : Consensus document of the Barany Society and the International Headache Society]. Nervenarzt 84:511-516
[20] Lezius F, Adrion C, Mansmann U, Jahn K, Strupp M (2011) High-dosage betahistine dihydrochloride between 288 and 480 mg/day in patients with severe Meniere‘s disease: a case series. Eur Arch Otorhinolaryngol 268:1237-1240
[21] Neuhauser HK (2007) Epidemiology of vertigo. Curr Opin Neurol 20:40-46
[22] Postema RJ, Kingma CM, Wit HP, Albers FW, Van Der Laan BF (2008) Intratympanic gentamicin therapy for control of vertigo in unilateral Menire‘s disease: a prospective, double-blind, randomized, placebo-controlled trial. Acta Otolaryngol 128:876-880
[23] Pullens B, van Benthem PP (2011) Intratympanic gentamicin for Meniere‘s disease or syndrome. Cochrane Database Syst RevCD008234
[24] Rieger A, Mansmann U, Maier W, Seitz L, Brandt T, Strupp M, Bayer O (2013) [Management of Patients with the Cardinal Symptom Dizziness or Vertigo.]. Gesundheitswesen
[25] Schniepp R, Wuehr M, Neuhaeusser M, Benecke AK, Adrion C, Brandt T, Strupp M, Jahn K (2012) 4-Aminopyridine and cerebellar gait: a retrospective case series. J Neurol 259:2491-2493
[26] Semont A, Freyss G, Vitte E (1988) Curing the BPPV with a liberatory maneuver. Adv Otorhinolaryngol 42:290-293
[27] Stokroos R, Kingma H (2004) Selective vestibular ablation by intratympanic gentamicin in patients with unilateral active Meniere‘s disease: a prospective, double-blind, placebo-controlled, randomized clinical trial. Acta Otolaryngol 124:172-175
[28] Strupp M, Arbusow V, Maag KP, Gall C, Brandt T (1998) Vestibular exercises improve central vestibulospinal compensation after vestibular neuritis. Neurology 51:838-844
[29] Strupp M, Hupert D, Frenzel C, Wagner J, Hahn A, Jahn K, Zingler VC, Mansmann U, Brandt T (2008) Long-term prophylactic treatment of attacks of vertigo in Meniere‘s disease--comparison of a high with a low dosage of betahistine in an open trial. Acta Otolaryngol 128:520-524
[30] Strupp M, Kalla R, Claassen J, Adrion C, Mansmann U, Klopstock T, Freilinger T, Neugebauer H, Spiegel R, Dichgans M, Lehmann-Horn F, Jurkat-Rott K, Brandt T, Jen JC, Jahn K (2011) A randomized trial of 4-aminopyridine in EA2 and related familial episodic ataxias. Neurology 77:269-275
[31] Strupp M, Schuler O, Krafczyk S, Jahn K, Schautzer F, Buttner U, Brandt T (2003) Treatment of downbeat nystagmus with 3,4-diaminopyridine: a placebo-controlled study. Neurology 61:165-170
[32] Strupp M, Teufel J, Habs M, Feuerecker R, Muth C, van de Warrenburg BP, Klopstock T, Feil K (2013) Effects of acetyl-DL-leucine in patients with cerebellar ataxia: a case series. J Neurol 260:2556-2561
[33] Strupp M, Thurtell MJ, Shaikh AG, Brandt T, Zee DS, Leigh RJ (2011) Pharmacotherapy of vestibular and ocular motor disorders, including nystagmus. J Neurol 258:1207-1222
[34] Strupp M, von Stuckrad-Barre S, Brandt T, Tonn JC (2013) Teaching NeuroImages: Compression of the eighth cranial nerve causes vestibular paroxysmia. Neurology 80:e77
[35] Strupp M, Zingler VC, Arbusow V, Niklas D, Maag KP, Dieterich M, Bense S, Theil D, Jahn K, Brandt T (2004) Methylprednisolone, valacyclovir, or the combination for vestibular neuritis. N Engl J Med 351:354-361





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.