
- DAZ.online
- DAZ / AZ
- DAZ 6/2014
- Plenus venter non studet ...
Ernährung
Plenus venter non studet libenter
Ernährungsmedizinische Aspekte von Schlaf und Schlafstörungen
1. Effekt der Ernährung auf den Normalschlaf
„Plenus venter non studet libenter“ – satt macht müde, während es umgekehrt schwierig ist, hungrig einzuschlafen. Diese Beobachtung hat evolutionär bedingte, physiologische Grundlagen: In der Urzeit des Homo sapiens war die Nahrungsbeschaffung ein Hunger-motivierter Vorgang, der vom einzelnen Individuum Wachheit (Vigilanz) und körperliche Leistungsfähigkeit und von der Umgebung Tageslicht erforderte; im Gegenzug konnte die Erholungsphase am besten bei Sättigung und Dunkelheit stattfinden. Diese urzeitliche Verknüpfung von Sättigung/Schlaf einerseits und Hunger/Vigilanz andererseits findet sich bis heute im menschlichen Gehirn wieder.
Hunger macht wach. Nahrungsmangel führt über sinkende Blutglucosespiegel zur reflektorischen Sympathikusaktivierung; dies zeigt sich somatisch in der Hemmung der Insulinsekretion, einem Anstieg des Blutdrucks und einer Umverteilung des Blutes aus dem Magen-Darm-Trakt in die Skelettmuskulatur. Zusätzlich kommt es jedoch auch zu psychischen Auswirkungen mit erhöhter Vigilanz und vermehrter Aggression. Sowohl die somatischen als auch die psychischen Effekte sind vor dem evolutionsbiologischen Hintergrund plausibel, denn sie konnten direkt für die Nahrungsbeschaffung und die Jagd genutzt werden. Ein Jäger, der sich bei Hunger müde in die Höhle zurückgezogen hätte, wäre nicht sehr erfolgreich gewesen.
Satt macht müde. Umgekehrt führt Sättigung zur Aktivierung nutritiver Programme im Körper, die sich in komplexen hormonalen und vegetativen Erscheinungen äußern. Nach der Nahrungsaufnahme steigen die Konzentrationen von Glucose, freien Fettsäuren und Aminosäuren im Blut an, und es kommt zum Anstieg des Insulinspiegels; dieser Insulinanstieg ruft das physiologische „nutritive Verhalten“ ab, das insbesondere in der Parasympathikus-Aktivierung mit gesteigerter Magen-Darm-Sekretion, Motilitätsförderung und Minimierung der Skelettmuskelaktivität besteht. So konnten nach dem anstrengenden Vorgang der Nahrungsbeschaffung in der anschließenden Ruhe-/Schlafphase die Inhaltsstoffe erschlossen und für den Körper verfügbar gemacht werden.
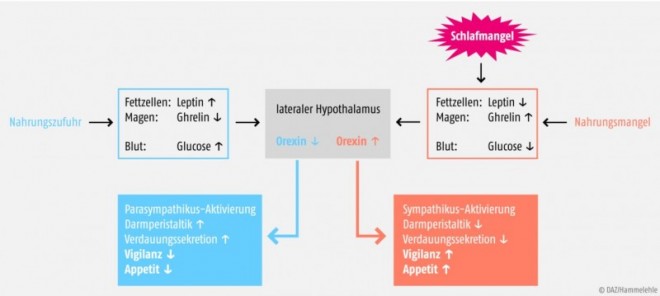
Bindeglied zwischen Schlaf und Ernährung: Orexin. Physiologisch gesehen stehen die interaktiven homöostatischen Systeme Schlaf und Ernährung über die Neuropeptide Orexin A und Orexin B in Verbindung [2]. Zentrale Funktion der im Hypothalamus gebildeten Orexine ist die Übersetzung des Ernährungszustandes in verschiedene Hunger- und Vigilanzzustände, vereinfacht bestehend aus postprandialer Müdigkeit und hungerinduzierter Vigilanzsteigerung (Abb. 1).Ein Anstieg von Orexin im Hypothalamus bewirkt einerseits Hungergefühl, andererseits verminderte Schlafbereitschaft; stimuliert wird die Orexin-Bildung durch äußere Signale von Nahrungsmangel: sinkende Glucosespiegel, vermehrte Ghrelin-Bildung im leeren Magen und sinkende Leptin-Bildung durch die Abnahme von Fettgewebe [3]. Ein Einschlafen ist unter diesen Bedingungen schwer möglich. In der Umkehrung bedeutet Nahrungsaufnahme steigende Glucosespiegel, reduzierte Ghrelin-Produktion („Magen ist gefüllt“) und gesteigerte Leptin-Produktion (durch mehr Fettgewebe): folglich wird im Hypothalamus weniger Orexin ausgeschüttet und es kommt neben Sättigungsgefühl auch zur Müdigkeit.
Vor diesem Hintergrund ist es plausibel, dass Mahlzeiten vor der Nachtruhe die Einschlafzeit verkürzen [4]. Allerdings beruht dieser Effekt nicht auf der allgemein angenommenen „Umverteilung von Blut aus dem Kopf in den Bauch“ [3], sondern ist Folge der nahrungsstimulierten Orexin-Hemmung im Gehirn [5]. Die Zusammensetzung der Nahrung spielt dabei eine Rolle, wie schnell es über sinkende Orexin-Spiegel zur Müdigkeit kommt: Während dies bei Kohlenhydrat-reicher Nahrung bereits innerhalb einer halben Stunde der Fall ist, dauert es bei fettreicher Nahrung bis zu drei Stunden, bevor die Müdigkeit einsetzt [6].
Tryptophan. Häufig diskutiert ist auch ein positiver Effekt von Tryptophan-reicher Nahrung für die Schlafbereitschaft. Hintergrund ist die Tatsache, dass die essenzielle Aminosäure Tryptophan die biologische Ausgangssubstanz für die körpereigene Serotonin- und Melatonin-Biosynthese ist – und Melatonin ist das physiologische „Schlafhormon“. Daher wäre es theoretisch möglich, die körpereigene Melatonin-Produktion durch exogene Zufuhr des Vorläufers Tryptophan anzuregen. Tryptophan ist in besonders hohen Konzentrationen in Sojabohnen, Kuhmilch, Haferflocken, Mandeln und Cashew-Kernen enthalten. Auch wenn immer wieder diskutiert wird, dass ein abendlicher Konsum dieser Lebensmittel (z.B. in Form der klassischen „Honigmilch“) die Schlafbereitschaft fördert, so reicht vermutlich auch der vergleichsweise hohe Tryptophan-Gehalt dieser Nahrungsmittel nicht aus, um eine pharmakologisch bedeutsame Melatonin-Wirkung zu erzielen [7, 8]. Nichtsdestotrotz kann die abendliche warme Honigmilch im Rahmen eines entspannenden Einschlafrituals durchaus positiv genutzt werden.
2. Effekt der Ernährung auf Schlafstörungen
Die internationale Klassifikation der Schlafstörungen unterscheidet verschiedene Gruppen und Untergruppen; bei mehreren dieser Schlafstörungen spielen Ernährungsaspekte sowohl in der Entstehung als auch im Rahmen der Therapie eine relevante Rolle.
Ernährungshinweise zum Thema Schlaf und Schlafstörungen
Grundregeln
- Hunger macht wach, satt macht müde: nicht mit leerem Magen ins Bett gehen
- nach dem Mittagessen keine Coffein-haltigen Getränke konsumieren (Kaffee, Schwarztee, Grüner Tee, Cola)
- Alkohol weitgehend vermeiden, keinesfalls als Einschlafmittel verwenden
- Abendmahlzeit: nicht zu viel, nicht zu wenig, nicht zu spät essen
- leicht verdaulich, Rohkost und stark gewürzte Speisen vermeiden
- auf Zitrusfrüchte und saure Fruchtsäfte verzichten
- Kohlenhydrat-reiche Kost bevorzugen
- süßes (kleines!) Betthupferl oder Hausmittel wie warme Honigmilch können als Teil des regelmäßigen Einschlafrituals genutzt werden
bei Demenz
bei manchen Patienten wirken Coffein-haltige Getränke schlafanstoßend (als Therapieversuch möglich)
bei obstruktivem Schlafapnoe-Syndrom (OSAS)
- Übergewicht sollte, möglichst mit ernährungstherapeutischer Begleitung, reduziert werden
- mediterrane Diätformen bevorzugen
- Alkohol vermeiden
bei Restless-legs-Syndrom
- Grundregeln der Schlafhygiene sind besonders wichtig
- Alkohol und Coffein-haltige Getränke vermeiden
- Abendmahlzeit: leicht verdauliche, Kohlenhydrat-reiche Nahrung bevorzugen
- Patienten auf Überprüfung der Eisenwerte hinweisen; bei Ferritinkonzentration < 50 µg/l ist orale Eisensupplementation sinnvoll
zur Linderung von Jetlag-Beschwerden
- Alkohol und Coffein-haltige Getränke vermeiden
- am Tag vor der Flugreise und am Reisetag selbst sollte möglichst wenig und möglichst kalorienarm gegessen werden
- Flugreise Richtung Westen: Protein-reiche Nahrung bevorzugen (Milchprodukte, Fisch, Fleisch, Eier)
- Flugreise Richtung Osten: Kohlenhydrat-reiche Nahrung bevorzugen (Nudeln, Kartoffeln, Reis, Obstsäfte)
zur Prävention von Adipositas und kardiovaskulären Erkrankungen
- regelmäßige Schlafdauer zwischen sieben bis neun Stunden einhalten
- kürzere oder längere Schlafdauer vermeiden
Insomnien. Innerhalb der Obergruppe der Insomnien stehen aus ernährungsmedizinischer Sicht die „Insomnie bei inadäquater Schlafhygiene“ und die „Substanz-induzierte Insomnie“ im Mittelpunkt. Die Regeln einer guten Schlafhygiene sind Grundlage des erholsamen Schlafes und gelten nicht nur in der Therapie, sondern auch für die Prophylaxe von Schlafstörungen. Ernährungsaspekte innerhalb einer adäquaten Schlafhygiene sind vor allem die Vermeidung von zu viel, zu wenig oder von zu spätem Essen vor der Nachtruhe. Dabei sollten insbesondere die schwer verdaulichen, großen Mahlzeiten vermieden werden; ebenso kontraproduktiv ist es aber auch, hungrig ins Bett zu gehen. Ein kleines, Kohlenhydrat-reiches „Betthupferl“ kann durchaus sinnvoll sein [9].
Coffein. Bei den substanzinduzierten Insomnien geht es unter ernährungsmedizinischem Aspekt vor allem um Coffein und Alkohol. Der Schlaf-hemmende Effekt von Coffein ist hinlänglich bekannt und gut belegt; insbesondere Menschen mit Schlafstörungen sollten Coffein-haltige Getränke daher bereits nach dem Mittagessen meiden [10]. Bei einigen Demenzpatienten kann es durch Coffein dagegen zu paradoxen, das heißt schlafanstoßenden Effekten kommen, was in Form von Coffein-haltigen Getränken vor dem Einschlafen als Therapieversuch genutzt werden kann [11].
Alkohol gehört zwar zu den ältesten und gebräuchlichsten Schlafmitteln der Selbstmedikation, ist aber häufig Auslöser einer Substanz-induzierten Insomnie. Ähnlich wie die Benzodiazepine greift Ethanol in den GABA-Stoffwechsel des Gehirns ein, was die verkürzte Einschlafzeit und die erhöhte Weckschwelle erklärt. Im Laufe der Nacht kommt es jedoch zu Alkohol-induzierten Schlafstörungen: Tiefschlafphasen und REM-Schlaf werden reduziert, Schlaffragmentierung und Wachanteil steigen an – die Folge ist ein weniger erholsamer Schlaf. Vielen habituellen Alkoholkonsumenten ist diese Ursache latenter Tagesschläfrigkeit oft nicht bekannt, da morgens keine Erinnerung mehr an die häufigen Wachphasen vorhanden ist [12]. Chronischer Alkoholabusus führt sogar regelhaft zu massiven Schlafstörungen, ebenso wie die plötzliche Abstinenz nach längerem Alkoholkonsum [12]. Aufgrund der Gefahr der Gewohnheitsbildung mit zunehmender Verschlechterung der Schlafqualität sollte Alkohol daher nicht als Einschlafhilfe eingesetzt werden [10].
Schlafbezogene Atemstörungen. Unter Ernährungsaspekten besonders relevant sind hier das obstruktive Schlafapnoe-Syndrom und das Adipositas-Hypoventilations-Syndrom. Das obstruktive Schlafapnoe-Syndrom (OSAS) entsteht durch Einengungen bzw. vollständige Verlegung der oberen Atemwege, worauf es zu starkem Schnarchen und zur reflektorischen Weckreaktion kommt, was über Reduktion von Tief- und Traumschlaf zu nicht erholsamem Schlaf und exzessiver Tagesmüdigkeit führt. Bei der Entwicklung eines OSAS spielt Übergewicht eine maßgebliche Rolle: 80 Prozent der OSAS-Patienten sind übergewichtig, und auch Alkoholkonsum führt über eine verstärkte Muskelrelaxation zur Verschlechterung der Symptomatik [13]. Beim Adipositas-Hypoventilations-Syndrom handelt es sich sogar um eine direkte Beeinträchtigung der Lungenexpansion und der Zwerchfellmotilität durch die Adipositas, was den REM-Schlaf drastisch reduziert [13].
Bei beiden Formen der schlafbezogenen Atemstörungen besteht die Basistherapie neben der nächtlichen Überdruckbeatmung in einer Gewichtsreduktion, da das Übergewicht in der Pathogenese eine entscheidende Rolle spielt. Patienten mit schlafbezogenen Atemstörungen bedürfen daher zur kausalen Therapie in der Regel einer umfassenden ernährungsmedizinischen Betreuung, um das Körpergewicht zu reduzieren [14]. Die ernährungstherapeutisch begleitete, diätetische Gewichtsreduktion ist hinsichtlich der klinischen Symptomverbesserung genauso wirksam wie eine bariatrische Adipositas-Chirurgie [15]. Darüber hinaus gibt es Hinweise darauf, dass im Vergleich der unterschiedlichen Diätformen insbesondere die mediterrane Diät zur Verbesserung der nächtlichen OSAS-Symptomatik führt [16].
Zirkadiane Störungen. Zirkadiane Störungen entstehen durch die fehlende Übereinstimmung der individuellen „biologischen Nacht” mit den exogenen Taktgebern; eine der häufigsten Ursachen ist die Flugreise über mehrere Zeitzonen („Jetlag“). Der wichtigste exogene Taktgeber ist der Licht-Dunkel-Wechsel, der zur zirkadian oszillierenden Melatonin-Produktion führt. Das tageszeitlich rhythmisch auftretende Hungergefühl ist nicht von der Melatonin-Produktion abhängig, sondern Folge der rhythmischen Ghrelin-Freisetzung aus Magenepithelzellen [17]; dies führt zu regelmäßigem Hungergefühl, unabhängig vom Tageslicht der Umgebung, was bei einem Jetlag zu entsprechenden Problemen führt. Zur bestmöglichen Bewältigung eines Jetlags gehört deshalb neben der effektiven Nutzung von Tageslicht als äußerem Taktgeber auch die Anpassung der Ernährung im Sinne einer „Jetlag-Diät“; die wissenschaftlichen Belege für deren Wirksamkeit sind allerdings eher dürftig. So reicht die häufig von Piloten praktizierte sogenannte „Ehret-Diät“ allein sicherlich nicht aus, um einen Jetlag zu verhindern, zusammen mit Tageslicht-orientierten Verhaltensregeln kann sie aber möglicherweise helfen, die Symptome zu lindern: Grundsätzlich erfolgt die zirkadiane Umstellung am schnellsten, wenn Alkohol und Coffein gemieden werden und wenn am Tag vor der Flugreise und am Reisetag selbst möglichst wenig und kalorienarm gegessen wird [18]. Noch leichter fällt dem Körper die Umstellung auf die neue Ortszeit, wenn die Art der Nahrung an die Reiserichtung angepasst wird [19]: Bei Flugreisen in Richtung Westen sollte möglichst Eiweiß-reiche Nahrung gegessen werden, da diese hilft, länger wach zu bleiben, was dem neuen Tag-Nacht-Zyklus entgegenkommt [20]. Bei Flugreisen in Richtung Osten sollte dagegen möglichst Kohlenhydrat-reiche Kost zu sich genommen werden, um so das Schlafbedürfnis zu stimulieren [21].
Schlafbezogene Bewegungsstörungen. Innerhalb dieser Gruppe ist das Restless-legs-Syndrom (RLS) von besonderer Bedeutung; mit einer Prävalenz von drei bis zehn Prozent zählt es in Europa zu den häufigsten neurologischen Erkrankungen [22]. Die Pathophysiologie des RLS ist komplex und bislang noch nicht vollständig aufgeklärt. Aus ernährungsmedizinischer Sicht ist jedoch bedeutsam, dass der Zusammenhang zwischen Eisenmangel und dem Auftreten des Restless-legs-Syndroms als gesichert gilt [22]. Eisen besitzt im Gehirn eine essenzielle Funktion im Dopamin-Stoffwechsel, und Eisenmangel bewirkt hier eine reduzierte Dopamin-Synthese [23]. Der Schweregrad der RLS-Symptomatik korreliert häufig mit dem Ausmaß des Eisenmangels, und die Wirksamkeit von (auch oraler) Eisensubstitution bei RLS ist belegt [22, 24]. Bislang nicht systematisch untersucht ist allerdings, ob sich der verstärkte Verzehr eisenhaltiger Nahrungsmittel günstig auf die RLS-Symptomatik auswirkt; auch für zahlreiche andere Ernährungsempfehlungen gibt es bislang keinen wissenschaftlich belegten Effekt. Ausnahmen bilden hier allein Coffein und Alkohol [25], deren Konsum sich negativ auf die RLS-Symptomatik auswirkt und von deren Konsum RLS-Patienten deutlich abgeraten werden sollte [26]. Einen ebenfalls symptomlindernden Effekt kann es haben, wenn als Abendmahlzeit leicht verdauliche, Kohlenhydrat-reiche Nahrung bevorzugt wird [27].
3. Dick macht müde – oder umgekehrt? Zusammenspiel von Ernährung, Schlaf und Körpergewicht
Aufgrund der neurophysiologischen Verbindung von Sättigung/Schlaf und Hunger/Vigilanz liegt auch ein Zusammenhang zwischen Schlafdauer und Körpergewicht nahe. In der Tat konnte dieser Zusammenhang in zahlreichen Studien gezeigt werden: Schlafrestriktion bewirkt eine Reduktion von Leptin und einen Anstieg von Ghrelin, was für den Körper entscheidende Hungersignale sind [28]. Schlafentzug hat damit für den Körper ähnliche physiologische Folgen wie Nahrungsmangel [29] (Abb. 1). Ernährungsmedizinisch besonders relevant ist die Beobachtung, dass dieser Schlafmangel-induzierte Hunger insbesondere einen gesteigerten Appetit auf hochkalorische Lebensmittel und Kohlenhydrate bedeutet [30]. Hieraus ergab sich die Hypothese, dass auch ein Zusammenhang zwischen Schlafdauer und metabolischen Erkrankungen wie Typ-2-Diabetes oder Adipositas bestehen könnte. In der Tat konnte in epidemiologischen Studien gezeigt werden, dass eine positive Korrelation zwischen kurzer Schlafdauer und Hypertonie, BMI, Adipositas, Typ-2-Diabetes und den Triglyzerid-Spiegeln im Blut besteht [31, 32]. Bereits seit Längerem gibt es deutliche Hinweise dafür, dass eine kurze Schlafdauer einen unabhängigen Risikofaktor für die Entstehung von Typ-2-Diabetes darstellen könnte [33].
Die Prävalenz von metabolischem Syndrom und kardiovaskulären Erkrankungen steigt bereits dann signifikant an, wenn die durchschnittliche Schlafdauer scheinbar unwesentlich von acht Stunden auf sieben Stunden pro Nacht reduziert wird; dies gilt allerdings auch für überdurchschnittliche Langschläfer (>10 Stunden) [34]. Schon bei Grundschulkindern ist der direkte Zusammenhang zwischen Schlafdauer und Adipositas signifikant, wenn der tägliche Schlaf nur um eine einzige Stunde reduziert wird [35], und zwar unabhängig von anderen soziodemografischen Faktoren [36].
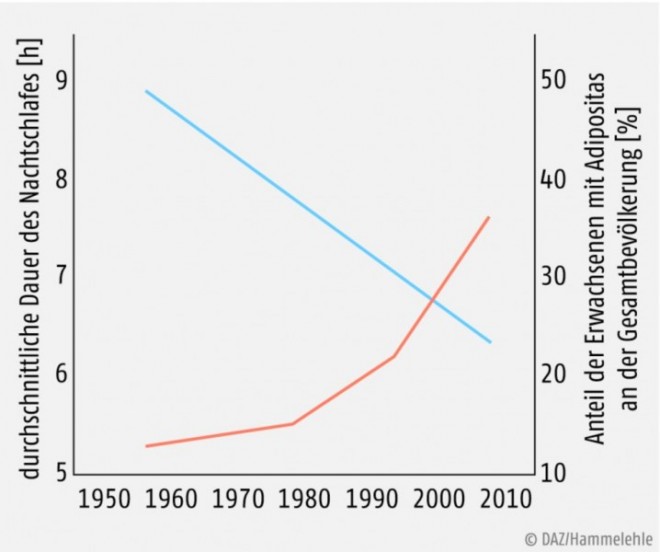
In den vergangenen Jahrzehnten hat die durchschnittliche Schlafdauer in den westlichen Industrienationen kontinuierlich abgenommen, während es parallel zu einem drastischen Anstieg der Prävalenz von Adipositas und metabolischem Syndrom gekommen ist (siehe Abb. 2) [30]. Korrelation bedeutet nicht automatisch Kausalität, doch in großen Interventionsstudien konnte tatsächlich gezeigt werden, dass Schlafrestriktion kausal zu gesteigertem Appetit und einer erhöhten Empfindlichkeit gegenüber hochkalorischen Nahrungsstimuli führt [37]. Sowohl die physiologischen als auch die epidemiologischen Erkenntnisse deuten vermehrt darauf hin, dass der in modernen westlichen Gesellschaften zunehmende Schlafmangel einen relevanten Einfluss auf das individuelle Risiko für Typ-2-Diabetes und kardiovaskuläre Mortalität besitzt.
Autoren
Prof. Dr. rer. nat. Martin Smollich, Fachapotheker für Klinische Pharmazie, Antibiotic Stewardship-Experte (DGI). 1998 bis 2004 Studium von Biologie und Pharmazie in Münster und Cambridge (UK), 2005 bis 2008 wissenschaftlicher Mitarbeiter an der Universitätsfrauenklinik Münster und Promotion über ein Thema zur experimentellen Pharmakotherapie des Mammakarzinoms, 2009 bis 2013 klinische Tätigkeit und pharmakologischer Konsildienst. Seit 2013 Professor und Studiengangsleiter des Studiengangs Clinical Nutrition/Ernährungsmanagement an der Mathias Hochschule Rheine.
Wissenschaftliche Schwerpunkte:
Klinische Ernährung, Klinische Pharmakologie, Arzneimitteltherapiesicherheit und rationale Antiinfektiva-Therapie.
Dipl. med. päd. Birgit Blumenschein, Diätassistentin, 1988 bis 1990 Ausbildung zur staatlich anerkannten Diätassistentin, 1996 bis 2002 Lehrassistentin an medizinischer Fachschule, Fachbereich Diätassistenz, 1997 bis 2003 Studium der Medizinpädagogik an der Charité in Berlin. Seit 2003 selbstständig tätig in eigener Praxis, seit 2011 wissenschaftliche Mitarbeiterin an der Mathias Hochschule Rheine, Studiengangskoordinatorin des Studiengangs Clinical Nutrition/ Ernährungsmanagement, B.Sc.
Wissenschaftliche Schwerpunkte: Ernährungsmedizin mit den Schwerpunkten Gastroenterologie, Stoffwechsel und Adipositas; Gesundheitsbildung, Betriebliches Gesundheitsmanagement.
Quelle
[1] Högl B. Ernährung und Schlaf. In: Ledochowsk M. Klinische Ernährungsmedizin. 2010; Springer Wien New York.
[2] Vanitallie TB. Sleep and energy balance: Interactive homeostatic sytems. Metabolism 2006; 55: 30–535.
[3] Burdakov D, Luckman SM, Verkhratsky A. Glucose-sensing neurons of the hypothalmus. Phil Trans R Soc B 2005; 360: 2227–2235.
[4] Orr WC & Chen CL. Sleep and the gastrointestinal tract. Neurol Clin 2005; 23: 1007–2024.
[5] Nicolaidis S. Metabolic mechanism of wakefulness (and hunger) and sleep (and satiety): role of adenosine triphosphate and hypocretin and other peptides. Metab Clin Exp 2006; 55: 24–249.
[6] van der Lely AJ, Tschöp M, Heiman ML et al. Biological, physiological, pathophysiological, and pharmacological aspects of ghrelin. Endocr Rev 2004; 25: 426–457.
[7] Chaput JP. Sleep patterns, diet quality and energy balance. Physiol Behav 2013; 13: 286–292.
[8] Peuhkuri K, Sihvola N, Korpela R. Diet promotes sleep duration and quality. Nutr Res 2012; 32: 309–319.
[9] Pfetzing A. Schlafhygiene. In: Peter H, Penzel T, Peter JH Enzyklopädie der Schlafmedizin. 2007; Springer Medizin Verlag, Heidelberg.
[10] Deutsche Gesellschaft für Schlafforschung und Schlafmedizin (DGSM) S3-Leitlinie „Nicht erholsamer Schlaf/Schlafstörungen. Somnologie 2009; 13: 4–160.
[11] Lauer CJ. Der Schlaf bei psychiatrischen Erkrankungen. Der Beitrag der Polysomnographie zum Verständnis der Pathophysiologie psychiatrischer Erkrankungen. 1997; MMV Medizin Verlag, München.
[12] Hornyak M. Alkohol-induzierte Schlafstörung. In: Peter et al.: Enzyklopädie der Schlafmedizin. 2007; Springer Medizin Verlag, Heidelberg.
[13] Herold G. Innere Medizin. 2013; Gerd Herold Verlag.
[14] Deutsche Gesellschaft für Hals-Nasen-Ohren-Heilkunde, Kopf- und Hals-Chirurgie ArGe Schlafmedizin. S2-Leitlinie „Therapie der obstruktiven Schlafapnoe des Erwachsenen“. 2009; AWMF-Register-Nr. 017/069.
[15] Dixon JB, Schachter LM, O’Brien PE et al. Surgical vs Conventional Therapy for Weight Loss Treatment of Obstructive Sleep Apnea. A Randomized Controlled Trial. JAMA 2012; 308: 1142–1149.
[16] PapandreouC, Schiza SE, Bouloukaki I et al. Effect of Mediterranean diet versus prudent diet combined with physical activity on OSAS: a randomised trial. Eur Respir J 2012; 39: 1398–1404.
[17] Mendoza J. Circadian clocks: setting time by food. J Neuroendocrinol 2007; 19: 127–137.
[18] Ehret CF & Scanlon LW. Overcoming jet-lag. 1983; New York, Berkley.
[19] Graeber RC. Recent studies relative to the airlifting of military units across time zones. In: Scheving & Halberg (Hrsg.): Chronobiology: Principlesand applications to shifts in schedules. 1980; Alphen aan den Rijn, The Netherlands, Sijthoff and Noordhoff.
[20] Leathwood P. Circadian rhythms of plasma amino acids, brain neurotransmitters and behaviour. In: Arendt J, Minors D, Waterhouse J (Hrsg.): Biological rhythms in clinical practice. 19989; John Wright, London.
[21] Redfern P. Jet lag strategies for prevention and care. Human Psychopharmacology 1989; 4: 159–168.
[22] Deutsche Gesellschaft für Neurologie. S1-Leitlinie „Restless-Legs-Syndrom (RLS) und Periodic Limb Movement Disorder (PLMD)“. 2012; AWMF-Register-Nr. 030/081.
[23] Earley CJ, Connor JR, Beard JL et al. Abnormalities in CSF concentrations of ferritin and transferrin in restlesslegs syndrome. Neurology 2000; 54: 1698–1700.
[24] Grote L, Leissner L, Hedner J et al. A randomized, double-blind, placebo controlled, multi-center study of intravenous iron sucrose and placebo in the treatment of restless legs syndrome. Mov Disord 2009; 24: 1445–1452.
[25] Trenkwalder C, Hening WA, Montagna P et al. Treatment of restless legs syndrome: an evidence-based review and implications for clinical practice. Mov Disord 2008; 23: 2267–2302.
[26] Silber MH, Ehrenberg BL, Allen RP et al. An algorithm for the management of restless legs syndrome. Mayo Clin Proc 2004; 79: 916–922.
[27] Paulson GW. Restless legs syndrome. How to provide symptom relief with drug and nondrug therapies. Geriatrics 2000; 55: 35–48.
[28] Spiegel K, Leproult R, L’hermite-Baléraux M et al. Leptin levels are dependent on sleep duration: relationships with sympathovagal balance, carbohydrate regulation, cortisol and thyrotropin. J Clin Endocrinol Metab 2004; 89: 5762–5771.
[29] Spiegel K, Tasali E, Penev P et al. Sleep curtailment in healthy young men is associated with decreased leptin levels, elevated ghrelin levels, and increased hunger and appetit. Ann Intern Med 2004; 141: 846–850.
[30] van Cauter E, Knutson K, Leproult R et al. (2005) The impact of sleep depriviation on hormones and metabolism. Medscape Neurology 2005; 7: e-pub.
[31] Bjorvatn B, Sagen IM, Øyane N et al. The association between sleep duration, body mass index and metabolic measures in the Hordaland Health Study. J Sleep Res 2007; 16: 66–76.
[32] Chaput JP, McNeil J, Després JP et al. Short sleep duration as a risk factor for the development of the metabolic syndrome in adults. Prev Med 2013; 57: 872–877.
[33] Ayas NT, White DP, Al-Delaimy WK et al. A prospective study of self-reported sleep duration and incident diabetes in women. Diabetes care 2003; 26: 380–384.
[34] Chaput JP, McNeil J, Després JP et al. Seven to eight hours of sleep a night is associated with a lower prevalence of the metabolic syndrome and reduced overall cardiometabolic risk in adults. PLoS One 2013; 8: 10.
[35] Moraleda-Cibrián M & O’Brien LM. Sleep duration and body mass index in children and adolescents with and without obstructive sleep apnea. Sleep Breath 2013; e-pub ahead of print; doi: 10.1007/s11325-013-0918-0.
[36] de Jong E, Stocks T, Visscher TL et al. Association between sleep duration and overweight: the importance of parenting. Int J Obes 2012; 36: 1278–1284.
[37] St-Onge MP, McReynolds A, Trivedi ZB et al. Sleep restriction lead to increased activation of brain regions sensitive to food stimuli. Am J Clin Nutr 2012; 95: 818–824.






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.