
- DAZ.online
- DAZ / AZ
- DAZ 40/2015
- Krebs überstanden
Onkologie
Krebs überstanden ...
Womit Langzeitüberlebende nach einer Krebserkrankung kämpfen müssen

Von Sven Stegemann | Selbst nach Jahrzehnten intensiver Forschung und zahlreichen innovativen Fortschritten in der Behandlung gehört Krebs auch weiterhin zu den lebensbedrohlichen Erkrankungen. Vorwiegend tritt die Krebserkrankung im siebten Lebensjahrzehnt auf oder in seltenen Fällen auch in der frühen Kindheit. Die Entstehung von Krebs wird heute wesentlich mehr auf molekularer Ebene verstanden und es wurden neue Therapien zusammen mit pharmako-genetischen Markern entwickelt, die eine personalisierte Therapie ermöglichen. Durch die gezielte, personalisierte Krebstherapie ist es heute möglich, bei manchen Tumoren eine Erfolgsrate von nahezu 100% zu erreichen. Daher gibt es jetzt auch eine neue Patientenpopulation, die Langzeitüberlebenden nach Krebserkrankungen.
Krebs wird heute als eine Gruppe verschiedener, chronischer, maligner Erkrankungen verstanden, die mit einer einzigartig starken Belastung während und nach der Behandlung für den Patienten, dessen Angehörigen und das soziale Umfeld einhergeht [Zebrack 2015]. Mit dem Überstehen der akuten Phase der Krebserkrankung beginnt die Phase der Unsicherheit für den Betroffenen, bezüglich einer Rezidivbildung, Metastasierung, Neubildung sowie den Langzeiteffekten, die sich aus der Therapie ergeben können. In diesem Zusammenhang ist auch der Begriff „(Langzeit)überlebender“ zu sehen, da unter einem Überlebenden jemand verstanden wird, der etwas Traumatisches, extrem Schwieriges oder Herausforderndes durchlebt hat, sei es nun ein Krieg, eine Katastrophe oder eben eine lebensbedrohliche Erkrankung [Hebdon et al. 2014]. Derartige Situationen setzen sich sowohl aus positiven (z. B. Tumorremission) als auch negativen (z. B. Metastasen) Ereignissen zusammen und schaffen für den Betroffenen zum Teil lebenslang eine ambivalente Gefühlswelt. Mit dem „Überleben“ kehrt der Betroffene also nicht wieder in die Zeit vor seiner Krebserkrankung zurück, sondern bleibt zurück mit physischen, psychischen, sozialen und auch finanziellen Veränderungen, die weiterführender Aufmerksamkeit und Interventionen bedürfen. Insofern wird aus einem „Langzeitüberlebenden“ nach einer Krebserkrankung, ein „Langzeitüberlebensfall“, da die Krebserkrankung für den Patienten nicht abgeschlossen ist und einer kontinuierlichen Überwachung und Behandlung bedarf [Kazanjian et al. 2012].
Krebserkrankungen im Erwachsenenalter
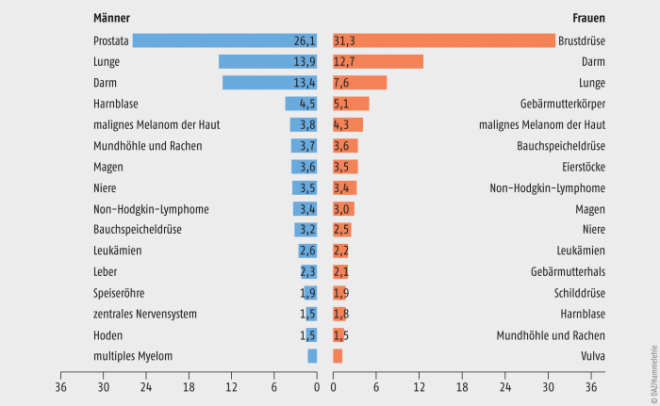
In Deutschland stieg die Zahl der Neuerkrankungen zwischen 2000 und 2010 bei Männern und Frauen zwar um 21 bzw. 14% an, korrigiert um die veränderte Altersstruktur blieb die Prävalenz allerdings unverändert. In Zahlen ausgedrückt erkrankten in Deutschland im Jahre 2011 255.318 Männer und 228.259 Frauen an Krebs, wobei die Sterberate von 119.368 bei Männern und 101.564 bei Frauen betrug. Hinsichtlich der altersbedingten Organverteilung der Tumoren ergibt sich ein geschlechtsspezifisches Verteilungsmuster (Abb. 1). Bei den Männern überwiegen Tumoren in der Prostata (26,1%), der Lunge (13,9%) und dem Darm (13,4%) während es bei den Frauen vor allem die Brust (31,3%), der Darm (12,7%) und die Lunge (7,6%) sind.
Abb. 1: Tumorhäufigkeit bezogen auf die Lokalisation der Tumorneuerkrankungen in Deutschland im Jahre 2010 [Robert Koch-Institut 2013]
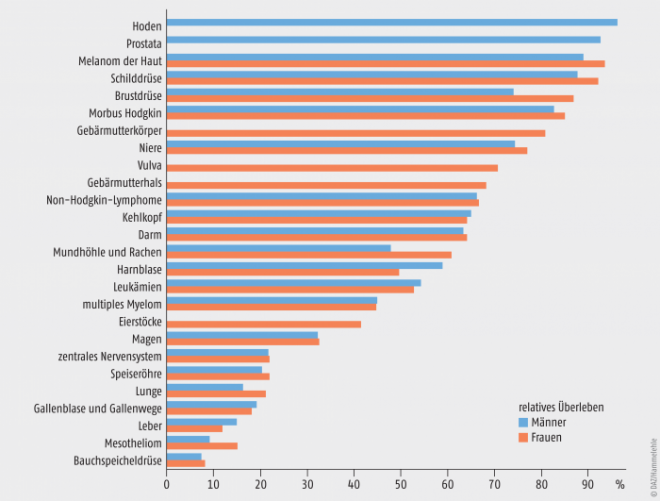
Nimmt man die Fünf-Jahres-Überlebensrate hinzu ergibt sich daraus heute eine prozentuale Überlebensrate von 61% für Männer und 67% für Frauen [Robert Koch-Institut 2013]. Wie aus Abbildung 2 ersichtlich, ist die durchschnittliche Überlebensrate gemittelt über alle Krebserkrankungen wenig aussagekräftig für den individuellen Patienten, da die Überlebenschancen stark von der Lokalisation des Tumors abhängen. Tumoren der Bauchspeicheldrüse überlebt etwa nur jeder zehnte Patient, während es sich bei Melanomen der Haut genau umgekehrt verhält und nur jeder zehnte Patient innerhalb von fünf Jahren an dem Tumor verstirbt.
Abb. 2: Vergleich der relativen Fünf-Jahres-Überlebensraten von Krebspatienten, nach Lokalisation und Geschlecht, Deutschland 2009 bis 2010 (Periodenanalyse) [Robert Koch-Institut 2013]
Krebserkrankungen im Kindesalter
Eine weitere wichtige Patientenpopulation innerhalb der Krebserkrankungen ist die pädiatrische Onkologie. Im Gegensatz zu den Tumoren im fortgeschrittenen Alter, bei denen es sich vorwiegend um epi- und endodermale Neoplasien (Karzinome) handelt, basieren die Tumoren im Kindesalter größtenteils auf mesodermalen Malignomen. Mit einer Inzidenz von 13,7 pro 100.000 Kindern unter 15 Jahren ergibt sich für Deutschland damit eine Anzahl von etwa 1800 Kindern pro Jahr [Creutzig et al. 2003]. In den vergangenen 50 Jahren ist die Überlebensrate in der pädiatrischen Onkologie von 10 bis 20% auf über 75% gestiegen, so dass im Durchschnitt drei von vier Kindern zu Langzeitüberlebenden nach einer Krebserkrankung werden [Creutzig et al. 2003]. Statistisch gesehen ergibt sich daraus das in der Altersgruppe zwischen 20 bis 39 Jahren 1 in 640 Individuen zur Gruppe der Langzeitüberlebenden nach Krebs gehört [Hogan et al. 2013]. Wie in Tabelle 1 dargestellt, stellen die Leukämien mit ca. 34% den größten Teil der Krebserkrankungen im Kindesalter dar, wobei die Heilungsaussichten bei der akuten lymphatischen Leukämie über 80% betragen, hingegen bei der akuten myeloischen Leukämie lediglich bei unter 50% liegen. Des Weiteren folgen ZNS-Tumoren mit 19%, Lymphome mit 13% und Neuroblastome mit 7% [Kuehni et al. 2012; Creutzig et al. 2003].
Krebslokalisation bei Kindern |
prozentualer Anteil |
|---|---|
Leukämien |
33,8 % |
ZNS-Tumoren |
20,0 % |
Lymphome |
12,7 % |
Tumoren des sympathischen Nervensystems |
8,7 % |
Weichteilsarkome |
6,4 % |
Nierentumoren |
6,2 % |
Knochentumoren |
4,6 % |
Keimzelltumoren |
3,5 % |
andere |
4,1 % |
Langzeitüberlebende nach Krebserkrankungen
Die Verbesserung der Früherkennung, evidenzbasierte Therapieoptimierungen, die Zunahme der Personalisierung der Therapie und die Einführung neuartiger onkologischer Substanzklassen und Substanzen haben wesentlich zu einer Steigerung der Überlebensraten nach Krebserkrankungen geführt. Zusammen mit der kontinuierlichen Erhöhung der Lebenserwartung, steigt die Zahl Langzeitüberlebender nach Krebserkrankungen kontinuierlich an. Daraus ergibt sich eine geschätzte Zahl von 32,5 Millionen Menschen weltweit, die fünf Jahre und länger mit einer Krebserkrankung leben. Demnach leben ungefähr 13,7 Millionen Langzeitüberlebende nach Krebs in den USA und schätzungsweise 3,4 Millionen Langzeitüberlebende in Deutschland [Hebdon et al. 2014; Robert Koch-Institut 2013]. Bei ca. 80 Millionen Einwohnern in Deutschland entspricht dies zwar nur einem prozentualen Anteil von 4%, allerdings sollte beachtet werden, dass Langzeitüberlebende mit Krebserkrankungen in der Regel älter als 65 Jahre sind. Da drei von vier ehemaligen Krebspatienten zusätzlich an mindestens zwei oder mehr krebsunabhängigen Erkrankungen leiden [Siu et al. 2013], sind Langzeitüberlebende nach Krebs eher der Regelfall als die Ausnahme in der Apothekenpraxis.
Langzeitüberleben nach Krebs als Patienten
Die Krebserkrankung sowie deren Therapie stellen einen erheblichen Eingriff in die Physiologie des Menschen dar. Aufgrund der infiltrierenden und devastierenden Wirkung des Tumors sowie der Behandlung durch chirurgische Eingriffe, Strahlentherapie und Chemotherapie erfolgt die Therapie häufig wenig selektiv bzw. spezifisch und ist auch aufgrund seiner starken „Aggressivität“ mit einer hohen Nebenwirkungsrate behaftet. Die Nebenwirkungen treten dabei während oder unmittelbar nach der Therapie selbst auf, können aber auch erst nach Jahren in Erscheinung treten und sind nicht auf den von der Tumorerkrankung lokalen Bereich eingeschränkt. In Tabelle 2 ist das Spektrum der Nebenwirkungen onkologischer Therapien nach deren medizinischem Formenkreis dargestellt.
Spätfolgen onkologischer Erkrankungen | |
psychologische |
|
somatische |
|
physische und soziale |
|
Nebenwirkungen des psychologischen Formenkreises
Bereits mit der Krebsdiagnose leiden Patienten unter starker psychologischer Belastung, die auch nach überstandener Krebstherapie bestehen bleibt. Die psychologische Belastung führt bei ungefähr einem Viertel der Patienten zu starken Depressionen mit einem signifikant erhöhten Risiko für eine dadurch bedingte Krankenhauseinweisung. In gleicher Weise treten bei fast einem Drittel der Patienten starke Angstzustände auf [Aaronson et al. 2014]. Sowohl Depressionen als auch Angstzustände treten in gleicher Weise nach Krebserkrankungen bei Kindern als auch bei altersbedingten Krebserkrankungen auf und können über Jahre bestehen bleiben [Prasad et al. 2015]. Die Prävalenz für Depression und Angst bei einer Krebserkrankung hängt auch mit weiteren Faktoren zusammen. So deuten Studien darauf hin, dass Personen die geschieden, getrennt, verwitwet oder ledig sind, Diabetes haben oder physisch eingeschränkt sind, eine höhere Prävalenz für Depression und Angst haben, hingegen Patienten mit einer höheren Bildung und einer physisch aktiven Freizeitgestaltung eher davor geschützt sind [Zhao et al. 2014]. Auch sollte in diesem Zusammenhang darauf hingewiesen werden, dass bei Patienten mit einem Prostatakarzinom mit niedrigem Risikoprofil und einer „aktiven Beobachtung“ (watchful waiting) als Therapie das Risiko für Depressionen und Angstzustände um den Faktor 2 bzw. 3 höher ist, als in einer gleichaltrigen, gesunden Population [Watts et al. 2015].
Ein weiterer großer Bereich von Langzeitnebenwirkungen betrifft den Einfluss von Strahlen- und Chemotherapie auf neurokognitive Funktionen. Aus Schätzungen geht hervor, dass fast 90% der Langzeitüberlebenden nach Krebs ein Fatigue-Syndrom entwickeln, das sich in einer eingeschränkten Aufmerksamkeit, Erinnerung und Informationsverarbeitungsgeschwindigkeit sowie einer generellen Müdigkeit und schlechten Schlafqualität der Patienten zeigt. Das Fatique-Syndrom kann auch erst Jahre nach der überstandenen Krebstherapie auftreten und die Lebensqualität stark einschränken [Clanton et al. 2011]. Etwa 40% der Langzeitüberlebenden nach Krebs sind von einem Fatigue-Syndrom betroffen und fühlen sich dadurch in ihrer allgemeinen Effizienz als auch in ihrer Lebensqualität stark eingeschränkt [Prasad et al. 2015]. Auch kommt es nach Chemotherapie und Bestrahlung gehäuft zum Auftreten von Taubheits- und Kribbelgefühlen, die für die Patienten sehr belastend sein können [Lewis et al. 2015].
Nicht nur viele Krebserkrankungen gehen mit starken Schmerzen einher, sondern auch die chirurgischen bzw. chemotherapeutischen Interventionen und Strahlenbehandlungen. Während in der akuten Phase fast alle Patienten von Schmerzen betroffen sind, entwickelt sich bei bis zu 40% der Langzeitüberlebenden nach Krebs ein chronisches Schmerzgeschehen [Glare et al. 2014]. Die Prävalenz für chronische Schmerzen hängt dabei von der Art der Krebserkrankung ab. So weisen zum Beispiel Brustkrebs und Kolon-Karzinome eine wesentlich höhere Inzidenz für chronische Schmerzen auf als andere Krebsformen [Glare et al. 2014]. In diesem Zusammenhang sollte allerdings berücksichtigt werden, dass eine Zunahme der Schmerzen bzw. Schmerzintensität bei Langzeitüberlebenden nach Krebs auch auf ein Rezidiv oder eine Zweit-Tumorerkrankung hindeuten kann, die es abzuklären gilt.
Morbidität und Co-Morbidität als Nebenwirkungen
Langzeitüberlebende nach einer Krebserkrankung zeigen ein erhöhtes Risiko an weiteren somatischen Erkrankungen und Co-Morbidität zu erkranken und zu leiden. Eine kürzlich publizierte Studie aus Dänemark zeigte, dass bei ungefähr jedem zehnten Patienten ein Zweit-Tumor auftritt. Allgemein lag die klinisch und sterblichkeitsrelevante Co-Morbidität bei 40%, verglichen mit 16% von gleichaltrigen Patienten ohne Tumorgeschichte [Hovaldt et al. 2015].
Die erhöhte Morbidität und Co-Morbidität von Langzeitüberlebenden nach Krebs ergibt sich häufig aus den therapiespezifischen unerwünschten Nebenwirkungen durch chirurgische, strahlentherapeutische und chemotherapeutische Maßnahmen sowie der Kombinationen aus diesen Therapien. Bei der Behandlung pädiatrischer Tumoren wird bei etwa der Hälfte der Patienten Chemotherapie allein und bei der anderen Hälfte Chemotherapie in Verbindung mit Strahlentherapie angewandt. Bei über 60% der Patienten tritt im Laufe der Zeit eine behandlungsbedingte somatische Erkrankung auf (Tabelle 3), wobei eine Korrelation mit dem Alter der Diagnose, der Bestrahlung des Herzens und dem Vorliegen bereits einer therapiebedingten Co-Morbidität besteht. Besonders betroffen vom Langzeiteinfluss einer onkologischen Behandlung sind die endokrinen Gewebe der Geschlechtsorgane (Hoden, Eierstöcke) und der Schilddrüse [Hogan et al. 2013; Kuehni et al. 2012].
therapiebedingte Folgeerkrankung |
Prävalenz [%] |
|---|---|
Endokrinopathie |
73 |
pulmonare Dysfunktion |
33 |
neurologische Störungen |
30 |
reduzierte Knochendichte |
20 |
Sekundärtumor |
17 |
Dyslipidämie |
16 |
kardiovaskuläre Erkrankungen |
11 |
Physische Leistungsfähigkeit und soziale Folgeerscheinungen
Sowohl die Krebserkrankung selbst als auch die onkologische Therapie stellt einen erheblichen Eingriff in die Physiologie des Betroffenen da, der unmittelbar als auch langfristig zu Beeinträchtigungen der täglichen physikalischen Leistungsfähigkeit führen kann. Die Einschränkung der physikalischen Leistungsfähigkeit betrifft vor allem die Bereiche der Mobilität und Kraft, wie zum Beispiel Aufzustehen, Bücken, Beugen, Knien, über die Kopfhöhe zu greifen, aus dem Bett aufzustehen, längere Strecken zu laufen oder schwere Hausarbeiten zu erledigen. Verglichen mit gleichaltrigen Patienten ohne Krebsgeschichte haben Langzeitüberlebende nach Krebs ein zweifach höheres Risiko an lebensrelevanten physikalischen Leistungseinschränkungen zu leiden [Ness et al. 2006; Hewitt et al. 2003]. Besonders betroffen von physikalischen Leistungseinschränkungen sind dabei Langzeitüberlebende nach Krebs im Kindesalter, wenn sie zwischen 40 und 49 Jahre alt sind [Ness et al. 2006] und Patienten, die eine Behandlung aus verschiedenen Therapiemaßnahmen, wie etwa radikaler Mastektomie in Kombination mit Bestrahlung erhalten haben [Sweeney et al. 2006]. Funktionale Einschränkungen können sich aber auch in anderen neuronalen Störungen äußern, wie etwa Wortfindungsstörungen, Gangstörungen oder Schluckstörungen, die zum Teil erst viele Jahre nach dem Ende der Krebsbehandlung auftreten [Van Ah, Tallman 2015; Snijders et al. 2007; Stegemann et al. 2012].
Aufgrund der psychosozialen Belastung und der Langzeitfolgen der Krebserkrankung und Behandlung wie etwa das Fatigue-Syndrom, chronischer Schmerzen, Depressionen und emotionale Labilität haben Patienten nach Krebserkrankungen oft Probleme im sozialen Umfeld und Schwierigkeiten, am Arbeitsleben teilzunehmen. Daraus können sich dann auch finanzielle Probleme ergeben [Burg et al. 2015]. Gerade aus der Kinderonkologie ist bekannt, dass die Langzeitüberlebenden oft von einer anhaltenden niedrigen Selbstwahrnehmung und einem niedrigen Selbstwertgefühl betroffen sind, die ihre Lebensqualität einschränkt [Hörnquist et al. 2015]. Langzeitüberlebende nach Krebs haben deshalb einen sehr hohen Bedarf an professioneller und glaubwürdiger Unterstützung sowie Information zur Krebserkrankung, den zu erwartenden gesundheitlichen Folgen und einer Langzeitbetreuung und Hilfe [Hörnquist et al. 2015; Burg et al. 2015].
Krebspatienten in der ambulanten Therapie
Neben der steigenden Anzahl der Langzeitüberlebenden nach Krebs entwickelt sich derzeit auch eine weitere onkologische Patientenpopulation: Durch die Einführung innovativer Therapeutika in die moderne Krebstherapie gibt es immer mehr ambulante Patienten, die unter den Nebenwirkungen dieser Therapien leiden. Wie aus Tabelle 4 ersichtlich, wurde in den vergangenen 15 Jahren – und vor allem in den vergangenen fünf Jahren – eine Vielzahl oraler Krebstherapeutika eingeführt. Dadurch verlagert sich die Durchführung der Arzneimitteltherapie bei Tumoren zunehmend vom stationären in den ambulanten Bereich. Die oralen Krebstherapeutika weisen zwar ein besseres Nebenwirkungsprofil auf als die klassischen Chemotherapeutika, haben aber nach wie vor ein sehr hohes Nebenwirkungsprofil, das einer besonderen Aufmerksamkeit und Beratung bedarf. Die Nebenwirkungen, ihre klinische Auswirkung sowie die Häufigkeit ihres Auftretens sind für jeden Wirkstoff und der angewendeten Dosierung spezifisch. Des Weiteren weisen viele der oralen Krebstherapeutika einen erheblichen Food-Effekt auf, der zu deutlich höheren oder niedrigeren Plasmaspiegeln führen kann [Weitschies 2014]. Verglichen mit Arzneimitteln für andere chronische Erkrankungen, wie etwa Bluthochdruck, ist bei oralen Krebstherapeutika mit einer wesentlich größeren Häufigkeit an klinisch und für die Lebensqualität des Patienten relevanten Nebenwirkungen zu rechnen [Brazzelli et al. 2013, Hauschild et al. 2012]. Für Patienten mit einer ambulanten, oralen Krebstherapie ist ein kompetenter und vertrauensvoller Ansprechpartner deshalb sowohl während als auch lange Jahre nach der onkologischen Erkrankung und Therapie dringlich erforderlich.
Arzneistoff |
Anwendung |
Darreichungsform |
|
|---|---|---|---|
2015 |
Panobinostat |
multiples Myelom |
Kapsel |
Palbociclib |
Brustkrebs |
Kapsel |
|
Lenvatinib |
Schilddrüsenkrebs |
Kapsel |
|
Sonidegib |
Basalzellkarzinom |
Kapsel |
|
2014 |
Ibrutinib |
Leukämie |
Kapsel |
Olaparib |
Leukämie, Lymphom |
Kapsel |
|
Ceritinib |
Lungenkrebs |
Kapsel |
|
2013 |
Afatinib |
Lungenkrebs |
Kapsel |
Ibrutinib |
Lymphom |
Kapsel |
|
Trametinib |
Melanom |
Tablette |
|
Pomalidomid |
Myelom |
Kapsel |
|
Lenalidomid |
Lymphom |
Kapsel |
|
Regorafenib |
Gastrointestinal-Tumor |
Tablette |
|
Dabrafenib |
Melanom |
Kapsel |
|
2012 |
Everolimus |
Nierenkrebs, Brustkrebs |
Tablette |
Bosutinib |
Leukämie |
Tablette |
|
Cabozantinib |
Schilddrüsenkrebs |
Kapsel |
|
Vismodegib |
Basalzellkarzinom |
Tablette |
|
Ponatinib |
Leukämie |
Tablette |
|
Axitinib |
Nierenzellkarzinom |
Tablette |
|
Regorafenib |
Kolonkarzinom |
Tablette |
|
Pazopanib |
Weichteilsarkom |
Tablette |
|
Enzalutamide |
Prostatakarzinom |
Kapsel |
|
2011 |
Sunitinib |
Pankreaskarzinom |
Kapsel |
Vandetanib |
Schilddrüsenkrebs |
Tablette |
|
Crizotinib |
Lungenkarzinom |
Kapsel |
|
Vemurafenib |
Melanom |
Tablette |
|
Abiraterone |
Prostatakarzinom |
Tablette |
|
Everolimus |
Pankreastumor |
Tablette |
|
2010 |
– |
– |
– |
2009 |
Pazopanib |
Nierenkarzinom |
Tablette |
Everolimus |
Nierenzellkarzinom |
Tablette |
|
2008 |
– |
– |
– |
2007 |
Nilotinib |
Leukämie |
Kapsel |
Lapatinib |
Brustkrebs |
Tablette |
|
2006 |
Dasatinib |
Leukämie |
Tablette |
Sunitinib |
Nieren- und GI-Tumor |
Kapsel |
|
2005 |
Sorafenib |
Nierenzellkarzinom |
Tablette |
2004 |
Erlotinib |
Lungenkrebs |
Tablette |
2003 |
Gefitinib |
Lungenkarzinom |
Tablette |
Alfuzosin |
Prostatakarzinom |
Tablette |
|
2002 |
Imatinib |
Gastrointestinal-Tumor |
Kapsel, Tablette |
2001 |
Letrozole |
Brustkrebs |
Tablette |
Imatinib |
Leukämie |
Kapsel, Tablette |
|
1995 – 2000 |
– |
– |
– |
Zusammenfassung und Ausblick
Patienten mit ambulanter Krebstherapie und Langzeitüberlebende nach Krebs werden in den kommenden Jahren zu einer wichtigen Patientengruppe in der öffentlichen Apotheke werden. Aufgrund der lebensbedrohlichen Natur der Erkrankung, der Belastung durch die Krankheit und der Therapie benötigen Krebspatienten eine langfristige professionelle und persönliche Unterstützung. Gerade die Apotheker sind prädestiniert, Krebspatienten und Langzeitüberlebende nach Krebs bei der Optimierung der Behandlung und des Therapieerfolges zu unterstützen und damit zur Verbesserung der Lebensqualität des Patienten beizutragen. |
Literatur
Aaronson NK, Mattioli V, Minton O, Weis J, Johansen C, Dalton SO, Verdonck-de Leeuw I, Stein KD, Alfonso CM, Mehnert A, de Boer A, van de Poll-Franse LV. Beyond treatment – psychosocial and behavioural issues in cancer survivoship research and practice. Eur J Cancer 2014;12(1):54-64
Brazzelli V, Grasso V, Borroni G. Imatinib, dasatinib and nilotinib: a review of adverse cutaneous reactions with emphasis on our clinical experience. J Eur Acad Dermatol Venol 2013;27:1471–1480
Burg MA, Adorno G, Lopez EDS, Loerzel V, Stein K, Wallace C, Sharma DGB. Current unmit neds of cancer survivors: Analysis of open-ended responses to the American cancer society study of cancer survivors II. Cancer 2015;121:623-630
Clanton NR, Klosky JL, Li C, Jain N, Srivatava DK, Mulrooney D, Zeltzer L, Stovall M, Robison LL, Krull KR. Fatigue, vitality, sleep, and neurocognitive functioning in adult survivors of childhood cancer. Cancer 2011;117:2559-2568
Creutzig U, Henze G, Bielack S, Herold R, Kaatsch P, Klussmann J-H, Graf N, Reinhardt D, Schrappe M, Zimmermann M, Jürgens H. Krebserkrankungen bei Kindern. Dtsch Äblatt 2003;100(13):A842–A852
Glare PA, Davies PS, Finlay E, Gulati A, Lemanne D, Moryl N, Oeffinger KC, Paice JA, Stubblefield MD, Syrjala KL. Pain in cancer survivors. J Clin Oncol 2014;32(16):1739-1747
Hauschild A, Grob J-J, Demodov LV, Jonary T, Gutzmer R et al.. Dabrafenib in BRAF-mutated metastatic melanoma: A multicenter, open-label, phase 3 randomised controlled trial. Lancet 2012;380:358-365
Hebdon M, Foli K, McComb S. Survivor in the cancer context: A concept analysis. J Adv Nurs 2015;71(8):1774-1786
Hewitt M, Roewland JH, Yancik R. Cancer survivors in the United States: Age, health, and disability. J Gerontol Med Sci 2003;58(1):82-91
Hörnquist L, Rickardsson J, Lannering B, Gustafsson G, Boman KK. Altered self-perception in adult survivors treated for a CNS tumor in childhood or adolescence: population-based outcomes compared with the general population. Neuro-Oncol 2015;17(5):733-740
Hogan M-J, Ma X, Kadan-Lottick NS. New health conditions identified at a regional childhood cancer survivor clini visit. Pediatr Blood Cancer 2013;60:682-687
Hovaldt HB, Suppli NP, Steding-Jessen M, Hansen DG, Møller H, Johansen C, Dalton SO. Who are the cancer survivors? A nationaide study in Denmark. 1943 – 2010. Brit J Cancer 2015;112:1549-1553
Kazanjian A, Smillie K, Howard AF, Ward A, Doll R. A structured approach to knowledge exchange: understanding the implementation of a cancer survivor program. Eur J Oncol Nurs 2012;16(4):399–405
Kuehni CE, Rueegg CS, Michel G, Rebholz CE, Strippoli M-PF, Niggli FK, Egger M, von der Weid NX. Cohort profile: The Swiss childhood cancer survivor study. Int J Epidemiol 2012;41:1553–1564
Lewis MA, Zhao F, Jones D, Loprinzi CL, Brell J, Weiss M, Fish MJ. Neuropathic symptoms and their risk factors in medical oncology outpatients with colorectal vs breast, lung, or prostate cancer: results from a prospective multicenter study. J Pain Symptom Manage 2015;49(6):1016-1024
Ness KK, Wall MM, Oakes JM, Robison LL, Gurney JG. Physical performance limitations and participation restrictions among cancer survivors: A population-based study. Ann Epidemiol 2006;16(3):197-205
Prasad PK, Hardy KK, Zhang N, Edelstein K, Srivastava D, Zeltzer L, Stovall M, Seibel NL, Leisenring W, Armstrong GT, Robison LL, Krull K. Psychosocial and neurocognitive outcomes in adults survivors of adolescent and early young adult cancer: A report from the childhood cancer survivor study. J Clin Oncol 2015;23(10):2545-2552
Robert Koch Institut. Krebs in Deutschland 2009/2010, www.krebsdaten.de/Krebs/DE/Content/Publikationen/Krebs_in_Deutschland/kid_2013/krebs_in_deutschland_2013.pdf?__blob=publicationFile)
Siu M, Catton P, Jones J, Jadad AR. A pilot study examining the unmet needs of cancer survivors living with polypathology. Curr Oncol 2013;20(3):266–269
Snijders AH, van de Warrenburg BP, Giladi N, Bloem BR. Neurological gait disorders in elderly people: clinical approach and classification. Lancet Neurol 2007;6:63-74
Stegemann S, Gosch M, Breitkreutz J. Swallowing dysfunction and dysphagia is an unrecognized challenge for oral drug therapy. Int J Pharm 2012;430:197-206
Sweeney C, Schmitz KH, Lazovich D, Virnig BA, Wallace RB, Folsom AR. Functional limitations in elderly female cancer survivors. J Nat Cancer Inst 2006;98(8) 521-529
Von AhD, Tallman EF. Perceived cognitive function in breast cancer survivors: Evaluating relationships with objective cognitive performance and other symptoms using the functional assessment of cancer therapy-cognitive function instrument. J Pain Sympt Managem 2015;49(4):697-706
Watts S, Leydon G, Eyles C, Moore CM, Richardson A, Birch B, Prescott P, Powell C, Lewith G. A quantitative analysis of the prevalence of clinical depression and anxiety in patients with prostate cancer undergoing active surveillance. BMJ Open 2015;5:e006674
Weitschies W. Orale Bioverfügbarkeit onkologischer Präparate. Urologe 2014;53:1772-1778
Zebrack B A patient-centered perspective on cancer survivorship. J Pers Med 2015;5:91–95
Zhao G, Okoro CA, White A, Dhingra S, Li C. Current depression among adult cancer survivors: findings from the 2010 behavioural risk factor surveillance system. Cancer Epidemiol 2014;38:757–764
Autor
Sven Stegemann ist Professor für Patientenzentrierte Medikamentenentwicklung und Produktionstechnologie an der Technischen Universität Graz und Präsident der Geriatric Medicine Society.
Univ.-Prof. Dr. Sven Stegemann, Technische Universität Graz, Institut für Prozess- und Partikeltechnik, Inffeldgasse 13, A-8010 Graz





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.