
- DAZ.online
- DAZ / AZ
- DAZ 36/2017
- Die Insulin-Tablette – ...
Arzneimittel und Therapie
Die Insulin-Tablette – ein neuer Versuch
Innovative Darreichungsform kann trotz positiver Studienergebnisse nicht überzeugen
Die Entwicklung alternativer Applikationswege für die Verabreichung von Insulin beschäftigt seit Jahren unzählige Forschungsgruppen in Hochschule und Industrie. So ziemlich jede mögliche Applikationsroute wurde in den vergangenen Jahren im Rahmen von Laborversuchen oder auch Proof-of-Concept Studien getestet, darunter zum Beispiel die orale Applikation als Tablette, die nasale Applikation als Pulver oder auch die transdermale Applikation unter Zuhilfenahme der Sonophorese. Doch Erfolg im Sinne eines etablierten Marktproduktes hatte keine der oft viel gepriesenen Technologien.
Die Geschichte von Exubera®, dem inhalierbaren Insulin von Pfizer, ist hinreichend bekannt. Es schaffte zwar nach vielen Jahren Entwicklungszeit den Markteintritt, wurde aber nach nicht einmal zwei Jahren vom Unternehmen selbst aus wirtschaftlichen Gründen wieder vom Markt genommen. In den letzten Wochen haben etlichen Medien über die neuesten und recht positiven Studienergebnisse einer oralen Insulinzubereitung der Firma NovoNordisk berichtet. Doch auch hier wird das Unternehmen die Anstrengungen wohl nicht weiter verfolgen. Grund genug, an dieser Stelle einmal genauer die wieder mal aktuelle Thematik der alternativen Applikation von Insulin zu betrachten.
Die Machbarkeitsstudie
Bereits im Juni 2017 präsentierte der dänische Pharmakonzern NovoNordisk im Rahmen des 77. Wissenschaftlichen Meetings der American Diabetes Association in San Diego (Kalifornien, USA) Daten aus einer achtwöchigen Machbarkeitsstudie zu einem peroral als Tablette verabreichten Basalinsulin für Patienten mit Typ-2-Diabetes. Die doppelblinde, placebokontrollierte Studie untersuchte die einmal tägliche Gabe des oralen Insulin 338 von NovoNordisk im Vergleich zu einer einmal täglichen subkutanen Injektion von Insulin glargin (Lantus®, Sanofi-Aventis) an 50 Studienteilnehmern, die in zwei Gruppen randomisiert wurden. Die Probanden der Gruppe 1 erhielten das orale Insulin 338 in Form einer speziell formulierten Tablette und zusätzlich ein subkutan injiziertes Placebo. Die Startdosis des oralen Insulin 338 wurde auf 2700 nmol festgelegt. Eine tägliche Maximaldosis von 16.200 nmol war erlaubt. Das orale Insulin 338 wurde in Tabletten mit unterschiedlichen Stärken einmal täglich mit 100 ml Wasser eingenommen. Die Probanden der Gruppe 2 erhielten das Basalinsulin Insulin glargin als subkutane Injektion und zusätzlich eine Placebo-Tablette. Dis Startdosis an Insulin glargin betrug 10 Einheiten. Eine tägliche Maximaldosis von 60 Einheiten war erlaubt. Bei beiden Gruppen fand eine Anpassung der Insulin-Dosis einmal pro Woche statt. Dabei wurde für beide Präparate der gleiche Titrationsalgorithmus unter Annahme, dass eine Dosis von 2.700 nmol des oralen Insulin 338 einer Dosis von 10 Einheiten subkutanem Insulin glargin entspricht, zugrunde gelegt. Die Dosisanpassung basierte auf dem Mittelwert der Blutzuckermessungen vor Dosisgabe an drei aufeinanderfolgenden Tagen [1].
Gewusst wie!
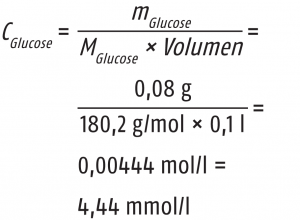
Blutzuckerwerte können in unterschiedlichen Maßeinheiten angegeben werden. Während in den meisten Ländern die molare Konzentration mit der Einheit mmol/l verwendet wird, findet man in Deutschland oder auch den USA die Angabe als Massenkonzentration mit der Einheit mg/dL. Die Umrechnung ist ganz einfach und soll hier einmal an einem Beispiel erklärt werden. Alles, was dazu notwendig ist, ist das Molekulargewicht von Glucose mit 180,2 g/mol.
Ein Patient hat beispielsweise einen Blutzuckerspiegel von 80 mg/dl. Wir wissen, dass 80 mg auch 0,08 g und 1 dl auch 0,1 l sind. Somit berechnet sich die molare Konzentration in mmol/l dann nach:
Verallgemeinert gilt für die Umrechnung der Messwerte in die unterschiedlichen Einheiten:
Messwert [mg/dl] × 0,0555 = Messwert [mmol/l]
Messwert [mmol/l] × 18,02 = Messwert [mg/dl]
Tablettenformulierung mit Penetrations-Enhancer
Die spezielle Tablettenformulierung, die im Rahmen der Studie eingesetzt wurde, bedient sich der patentierten Plattform-Technologie GIPET. Die Technologie wurde ursprünglich von der irischen Firma Merrion Pharmaceuticals entwickelt und in 2015 an NovoNordisk auslizenziert. GIPET steht allgemein für „Gastrointestinal Permeation Enhancement Technology“ und beinhaltet drei unterschiedliche magensaftresistente Formulierungen mit oberflächenaktiven Hilfsstoffen zur Verbesserung der Permeabilität von Makromolekülen im Dünndarm. Die laut Studieninformation von NovoNordisk verwendete Formulierung GIPET I enthält als penetrationsfördernden Hilfsstoff in der Regel das Natriumsalz der gesättigten Fettsäure Caprinsäure (C10), welche sich vom Alkan n-Decan ableitet und deshalb auch Decansäure genannt wird [2]. Es wird angenommen, dass es aufgrund der oberflächenaktiven Wirkung des Hilfsstoffs zu einer Zunahme der apikalen Membranfluidität und somit zum gesteigerten transzellulären Transport pharmazeutischer Wirkstoffmoleküle kommt [3]. Zusätzlich wird in der Literatur auch ein gesteigerter parazellulärer Transport beschrieben, der durch eine Kontraktion der Aktinfilamente des Zytoskeletts und damit in Folge durch Öffnen der Tight Junctions zustande kommen soll [4 – 6]. Das magensaftresistente Coating der Tablettenformulierung soll dabei, gerade bei Peptiden und Proteinen, diese vor dem pH-Wert und den Enzymen des Magens schützen und zusätzlich ermöglichen, dass nach Magenpassage durch schnelle Freisetzung von Penetrationsenhancer und Wirkstoff hohe Konzentrationen beider Komponenten am Epithel des oberen Dünndarms vorliegen und somit die Wirkstoffpenetration gesteigert wird. Es wird angenommen, dass es durch die gemeinsame Freisetzung von Wirkstoff und oberflächenaktivem Penetrationsenhancer zu einer Anreicherung des freigesetzten Wirkstoffs in mizellaren Strukturen kommt, die dann als Drug-Delivery-Vehikel fungieren. Der Wirkstoff würde somit stärker lipophile Eigenschaften erhalten und in gewissem Maß vor enzymatischem Abbau geschützt bleiben. Auf diesem Wege soll allgemein die Membranpermeabilität für größere und/oder geladene Moleküle verbessert werden [3].
Die Ergebnisse
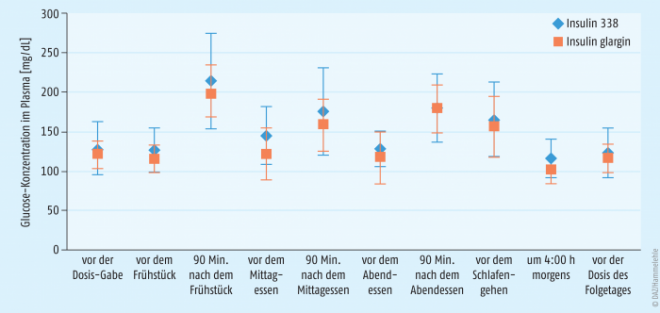
Die Ergebnisse der Machbarkeitsstudie zeigten für den primären Endpunkt, der Glucose-Konzentration im Plasma im nüchternen Zustand nach acht Wochen Behandlung, keine statistisch signifikanten Unterschiede zwischen den beiden Studiengruppen. Die perorale Gabe der Tablettenformulierung des Insulin 338 senkte die Plasmaglucose von initial 175 mg/dl (9,7 mmol/l) auf 129 mg/dl (7,18 mmol/l). Unter Insulin glargin sanken die Werte von initial 165 mg/dl (9,13 mmol/l) auf 121 mg/dl (6,71 mmol/l). Der HbA1c-Anteil war beim oralen Insulin 338 von 8,1% auf 7,3% und beim subkutanen Insulin glargin von 8,2% auf 7,1% gefallen. Zusätzlich zeigt Abbildung 1 das 10-Punkte-Profil der Plasmaglucose-Konzentration nach acht Wochen Behandlung. Gemäß den veröffentlichten Studienergebnissen kam es über den Zeitraum des Monitorings der Studie unter dem oralen Insulin 338 zu sieben behandlungsbedürftigen hypoglykämischen Episoden, unter Insulin glargin zu elf [1].
Die von NovoNordisk durchgeführte Machbarkeitsstudie kann auf Basis der publizierten Ergebnisse als durchaus positiv angesehen werden. Das orale Insulin 338 unter Verwendung der GIPET I-Formulierung wurde gut vertragen und war dem Insulin glargin nicht unterlegen. Dennoch hat nach Medienangaben NovoNordisk die Entwicklung dieser Formulierung inzwischen eingestellt. Grund hierfür ist die schlechte Bioverfügbarkeit von lediglich 2% der oral verabreichten Insulin-338-Formulierung [7]. Diese niedrige Bioverfügbarkeit treibt die notwendigen Investitionskosten so stark nach oben, dass sich eine kommerzielle Massenherstellung wirtschaftlich nicht rechnet [7, 8]. |
Literatur:
[1] EU Clinical Trials Register. EudraCT number: 2014-002716-16. An 8-week randomised, double-blind, parallel, multiple dose trial comparing NNC0123-0000-0338 in a tablet formulation and insulin glargine in subjects with type 2 diabetes currently treated with oral antidiabetic therapy. (https://www.clinicaltrialsregister.eu).
[2] Cumming KI, Ramtoola Z. Solid oral dosage form containing an enhancer. United States Patent. Patent No.: US 7,658,938 B2; Date of patent: Feb. 9, 2010.
[3] Walsh EG, Adamczyk BE, Chalasani KB, Maher S, O‘Toole EB, Fox JS, Leonard TW, Brayden DJ. Oral delivery of macromolecules: rationale underpinning Gastrointestinal Permeation Enhancement Technology (GIPET). Ther Deliv. 2011 Dec;2(12):1595-610.
[4] Metha N, Stern W. Technologie for Orla Delivery of Peptides. In “Peptide-based Drug Discovery.” Editor Ved Srivastava. The Royal Society of Chemistry 2017.
[5] Anderberg EK, Lindmark T, and Artursson P. Sodium caprate elicits dilations in human intestinal tight junctions and enhances drug absorption by the paracellular route. Pharmaceutical Research. 10, 857-864 (1993).
[6] Tomita M, Shiga M, Hayashi M, and Awazu S. Enhancement of colonic drug absorption by the paracellular permeation route. Pharmaceutical Research. 5, 341-346 (1988).
[7] Cowen L. The ADA Presidents Oral Session: Tuesday 13th June. medwireNews 16.06.2017, Springer Healthcare 2017 (https://diabetes.medicinematters.com).
[8] Bublak R, Geissel W. Prinzipiell ist Insulin auch als Tablette möglich. Ärzte Zeitung Online, 06.07.2017 (https://www.aerztezeitung.de).





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.