
- DAZ.online
- DAZ / AZ
- DAZ 49/2018
- „Nicht zum Kausalitä...
Arzneimittel und Therapie
„Nicht zum Kausalitätsnachweis geeignet“
Eine kritische Wertung der Datenlage vor dem Hintergrund der Heneghan-Studie
Als Schwangerschaftstest wurde je ein Dragee oder eine Ampulle an zwei aufeinanderfolgenden Tagen verabreicht. Trat im Folgenden keine Blutung auf, lag wahrscheinlich eine Schwangerschaft vor.
Wirkstoffe weiterhin zugelassen
Die in Duogynon® enthaltenen Wirkstoffe, das Estrogen Ethinylestradiol und die Gestagene Progesteron und Norethisteron, sind bis heute weltweit in zahlreichen Präparaten, vor allem hormonellen Kontrazeptiva, zugelassen. Ethinylestradiol ist in „Kombinationspillen“ mit 0,02 bis 0,035 mg, Norethisteron mit bis zu 1 mg sowie in „Drei-Monats-Spritzen“ mit 200 mg enthalten. Progesteron wird, mit bis zu 600 mg täglich, zur Fehlgeburtsprophylaxe eingesetzt.
In einer 1967 veröffentlichten Studie wurde erstmals die Vermutung geäußert, dass hormonelle Schwangerschaftstests mit Neuralrohrdefekten assoziiert sein könnten (Gal et al 1967). In den folgenden Jahren kamen viele weitere Studien zu heterogenen Ergebnissen hinsichtlich eines Zusammenhangs zwischen verschiedenen angeborenen Fehlbildungen und der mütterlichen Exposition gegenüber Estrogen-Progesteron-Kombinationspräparaten während der Frühschwangerschaft.
Es liegt bisher kein plausibler Schädigungsmechanismus für Duogynon® vor [Brent 2005]. Auch tierexperimentelle Studien haben keine derartigen Effekte gezeigt [Hendrickx et al 1987].
BfArM- und MHRA-Daten: Kausalität unwahrscheinlich
2014 wurden von Tümmler et al in einer Studie 296 Patienten und Patientinnen mit angeborenen Fehlbildungen nach Anwendung von Duogynon® eingeschlossen, die zwischen 1957 und 1983 geboren worden waren. Dabei handelt es sich um Fälle, die dem Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) bis 2012 gemeldet worden waren. Zu berücksichtigen ist, dass auf Beobachtungsdaten zurückgegriffen wurde, die lange zurückliegende Verhältnisse beschreiben, bei denen weder die Exposition hinsichtlich Zeitpunkt und Dosis noch zahlreiche für den Schwangerschaftsausgang relevante Angaben verifiziert werden konnten, wie beispielsweise mütterliche Charakteristika. Im Rahmen einer Disproportionalitätsanalyse wurden die relativen Häufigkeiten der von Fehlbildungen betroffenen Organsysteme zwischen der Duogynon-Gruppe und einer nicht exponierten Vergleichsgruppe betrachtet. Da zeitgleich in der damaligen BRD kein Fehlbildungsregister mit ausreichend großen Fallzahlen etabliert war, wurde auf die Daten des Fehlbildungsmonitorings Sachsen-Anhalt an der Universitätsklinik Magdeburg in der DDR zurückgegriffen. Für fünf verschiedene Fehlbildungsgruppen beziehungsweise Fehlbildungen ergaben sich statistisch signifikante Unterschiede gegenüber der Vergleichsgruppe. Diese betreffen Neuralrohrdefekte (OR = 2,99; 95% CI 1,85 – 4,84), orofaziale Spalten (OR = 1,59; 95% CI 1,05 – 2,40), Fehlbildungen des Skeletts und der Extremitäten (OR = 1,95; 95%-CI 1,53 – 2,49), Nierenagenesie (OR = 2,53; 95% CI 1,17 – 5,45) und Blasenekstrophie (OR = 37,27; 95% CI 14,56 – 95,28). Diese signifikanten Unterschiede bei den relativen Häufigkeiten können nicht ohne Weiteres als Hinweise auf Kausalität interpretiert werden.
Einerseits ist aufgrund fehlender Angaben zu Faktoren mit potenziellem Einfluss auf das Schwangerschaftsergebnis (Familienanamnese, teratogene Koexpositionen, mütterliche Charakteristika etc.) keine Adjustierung auf Störgrößen möglich. Andererseits könnten die beobachteten Unterschiede bei der Verteilung der Fehlbildungsarten Ergebnis einer Verzerrung im Sinne eines Selektions-, Informations- oder Recall-Bias sein.
Am wahrscheinlichsten ist eine selektive Berichterstattung an das BfArM nach Veröffentlichung von Berichten zu bestimmten Fehlbildungen, wie beispielsweise der Blasenekstrophie, im Zusammenhang mit Duogynon®. Entsprechend Erkrankte wurden nach Thematisierung eines möglichen Zusammenhangs motiviert, sich zu melden. Allerdings konnten wegen der methodischen Unzulänglichkeiten die Falldaten aber auch nicht dazu genutzt werden, Duogynon® als unbedenklich zu bezeichnen. Ein teratogener Effekt wurde jedoch als unwahrscheinlich angesehen, zumal es auch keine Hinweise auf eine Abnahme der Prävalenz von Blasenekstrophien nach Marktrücknahme von Duogynon® gibt.
Auf Veranlassung der britischen Medicines and Healthcare Products Regulatory Agency (MHRA) wurde 2017 eine neue Bewertung der Datenlage von einer Expertengruppe publiziert, die aufgrund des insuffizienten und inhomogenen Datenmaterials einen ursächlichen Zusammenhang zwischen dem hormonellen Schwangerschaftstest und kongenitalen Anomalien nicht bestätigen konnte (EWG 2017).
Neue Analyse mit alten Daten
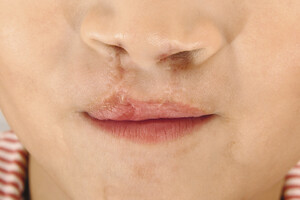
Eine Arbeitsgruppe um Prof. Carl Heneghan (Director of the Centre for Evidence-Based Medicine University of Oxford) führte nun aktuell eine Metaanalyse auf der Basis von 16 Fall-Kontroll-Studien und zehn prospektiven Kohortenstudien durch [Heneghan et al 2018]. Unter 71.330 Fällen befinden sich in dieser Auswertung 4209 Frauen nach hormonellem Schwangerschaftstest. Unter Zusammenführung aller Fälle zeigt sich statistisch ein Anstieg des allgemeinen Fehlbildungsrisikos um 40% (OR = 1,40; 95% CI 1,18 – 1,66). Bei Betrachtung einzelner Organsysteme findet man einen signifikanten Anstieg von Herzfehlern (OR = 1,89; 95% CI 1,32 – 2,72), ZNS-Anomalien (OR = 2,98; 95% CI 1,32 – 6,76), muskuloskelettalen Defekten (OR = 2,24, 95% CI 1,23 – 4,08) und VACTERL-Syndrom (OR = 7,47; 95% CI 2,92 – 19,07). Die häufig diskutierte Zunahme urogenitaler Fehlbildungen konnte statistisch nicht bestätigt werden.
Die Autoren sehen die Stärke ihrer Analyse in der hohen Fallzahl mit entsprechend größerer Aussagekraft. Dabei muss man allerdings berücksichtigen, dass auf sehr inhomogene und sicherlich heutigen Standards nicht entsprechende Publikationen aus den 1960er- und 70er-Jahren zurückgegriffen wird. Bei Sichtung einzelner Quellen fällt auf, dass dort teilweise weder das Kollektiv noch die Methodik der Erfassung näher beschrieben wird. Betrachtet man z. B. die verwendeten Publikationen aus Deutschland, kann man eine mehrfache Erfassung derselben Fälle nicht ausschließen. Auch die Differenzierung der Fehlbildungen nach Organsystemen ist nur teilweise verfügbar.
Die Metaanalyse basiert überwiegend auf Fall-Kontroll-Studien. Kinder mit Fehlbildungen werden hier retrospektiv mit gesunden Kindern im Hinblick auf Risikofaktoren verglichen. Dass bei Fällen mit Anomalien häufiger ein Schwangerschaftstest erfolgte, kann auch mit unklaren Blutungen bei nicht intakten Schwangerschaften zusammenhängen. Eine Kausalität zwischen hormonellem Schwangerschaftstest und Fehlbildung lässt sich damit keinesfalls nachweisen. Auch die Inhomogenität der registrierten Fehlbildungen wirft Fragen bezüglich eines ursächlichen Zusammenhangs auf. Die immer wieder postulierte Zunahme einer Blasenekstrophie lässt sich in dieser großen Metaanalyse nicht nachvollziehen. Unter den eingeschlossenen Studien findet sich auch die sehr umfassende Auswertung der deutschen Fehlbildungsfälle zu Duogynon® von 2014 (Tümmler et al 2014). Dabei weisen die Autoren auf die Grenzen ihrer Analyse aufgrund des historischen Datenmaterials hin. Diese selbstkritische Perspektive vermisst man leider bei der neuen Auswertung aus Oxford.
Diskussion neu entfacht
Die Publikation der Arbeitsgruppe um Prof. Carl Heneghan wird sicherlich die Diskussion um eine embryonale Schädigung durch Duogynon® wieder aufleben lassen. Die Ergebnisse müssen ernsthaft diskutiert werden, doch werden die teilweise schwer rekonstruierbaren historischen Daten nicht allein dadurch besser, dass man sie gepoolt einer umfangreichen statistischen Analyse unterwirft. |
Literatur:
[1] Brent RL Nongenital malformations following exposure to progestational drugs: the last chapter of an erroneous allegation. Birth Defects Res A Clin Mol Teratol. 2005;73(11):906-918
[2] Expert Working Group (EWG): Report of the Commission on Human Medicines’ Expert Working Group on Hormone Pregnancy Tests. GOV.UK. (Published 15 November 2017, Last updated 5 February 20189
[3] Gal I et al. Hormonal pregnancy tests and congenital malformation. Nature. 1967;216(5110):83
[4] Hendrickx AG et al. Embryotoxicity of sex steroidal hormone combinations in nonhuman primates: I. Norethisterone acetate + ethinylestradiol and progesterone + estradiol benzoate (Macaca mulatta, Macaca fascicularis, and Papio cynocephalus). Teratology. 1987;35(1):119-127
[5] Heneghan C, Aronson JK, Spencer E et al. Oral hormone pregnancy tests and the risks of congenital malformations: a systematic review and meta-analysis. F1000Research 2018,7:1725
[6] Tümmler G, Rißmann A, Meister R, Schaefer C. Congenital bladder exstrophy associated with Duogynon hormonal pregnancy tests-signal for teratogenicity or consumer report bias? Reprod Toxicol 2014 Jun;45:14-9






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.