
- DAZ.online
- DAZ / AZ
- DAZ 16/2019
- Entwarnung für Phthalate
Toxikologie
Entwarnung für Phthalate
Keine Assoziation mit Brustkrebs
Phthalate sind weitverbreitet, in Europa werden pro Jahr etwa eine Million Tonnen produziert. Sie werden Kunststoffen zugesetzt, um sie gebrauchsfähig zu machen (Weichmacher), werden aber auch in anderen Bereichen verwendet, etwa als Lösungsmittel in Farben oder in Körperpflegeprodukten und Kosmetika. Bereits Mitte der 1980er-Jahre begann die Diskussion über hormonartige Wirkungen dieser ubiquitär vorhandenen Chemikalien. Im Urin des Menschen lassen sich Phthalate und ihre Metaboliten bereits seit Langem nachweisen. Obwohl sie sich durch eine geringe akute Toxizität auszeichnen, bestehen Bedenken wegen der möglichen Wirkungen auf die Reproduktionsorgane. Jene Verbindungen, die in dieser Hinsicht eine relativ hohe Potenz aufweisen, wurden verboten. Diethylhexylphthalat (DEHP) ist die bekannteste Verbindung aus dieser Gruppe (Abb. 1). Es wirkt nicht als Antagonist am Androgenrezeptor, sondern hemmt im Hodengewebe von Rattenfeten – genauer: in den Leydig-Zellen – die Testosteron-Synthese. Nach der mehrtägigen, perinatalen Verabreichung von 750 mg/kg Körpergewicht sind die Gewichte der Hoden bei den neugeborenen Ratten um ca. 35% reduziert [Gray et al. 2000]. Diisononylphthalat (DiNP) verursacht im Tierexperiment dagegen auch bei sehr hohen Dosierungen weder Fehlbildungen noch Gewichtsveränderungen an den Reproduktionsorganen. Es wurde im vergangenen Jahr vom Committee for Risk Assessment (RAC) der Europäischen Chemikalienagentur (ECHA) im Gegensatz zu DEHP und einigen anderen Phthalaten nicht als reproduktionstoxisch bewertet [ECHA, 2018], allerdings ist eine Verwendung des Stoffes in Kinderspielzeug ebenso wie für einige andere Phthalate bereits seit Längerem verboten. DEHP ist als reproduktionstoxisch Kategorie 1B klassifiziert, DiNP ist nicht klassifiziert (Tab. 1).
Abkürzung |
Phthalat |
ECHA-Einstufung/Kennzeichnung |
Verbot in Spielzeug* |
|---|---|---|---|
DMP |
Dimethylphthalat |
||
DEP |
Diethylphthalat |
||
BBzP |
Butylbenzylphthalat |
1B / H360Df |
X |
DiBP |
Diisobutylphthalat |
1B / H360Df |
|
DnBP |
Di-n-butyl-phthalat |
1B / H360Df |
X |
DCHP |
Dicyclohexylphthalat |
||
DnPeP |
Di-n-pentylphthalat |
1B / H360FD |
|
DEHP |
Di-(2-ethylhexyl)-phthalat |
1B / H360FD |
X |
DiNP |
Diisononylphthalat |
keine Klassifizierung |
X |
DiDP |
Diisodecylphthalat |
X |
|
DPHP |
Dipropylheptylphthalat |
||
DnOP |
Di-n-octyl-phthalat |
X |
|
Kategorie 1A/B: Kann die Fruchtbarkeit beeinträchtigen (F) oder das Kind im Mutterleib schädigen (D). Einstufung auf der Basis von Humandaten (A) oder Tierstudien (B). Kategorie 2: Kann vermutlich die Fruchtbarkeit beeinträchtigen (f) oder das Kind im Mutterleib schädigen (d). keine Klassifizierung: keine ausreichende Evidenz für Kategorie 1 oder 2 * Verbot in Spielzeug EG 1907/2006 (Anhang XVII) | |||
Phthalate sind Diester, die im menschlichen Organismus rasch in die Säure- und Alkoholkomponente gespalten werden. Zunächst entstehen die Monoester, daraus können durch oxidativen Stoffwechsel zahlreiche Metaboliten entstehen, die überwiegend glukuronidiert und mit dem Urin ausgeschieden werden. Urin ist daher besser als Blutplasma geeignet, um Informationen zur Phthalat-Exposition zu erhalten. Das Ausmaß der Glukuronidierung bleibt bei solchen Analysen unberücksichtigt – die Proben werden vor der Analyse mit Glukuronidase versetzt. Im Gegensatz zum Menschen erfolgt bei Ratten keine Glukuronidierung.
Auswertung der Umweltprobenbank
Um die Exposition des Menschen zu erfassen und die Wirksamkeit der regulatorischen Maßnahmen zu überprüfen, wurden in drei retrospektiven Studien etwa 1200 archivierte 24-Stunden-Sammelurinproben der Umweltprobenbank auf Primär- und Sekundärmetaboliten von einem Dutzend Phthalaten untersucht. Der Tabelle 1 kann auch die Einstufung der Phthalate durch die Europäische Chemikalienagentur ECHA entnommen werden.
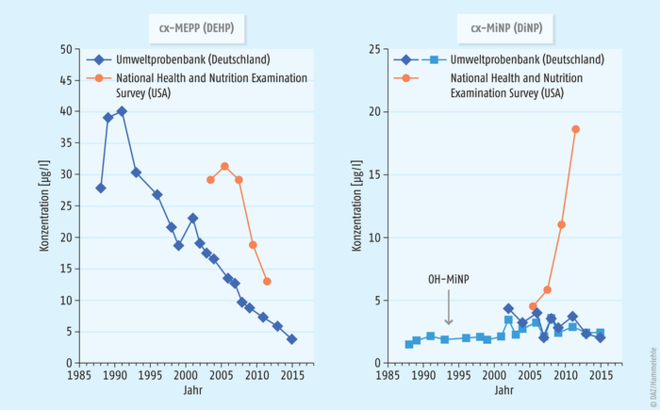
Die Exposition der Bevölkerung gegenüber DEHP und anderen Phthalaten ist seit Jahren rückläufig. Die Konzentrationen anderer Phthalate, die als Ersatz verwendet werden, blieben konstant oder steigen. Dies zeigen die Ergebnisse von Analysen menschlicher Urinproben aus der Umweltprobenbank (24-Stunden-Sammelurin) (Abb. 2). Die Daten belegen, dass in Deutschland – im Gegensatz zu den USA – offenbar DiNP nur zu einem geringen Teil als Ersatzstoff für DEHP verwendet wird. Die Analysen aus dem US-amerikanischen NHANES-Projekt zeigen einen deutlichen Anstieg des Metaboliten cx-MiNP, was auf eine zunehmende DiNP-Exposition hinweist. Wie andere Untersuchungen zeigten, nimmt hierzulande dagegen die Exposition gegenüber DINCH (Diisononyl-1,2-cyclohexan-dicarbonsäure), einem nichtaromatischen Weichmacher ohne Phthalat-Struktur, zu [Schütze et al. 2014].
Gibt es eine Assoziation mit Brustkrebs?
Die Liste der Gesundheitsschäden beim Menschen, die mit einer Phthalat-Exposition in Verbindung gebracht werden, ist lang. Das steht im Widerspruch zu den Effekten, die sich im Tierexperiment eindeutig auslösen lassen. Es ist bekannt, dass epidemiologische Untersuchungen zur Wirkung von Phthalaten sehr störanfällig sind. Eine Ursache ist die hohe Variabilität der Exposition, da Phthalate in verschiedenen Lebensmitteln in unterschiedlichen Konzentrationen nachgewiesen werden können. Ein weiterer Faktor ist die individuelle Variabilität im Metabolismus und der Elimination der Fremdstoffe. Wenn nur eine Urinprobe untersucht wird, resultiert eine Momentaufnahme, aber kein realistisches Abbild der wahren Exposition. In besser konzipierten Studien wird daher ein 24-Stunden-Sammelurin untersucht oder es werden mehrere Proben der gleichen Person analysiert.
Neben den Störungen der Reproduktion sollen Phthalate auch verantwortlich sein für Krankheiten wie Asthma, Autismus, Diabetes und andere. Es ist daher wenig überraschend, dass etliche epidemiologische Studien durchgeführt wurden, um der Frage einer möglichen Assoziation zwischen einer erhöhten Phthalat-Exposition und Brustkrebs nachzugehen [Zuccarello et al. 2018]. Anlass für die epidemiologischen Studien sind In-vitro-Experimente, die zeigen, dass einige Phthalate sich agonistisch oder antagonistisch an Estrogen-Rezeptoren verhalten [Zacharewski et al. 1998, Takeuchi et al. 2005]. Obwohl diese Effekte erst bei hohen Konzentrationen auftraten, wurden sie von einigen Untersuchern dennoch als relevant angesehen. In Tierversuchen wurde kein erhöhtes Risiko für Mammakarzinome durch Phthalate beobachtet.
Phthalate und Brustkrebs – überwiegend retrospektive Studien
Die erste Studie wurde 2007/2008 in Mexiko durchgeführt und wenig später veröffentlicht [López-Carrillo et al. 2010]. Mit 233 Brustkrebs-Patientinnen und 221 gesunden Frauen als Kontrollgruppe wurden zunächst Interviews geführt, um anamnestische und soziodemografische Angaben zu erhalten. Alle Studienteilnehmerinnen stellten dann eine Urinprobe zur Verfügung, die auf den Gehalt von insgesamt 13 Phthalat-Metaboliten untersucht wurde. Die Konzentration von Monoethylphthalat (MEP) war höher bei den erkrankten Frauen als bei den gesunden: Die geometrischen Mittelwerte in beiden Gruppen betrugen 170 µg Monoethylphthalat/g Kreatinin und 107 µg Monoethylphthalat/g Kreatinin. Die gesamte Spannbreite der Werte reichte von etwa 9 µg Monoethylphthalat/g Kreatinin bis fast 19.000 µg Monoethylphthalat/g Kreatinin. Üblicherweise erfolgt die Angabe der Konzentration in Relation zum Kreatinin-Gehalt des Urins – so lassen sich Verdünnungseffekte ausgleichen, die durch unterschiedliche Trinkmengen hervorgerufen werden. Interessanterweise fanden die Untersucher auch statistisch signifikante negative Assoziationen. Für die Metaboliten MBzP (Monobenzylphthalat) und MCPP (Mono[3-carboxypropyl]-phthalat) wurden bei den Kontrollen höhere Konzentrationen ermittelt als bei den erkrankten Frauen (Tab. 2). Bei den Abbauprodukten der übrigen Phthalate unterschieden sich die Konzentrationen zwischen den Gruppen statistisch nicht signifikant. Es bleiben also mehr Fragen offen, als durch diese Studie beantwortet werden konnten. Folgerichtig schreiben die Autoren, dass die Ergebnisse in weiteren Studien bestätigt werden müssen, bevor wesentliche Schlüsse daraus gezogen werden können.
Jahr |
Land |
Phthalat-Analytik |
Anzahl der Studienteilnehmerinnen |
signifikante Assoziation mit (Metabolit) |
Autor |
|---|---|---|---|---|---|
2010 |
Mexiko |
13 Metaboliten im Urin |
233 Patientinnen
221 Kontrollen
|
positive Assoziation mit MEP
negative Assoziation mit MBzP
negative Assoziation mit MCPP
|
López-Carrillo et al. |
2014 |
USA (Alaska) |
10 Metaboliten im Urin |
75 Patientinnen
95 Kontrollen
|
positive Assoziation mit MEHP |
Holmes et al. |
2017 |
USA |
8 Metaboliten im Urin |
97 Patientinnen
2731 Kontrollen
|
keine Assoziation |
Morgan et al. |
2018 |
USA (Long Island) |
9 (11) Metaboliten im Urin |
710 Patientinnen
598 Kontrollen
|
keine Assoziation |
Parada et al. |
2019 |
USA |
13 Metaboliten in 2 (oder 3) Urinproben |
419 Patientinnen
838 Kontrollen
|
keine Assoziation |
Reeves et al. |
MEP = Monoethylphthalat; MBzP = Monobenzylphthalat; MCPP = Mono(3-carboxypropyl)-phthalat; MEHP = Mono-(2-ethylhexyl)-phthalat | |||||
Eine nachfolgende Arbeit wurde etwas später publiziert[Meridas-Ortega 2016]. Die Ernährungsgewohnheiten der Mexikanerinnen in der zuvor beschriebenen Studie waren über einen Fragebogen ermittelt worden. Eine erneute Auswertung der gleichen Daten unter zusätzlicher Berücksichtigung der Zufuhr von Flavonoiden – abgeleitet aus den Angaben zum Verzehr von Obst und Gemüse – brachte folgendes Resultat: Die positive Assoziation von Monoethylphthalat mit einer Brustkrebserkrankung war nicht mehr statistisch signifikant, die negative Assoziation mit den anderen beiden Metaboliten MBzP und MCPP bestand fort. Die Autoren interpretieren ihre Ergebnisse so: „Der Metabolit MBzP scheint synergistisch mit der Zufuhr von Flavonoiden wie Anthocyanidine und Flavan-3-ole das Risiko für Brustkrebs zu reduzieren.“ Diese Studien haben keine fundierte Basis, keine eindeutige biologische Plausibilität. Sie könnten nur dann rational interpretiert werden, wenn experimentelle Daten zu einer möglichen synergistischen Wirkung von Phthalat-Estern und bestimmten Flavonoiden vorlägen. Da solche Fakten fehlen, kann man die Ergebnisse beider Studien nur mit erheblicher Skepsis zur Kenntnis nehmen. Es war zu erwarten, dass weitere Untersuchungen zu der Problematik folgen würden.
Weitere retrospektive Studien kommen aus den USA. An einer relativ kleinen Zahl von Frauen wurde zunächst in Alaska geprüft, ob es einen Zusammenhang zwischen Phthalat-Metaboliten im Urin und Brustkrebs gibt [Holmes et al. 2014]. Bei den erkrankten Frauen war die Konzentration des zuvor bei den Mexikanerinnen als kritisch ermittelten Metaboliten MEP nicht erhöht, sondern niedriger als bei den Kontrollen. In dieser Studie war ein anderer Metabolit auffällig: Die Autoren errechneten eine Assoziation zwischen erhöhten Konzentrationen an Mono-(2-ethylhexyl)-phthalat (MEHP) und dem Auftreten von Brustkrebs.
Bei einer großen Gruppe von Frauen über 20 Jahren, die im Rahmen des NHANES-Projektes (National Health and Nutrition Examination Survey) erfasst wurden, konnten Phthalat-Metaboliten im Urin gemessen werden. Die Analysenergebnisse von 97 Frauen mit Mammakarzinom wurden mit denen von 2731 Frauen, die nicht erkrankt waren, verglichen. Die Berechnung zeigte keine signifikante Assoziation zwischen erhöhten Phthalat-Konzentrationen und der Krebserkrankung [Morgan et al. 2017]. Ebenfalls aus den USA kommt eine Studie an 710 Frauen mit Mammakarzinom. Im Vergleich zu einer Kontrollgruppe gab es keinen Anhalt, dass eine erhöhte Phthalat-Konzentration im Zusammenhang mit der Erkrankung stehen könnte. Negative Assoziationen bestanden mit einigen Metaboliten, sie waren jedoch nicht signifikant [Parada et al. 2018]. Auch in einer Metaanalyse, in der mehrere Studien zusammen ausgewertet wurden, konnte weder eine positive noch negative Assoziation mit der Summe aller Phthalat-Metaboliten festgestellt werden. Eine positive Assoziation fand sich aber für einen Sekundärmetaboliten, das MECPP [Mono-(2-ethyl-5-carboxypentyl)-phthalat], ein Produkt des oxidativen Stoffwechsels [Fu et al. 2017].
Aktuelle Studie mit prospektivem Ansatz
Auch in der bisher größten und besten Studie über Phthalate und Brustkrebs bei Frauen nach der Menopause konnte keine Assoziation zwischen Phthalat-Metaboliten im Urin und einem erhöhten Krankheitsrisiko ermittelt werden. Die Studie wurde als erste prospektiv durchgeführt, die Exposition wurde bereits vor der Diagnose ermittelt. Die Frauen waren Teilnehmerinnen der nationalen Gesundheitsstudie Women Health Initiative (WHI), die mehr als 160.000 Frauen einschloss. Dreizehn Phthalat-Metaboliten wurden im Morgenurin von 419 Frauen gemessen, bei denen frühestens drei Jahre nach Aufnahme in die Studie Brustkrebs festgestellt worden war. Die Kontrollgruppe umfasste 838 Frauen. Da auch durch medizinische Maßnahmen eine Exposition mit Phthalaten erfolgt, ist es vorteilhaft, dass hier die Analytik vor der Diagnose erfolgte. Im Gegensatz zu anderen Studien wurden zwei oder drei Urinproben im Abstand von mindestens einem Jahr analysiert. Die Frauen mit Mammakarzinom waren häufiger Raucherinnen oder stark übergewichtig (BMI von ≥ 30 kg/m2: 36,7% vs. 27,4% der Teilnehmerinnen). Eine Assoziation zwischen der Krebserkrankung und den Phthalat-Metaboliten konnte nicht gefunden werden. Metaboliten, die zuvor aufgefallen waren, weil sie entweder positiv oder negativ mit dem Risiko für die Erkrankung assoziiert waren, traten fast gleich häufig in beiden Gruppen auf. Zum Beispiel wurden die geometrischen Mittelwerte für die Konzentrationen von MEP mit 131 µg/g und 140 µg/g berechnet und für MBzP mit 17 µg/g und 19 µg/g (jeweils Fälle vs. Kontrollen). Die Bedeutung dieser Ergebnisse wird dadurch erhöht, dass die Probengewinnung bereits in den 1990er-Jahren erfolgte. Da vor mehr als zwei Jahrzehnten auch in den USA die Exposition mit Phthalaten noch deutlich höher war, bekommt diese Entwarnung besonderes Gewicht [Reeves et al. 2019].
Fazit
Diethylhexylphthalat (DEHP) und einige andere Phthalate stehen seit mehr als drei Jahrzehnten in der Kritik, weil sie im Tierexperiment die prä- und postnatale Entwicklung der männlichen Reproduktionsorgane stören. Drei Aspekte sind heute positiv zu vermerken:
- Die Exposition der Bevölkerung mit diesen Stoffen ist in Deutschland seit Jahren deutlich zurückgegangen,
- es werden heute vermehrt Phthalate wie DiNP (Diisononylphthalat) oder Ersatzstoffe wie DINCH (Diisononyl-1,2-cyclohexan-dicarbonsäure) eingesetzt, die nicht reproduktionstoxisch sind und
- ältere epidemiologische Studien an kleinen Patientengruppen zeigten sowohl positive als auch negative Assoziationen zwischen hohen Phthalat-Konzentrationen und Mammakarzinom, wahrscheinlich handelte es sich um Zufallsbefunde. Aktuelle epidemiologische Studien geben keinen Anhalt für ein erhöhtes Brustkrebsrisiko durch eine erhöhte Phthalat-Exposition. |
Literatur
ECHA Committe for Risk Asssessment (RAC) 2018; Opinion proposing harmonised classification and labelling at EU level of 1,2-Benzenedicarboxylic acid, di-C8-10-branched alkylesters, C9-rich; [1] di-isononyl phthalate; [2] [DINP] https://echa.europa.eu/documents/10162/56980740-fcb6-6755-d7bb-bfe797c36ee7
Fu Z, Zhao F, Chen K, Xu J, Li P, Xia D, Wu Y. Association between urinary phthalate metabolites and risk of breast cancer and uterine leiomyoma. Reprod Toxicol 2017;74:134-142
Gray LE Jr, Ostby J, Furr J, Price M, Veeramachaneni DN, Parks L. Perinatal exposure to the phthalates DEHP, BBP, and DINP, but not DEP, DMP, or DOTP, alters sexual differentiation of the male rat. Toxicol Sci 2000;58(2):350-365
Holmes AK, Koller KR, Kieszak SM, Sjodin A, Calafat AM, Sacco FD, Varner DW,Lanier AP, Rubin CH. Case-control study of breast cancer and exposure to synthetic environmental chemicals among Alaska Native women. Int J Circumpolar Health 2014;73:25760
Koch HM, Rüther M, Schütze A, Conrad A, Pälmke C, Apel P, Brüning T, Kolossa-Gehring M. Phthalate metabolites in 24-h urine samples of the German Environmental Specimen Bank (ESB) from 1988 to 2015 and a comparison with US NHANES data from 1999 to 2012. Int J Hyg Environ Health 2017;220(2 PtA):130-141
López-Carrillo L, Hernández-Ramírez RU, Calafat AM, Torres-Sánchez L, Galván-Portillo M, Needham LL, Ruiz-Ramos R, Cebrián ME. Exposure to phthalates and breast cancer risk in northern Mexico. Environ Health Perspect 2010;118(4):539-544
Mérida-Ortega Á, Hernández-Alcaraz C, Hernández-Ramírez RU, García-Martínez A, Trejo-Valdivia B, Salinas-Rodríguez A, Svensson K, Cebrián ME, Franco-Marina F, López-Carrillo L. Phthalate exposure, flavonoid consumption and breast cancer risk among Mexican women. Environ Int 2016;96:167-172
Morgan M, Deoraj A, Felty Q, Roy D. Environmental estrogen-like endocrine disrupting chemicals and breast cancer. Mol Cell Endocrinol 2017;457:89-102
Parada H Jr, Gammon MD, Chen J, Calafat AM, Neugut AI, Santella RM, Wolff MS, Teitelbaum SL. Urinary Phthalate Metabolite Concentrations and Breast Cancer Incidence and Survival following Breast Cancer: The Long Island Breast Cancer Study Project. Environ Health Perspect 2018;126(4):047013
Reeves KW, Santana MD, Manson JE, Hankinson SE, Zoeller RT, Bigelow C, Sturgeon SR, Spiegelman D, Tinker L, Luo J, Chen B, Meliker J, Bonner MR, Cote ML, Cheng TD, Calafat AM. Urinary Phthalate Biomarker Concentrations and Postmenopausal Breast Cancer Risk. J Natl Cancer Inst 10. Januar 2019, doi: 10.1093/jnci/djz002 [Epub ahead of print]
Schütze A, Kolossa-Gehring M, Apel P, Brüning T, Koch HM. Entering markets and bodies: increasing levels of the novel plasticizer Hexamoll® DINCH® in 24 h urine samples from the German Environmental Specimen Bank. Int J Hyg Environ Health 2014;217(2-3):421-426
Takeuchi S, Iida M, Kobayashi S, Jin K, Matsuda T, Kojima H. Differentialeffects of phthalate esters on transcriptional activities via human estrogen receptors alpha and beta, and androgen receptor. Toxicology 2005;210(2-3):223-233
Zacharewski TR, Meek MD, Clemons JH, Wu ZF, Fielden MR, Matthews JB. Examination of the in vitro and in vivo estrogenic activities of eight commercial phthalate esters. Toxicol Sci 1998;46(2):282-293
Zuccarello P, Oliveri Conti G, Cavallaro F, Copat C, Cristaldi A, Fiore M, Ferrante M. Implication of dietary phthalates in breast cancer. A systematic review. Food Chem Toxicol 2018;118:667-674























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.