
- DAZ.online
- DAZ / AZ
- DAZ 10/2020
- Kurz gemeldet: Höhepunkt...
Arzneimittel und Therapie
Kurz gemeldet: Höhepunkt der Grippewelle überschritten, Zulassungsempfehlungen für zwei Antibiotika, Keine Indikationserweiterung für Galcanezumab
Höhepunkt der Grippewelle überschritten
Während sich das neuartige Coronavirus SARS-CoV-2 weltweit weiter ausbreitet, entspannt sich zumindest die Lage an einer anderen Virus-Front: Die Influenza-Aktivität ist leicht gesunken, das Robert Koch-Institut (RKI) geht davon aus, dass der Höhepunkt der Grippewelle 2019/20 überschritten ist. Bislang sind knapp 100.000 Menschen in Deutschland an Grippe erkrankt, 2,1 Millionen waren wegen Verdachts auf Influenza beim Arzt. 161 Menschen mit positivem Influenza-Nachweis sind bislang verstorben, 85% von ihnen waren 60 Jahre oder älter. Noch ist die Grippewelle allerdings nicht vorbei, eine Impfung kann immer noch nachgeholt werden. Erste Schätzungen zur Wirksamkeit des Grippe-Impfstoffes liegen aus den USA, Kanada, Finnland und Schweden vor. Die Impfeffektivität gegen alle Influenza-Typen wird in den USA mit 45%, in Kanada mit 58% angegeben. In Finnland und Schweden liegen die ersten Schätzungen bei 39% bzw. 41% (Personen ab 65 Jahre). Für Deutschland gibt es noch keine epidemiologischen Daten zur Wirksamkeit der Vakzine. Das RKI beschreibt hierzulande die „Hinweise zur Wirksamkeit aus dem Labor“ mit „vielversprechend“.
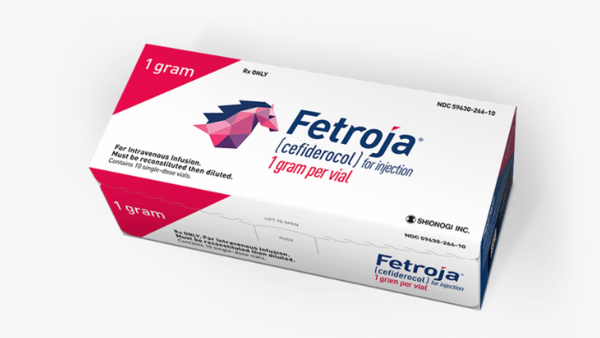
Zulassungsempfehlungen für zwei Antibiotika
Der Ausschuss für Humanarzneimittel (CHMP) der europäischen Arzneimittelagentur (EMA) hat in seiner Februar-Sitzung zwei Antibiotika positiv bewertet. Bei Cefiderocol (Fetcroja®, Shionogi B. V.) handelt es sich um den ersten Vertreter der neuen Antibiotikaklasse der Siderophor-Cephalosporine. Cefiderocol ist gegen aerobe Gram-negative Erreger wirksam und könnte eingesetzt werden, wenn andere Therapiemöglichkeiten limitiert sind. Es soll als Pulver zur Herstellung einer Infusionslösung auf den Markt kommen. In den USA ist Cefiderocol bereits seit November 2019 zugelassen.Die zweite Zulassungsempfehlung galt Tigecyclin. Das Antibiotikum aus der Klasse der Glycylcycline ist in Europa bereits seit 2006 zur Behandlung von komplizierten Haut- und Weichteilinfektionen sowie von komplizierten intraabdominellen Infektionen, wenn andere alternative Antibiotika nicht geeignet sind, zugelassen. In Deutschland ist Tigecyclin als Tygacil® im Handel. Nun hat der CHMP die Zulassung des Generikums Tigecycline Accord® empfohlen.
Keine Indikationserweiterung für Galcanezumab
Galcanezumab (Emgality®, Eli Lilly) kam im April 2019 zur Migräneprophylaxe auf den Markt. In den USA ist der gegen das Calcitonin Gene-Related Peptide (CGRP) gerichtete Antikörper seit Anfang Juni 2019 auch zur Prävention bei episodischen Clusterkopfschmerz-Attacken indiziert. Im Rahmen einer Phase-III-Studie war der humanisierte monoklonale Antikörper im Vergleich zu Placebo an insgesamt 106 Clusterkopfschmerz-Patienten untersucht worden. Die Probanden erhielten über zwei Monate einmal monatlich subkutan 300 mg Galcanezumab oder Placebo. Unter Galcanezumab wurde die Anzahl wöchentlicher Cluster-Attacken im Vergleich zum Ausgangswert um 8,69 Anfälle pro Woche reduziert, unter Placebo waren es 5,22 Anfälle pro Woche weniger als zuvor. Die europäische Zulassungsbehörde zeigte sich von diesen Daten indes nicht überzeugt und lehnte den Antrag auf eine Indikationserweiterung ab. Nach Einschätzung des CHMP ist die präventive Wirksamkeit bei episodischem Clusterkopfschmerz nicht eindeutig belegt.



























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.