
- DAZ.online
- DAZ / AZ
- DAZ 32/2020
- Dropizol-Vertreiber kä...
DAZ aktuell
Dropizol-Vertreiber kämpft gegen Opiumtinktur-Rezeptur
Was steckt hinter dem Brief der Firma Innocur an die Apotheken?
Schon mehrfach berichtete die DAZ über Streitigkeiten zur rechtlichen Stellung von Opiumtinktur für Rezepturzwecke. Dabei ging es zunächst um Verfahren zwischen dem Hersteller des Opiumtinktur-Fertigarzneimittels Dropizol®, der dänischen Firma Pharmanovia, und dem Hersteller des Ausgangsstoffs für die Rezeptur, der Firma Maros. Pharmanovia hatte versucht, den Vertrieb des Ausgangsstoffs verbieten zu lassen, und dazu argumentiert, dieser sei ein nicht zugelassenes Fertigarzneimittel. Doch das Landgericht Hamburg hatte am 28. Mai 2019 erklärt, das Produkt sei nicht zur Abgabe an Verbraucher bestimmt. Derjenige, der das Arzneimittel in Verkehr bringe, habe es in der Hand, ob es zur Abgabe an den Verbraucher bestimmt sei und damit als Fertigarzneimittel in Verkehr gebracht werde (DAZ 2019, Nr. 38, S. 22). Das Hanseatische Oberlandesgericht hatte dies in einem Beschluss vom 21. April 2020 bestätigt und ergänzt, allein der Umstand, dass das Mittel vom Apotheker in seiner Zusammensetzung nicht verändert werde, rechtfertige nicht die Annahme, es handele sich um ein zur Abgabe an den Verbraucher bestimmtes Arzneimittel. Maßgeblich sei die Zweckbestimmung. Außerdem hatte das Gericht erklärt, es sei nichts Ungewöhnliches daran, wenn eine Bulkware am Ende der Herstellung portioniert werde (DAZ 2020, Nr. 21, S. 16). Diese Entscheidung der zweiten Instanz ist inzwischen rechtskräftig.
Deutliche Warnungen an Apotheken
Von diesem Rechtsstreit zwischen den Herstellern sind die Verfahren gegen einzelne Apotheken zu unterscheiden. Das Landgericht Hamburg hatte einstweilige Verfügungen gegen Apotheken erlassen, mit denen diesen Apotheken die Abgabe solcher Opiumtinktur-Rezepturen verboten wurde. Gemäß einer früheren Mitteilung der Firma Innocur als Vertreiberin des Fertigarzneimittels an die DAZ wurden diese Verfügungen von Pharmanovia erwirkt. Doch in der vorigen Woche hat sich Innocur unter Bezugnahme auf dieses Verfahren an einige Apotheken gewandt. Darin heißt es: „Apotheke bleibt die Abgabe der von der Maros Arznei GmbH bezogenen Tinctura Opii normata Ph. Eur. Opiumtinktur verboten.“ Weiter heißt es, das Hamburger Gericht bleibe bei seiner Auffassung. Die Abgabe der Rezeptur sei einer Apotheke untersagt, wenn sie die Opiumtinktur als Rohstoff beziehe und ohne wesentliche Veränderungen an Endkunden abgebe. Die Apotheke hätte Widerspruch gegen diese einstweilige Verfügung eingelegt, diesen aber zurückgenommen, nachdem das Landgericht Hamburg seine Rechtsauffassung in einer schriftlichen Verfügung niedergelegt habe. Damit sei der Beschluss (Aktenzeichen 327 O 1/20) rechtskräftig. Zur Begründung habe das Landgericht erklärt: „Voraussetzung für die zulassungsfreie Herstellung und den entsprechenden Vertrieb aufgrund einer Rezeptur ist, dass das Mittel tatsächlich aufgrund einer individuellen Rezeptur hergestellt wird. Hieran fehlt es, wenn ein Mittel – wie hier – in keiner Weise mehr von dem dem Apotheker angelieferten Zwischenprodukt bzw. der Bulkware abweicht und sich dessen Tätigkeit daher auf das bloße Umfüllen des gebrauchsfertigen Wirkstoffs in ein zur Abgabe an den Verbraucher bestimmtes Behältnis beschränkt.“
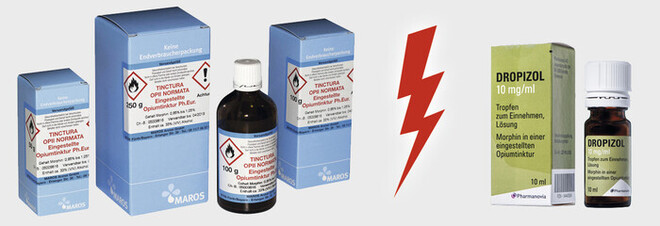
Opiumtinktur als Ausgangsstoff für die Rezeptur von der Firma Maros Arznei GmbH (links) und als Fertigarzneimittel Dropizol der Firma Innocur Pharma GmbH (rechts).
Innocur folgert, Hersteller dürften Opiumtinktur als Rohstoff an Apotheken verkaufen, aber es sei den Apotheken untersagt, diese „ohne Veränderung an der Wirksubstanz“ an den Endverbraucher abzugeben, es sei denn, sie hätten eine Zulassung. Nach der Rechtsprechung des Landgerichts Hamburg sei die Abgabe der Rezeptur unzulässig. Das sich daraus ergebende zivil- und strafrechtliche Risiko liege allein beim Apotheker. Zusätzlich wirft Innocur die Frage auf, ob Opiumtinktur-Rezepturarzneimittel erstattungsfähig seien. Denn nach der Rechtsprechung des Landgerichts Hamburg seien dies zulassungspflichtige, aber nicht zugelassene Fertigarzneimittel. Diese seien aber nicht erstattungsfähig und die Hilfstaxe gelte nur für „wahre“ Rezepturarzneimittel. Damit sei die Abrechnung gemäß Hilfstaxe nicht nur sozialrechtlich fraglich, sondern „könnte unter Umständen auch als Abrechnungsbetrug angesehen werden“, wenn die Krankenkasse dabei getäuscht würde, argumentiert Innocur. Insgesamt erscheinen diese Folgerungen als deutliche Warnung an die Apotheken. Allerdings weist Innocur darauf hin, dass sich die Rechtsprechung des Landgerichts Hamburg nur auf die genannte Opiumtinktur beziehe. Die grundsätzliche Zulässigkeit „wahrer“ Rezepturarzneimittel werde dadurch nicht infrage gestellt – soweit das Schreiben von Innocur.
Schriftlicher Hinweis vom LG Hamburg
Auf Anfrage der DAZ verwies das Landgericht Hamburg auf seine einstweilige Verfügung vom 8. Januar 2020 gegen eine Apotheke. Es gebe dazu jedoch keine „Entscheidung“ vom 28. Mai 2020, sondern die zuständige Kammer des Gerichts habe mit Verfügung vom 28. Mai 2020 einen „schriftlichen Hinweis zur Einschätzung der Rechtslage“ erteilt. Dieser entspricht dem von Innocur zitierten Text und enthält zusätzlich den Hinweis: „In der Sache dürfte ein Verstoß gegen § 21 AMG überwiegend wahrscheinlich sein.“ Soweit vom Landgericht Hamburg – zum Hintergrund ist anzumerken, dass sich § 21 AMG auf Fertigarzneimittel bezieht. Dies alles betrifft das Verfahren gegen eine Apotheke, das offenbar ohne mündliche Gerichtsverhandlung stattgefunden hat. Doch nach übereinstimmenden Informationen der DAZ und des Hamburger Apothekervereins dauert das Verfahren gegen eine weitere Apotheke an. Dort steht demnächst ein Termin vor dem Landgericht Hamburg an und in diesem Rechtsstreit ist bisher nichts rechtskräftig entschieden.
ABDA: Rechtskraft nur für Beteiligte
Auch die ABDA hat sich bereits mit dem Schreiben von Innocur an die Apotheken beschäftigt. In einer Information an die Geschäftsführer der Apothekerverbände heißt es dazu: Da eine Begründung für die Entscheidung nicht vorliege, könne nicht abschließend beurteilt werden, ob die behauptete Argumentation für die Entscheidung des Gerichts maßgeblich gewesen sei. Weiter erklärte die ABDA: „Die Entscheidung hat indes Rechtskraft ausschließlich im Verhältnis der beteiligten Parteien. Damit lässt sich insbesondere kein generelles Abgabeverbot begründen, da die konkreten Gründe für die Rücknahme des Widerspruchs nicht bekannt sind und es auch keine gerichtliche Entscheidung gibt, die hierfür weitergehende Anhaltspunkte bieten kann.“ Außerdem verweist die ABDA auf den Rechtsstreit zwischen den Herstellern (siehe oben). In einem weiteren Schreiben an die Geschäftsführer der Apothekerverbände erklärte die ABDA, die Argumentation des Hanseatischen Oberlandesgerichtes im Beschluss vom 21. April 2020 stütze im Ergebnis die Auffassung, dass die im Schreiben von Innocur beschriebene Entwicklung im Verfahren gegen eine Apotheke „ihre Begründung in den Besonderheiten des Einzelfalls hat“. Dieser Auffassung hat sich auch der Hamburger Apothekerverein in einem Rundschreiben vom 4. August angeschlossen. Darin hat der Verein erklärt, eine andere Apotheke werde den Prozess weiterführen, so dass in der Hauptsache noch nichts entschieden sei und auch keine neue Rechtslage bestehe.
Reaktionen von Krankenkassen sind bisher nicht bekannt. Doch bleibt zu bedenken, dass das Opiumtinktur-Fertigarzneimittel erheblich teurer als eine vergleichbare Menge des Rezepturarzneimittels ist. Außerdem wird die Hilfstaxe zwischen Krankenkassen und Apothekern auf der Grundlage der Preise der marktgängigen Ausgangsstoffe vereinbart. Das Verfahren beruht letztlich darauf, dass die Krankenkassen wissen, welche Ausgangsstoffe den Apotheken zu welchem Preis zur Verfügung stehen.
Auf die Frage nach der Position der Firma Maros als Herstellerin des Ausgangsstoffs hat die DAZ eine sehr persönliche Stellungnahme des Maros-Geschäftsführers Dr. Norbert Brand erhalten (s. Seite 14). |
Lesen Sie dazu auch das Editorial "Der Wert der Rezeptur" von Dr. Thomas Müller-Bohn






















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.