
- DAZ.online
- DAZ / AZ
- DAZ 32/2020
- Neue Ebola-Schutzimpfung ...
Arzneimittel und Therapie
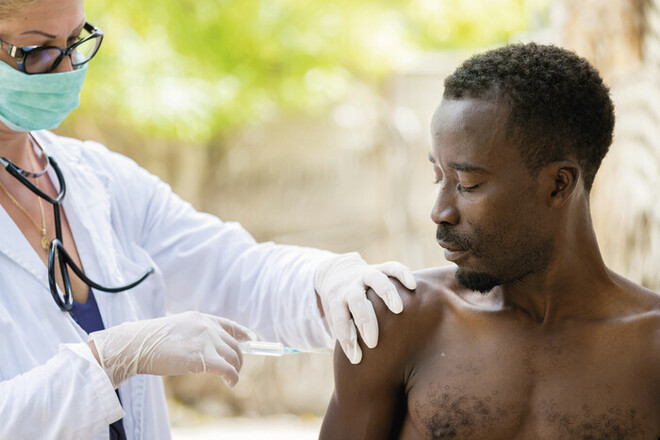
Neue Ebola-Schutzimpfung zugelassen
Zwei Einzeldosen sollen das Virus eindämmen
Mit einer Sterblichkeitsrate von 30 bis 90% gehört eine Infektion mit dem Ebolavirus zu einer der gefährlichsten Viruserkrankungen weltweit. Die Infektion, die zu den viralen hämorrhagischen Fiebererkrankungen zählt, erfolgt durch den Kontakt mit Körperflüssigkeiten infizierter Personen, beispielsweise Blut, Speichel, Schweiß, Urin oder Exkrementen. Da eine bestehende Infektion aktuell kaum ausreichend behandelt werden kann, wird umso mehr versucht, präventiv der Krankheit durch Entwicklung eines Impfstoffs entgegenzuwirken. Am 1. Juli 2020 erhielt in Europa ein weiterer Ebola-Impfstoff, der bei Erwachsenen und Kindern ab dem ersten Lebensjahr angewendet werden kann, die behördliche Genehmigung in einem beschleunigten Verfahren. Die Zulassung stützt sich auf Daten aus elf klinischen Studien der Phasen I bis III, in denen die Fähigkeit des Impfstoffs, eine Immunantwort auszulösen, sowie die Sicherheit an mehr als 6500 Erwachsenen und Kindern ab einem Jahr in den USA, Europa und Afrika untersucht worden war. Außerdem wurden die Ergebnisse von Immuno-Bridging-Analysen berücksichtigt, die die Ergebnisse klinischer und präklinischer Wirksamkeitsstudien vergleichen.
Im Rahmen klinischer Studien und Impfinitiativen wurden bereits etwa 60.000 Personen mit dem neuen Ebola-Impfregime der Firma Janssen geimpft.
Eigenschaften des Impfstoffs
Das Impfregime besteht aus je einer Dosis Zabdeno™ (Ad26.ZEBOV) und Mvabea™ (MVA-BN-Filo). Zunächst wird Zabdeno™ verabreicht. Nach acht Wochen erfolgt die Injektion von Mvabea™, das die ausgelöste Immunantwort verstärken soll.
Bei der Herstellung wurden ein Adenovirus-Serotyp-26 (Ad26) und eine modifizierte Virus-Ankara-Vakzine (MVA) genetisch so verändert, dass sie sich in menschlichen Zellen nicht vermehren können. Gleichzeitig wird die Produktion von Schlüsselproteinen des Ebola-Virus angeregt, um eine Immunantwort auszulösen. Die häufigsten Nebenwirkungen, die man in klinischen Studien beobachtet hatte, waren Reaktionen an der Injektionsstelle wie Schmerzen und Schwellungen, außerdem Müdigkeit, Kopfschmerzen, Myalgie, Arthralgie und Schüttelfrost.
Die Vektortechnologie AdVac®, die für die erste Impfstoffdosis Verwendung findet, wird nach Herstellerangaben unter anderem auch für die Entwicklung von Impfstoffkandidaten zum Schutz gegen SARS-CoV-2 und das Zikavirus eingesetzt.
Der erste Impfstoff, der im November 2019 zur Prophylaxe der Zaire-Ebola-Virus-Krankheit zugelassen worden war (Ervebo®, Merck Sharp & Dohme) besitzt einen anderen Aufbau. Er besteht aus einem lebenden, abgeschwächten rekombinanten Vesikulären Stomatitis-Virus (rVSV). Sein Hüllglykoprotein wurde durch das Oberflächenglykoprotein des Zaire-Ebolavirus (ZEBOV) ersetzt. Er ist erst ab einem Alter von 18 Jahren zugelassen.
Einsatz in Ebola-Risikogebieten wird vorangetrieben
Nach der erfolgreichen Zulassung besteht das Ziel der zuständigen Institutionen jetzt darin, die Registrierung der Ebola-Schutzimpfung in den afrikanischen Ländern voranzutreiben, in denen ein besonders hohes Risiko für einen Ebola-Ausbruch besteht. Darüber hinaus sollen durch die Impfung Menschen mit einem hohen Expositionsrisiko wie medizinisches Fachpersonal, Mitarbeiter in Hochsicherheitslaboratorien, Militärmitarbeiter anderer Länder, Flughafenangestellte sowie Besucher von Hochrisikoländern geschützt werden. Das genaue Schutzlevel, das mit der Impfregime erreicht werden kann, ist noch nicht bekannt. Wer plant, sich in ein Ebola-Risikogebiet zu begeben und die letzte Schutzimpfung bereits vor mehr als vier Monaten bekommen hat, sollte deshalb vorsichtshalber eine Boosterimpfung mit Zabdeno™ erhalten. |
Literatur
Ebolafieber. Informationen des Robert Koch-Institus. www.rki.de/SharedDocs/FAQ/Ebola/Ebola.html, Abruf am 28. Juli 2020
Ervebo. Public Health - Union Register of medicinal products, https://ec.europa.eu/health/documents/community-register/html/h1392.htm, Abruf am 2. Juli 2020
New vaccine for prevention of Ebola virus disease recommended for approval in the European Union. Pressemitteilung der EMA vom 29. Mai 2020, https://www.ema.europa.eu/en/documents/press-release/new-vaccine-prevention-ebola-virus-disease-recommended-approval-european-union_en.pdf, Abruf am 2. Juli 2020
Zulassung von Janssens Ebola-Impfstoff in Europa. Presseinformation der Janssen Pharmaceutical Companies of Johnson & Johnson vom 1. Juli 2020





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.