
- DAZ.online
- DAZ / AZ
- DAZ 33/2020
- Erstes Arzneimittel gegen...
Arzneimittel und Therapie
Erstes Arzneimittel gegen Hepatitis D
Bulevirtid verhindert Viruseintritt in Leberzellen
Im Verlauf einer akuten oder chronischen Hepatitis B kann es zu einer Simultaninfektion mit Hepatitis-D-Viren kommen. Eine alleinige Hepatitis-D-Infektion kann nicht erfolgen, da das Hepatitis-D-Virus nur dann infektiöse Viruspartikel bilden kann, wenn ihm die HBsAg(Oberflächenprotein des Hepatitis-B-Virus)-haltige Hülle des Hepatitis-B-Virus zur Verfügung steht. Hepatitis D tritt somit stets zusammen mit Hepatitis B auf. In der Mehrzahl der Fälle kommt es bei einer Co-Infektion zu chronischen Verläufen mit der Gefahr einer raschen Entwicklung einer Leberzirrhose und einem erhöhten Risiko für ein hepatozelluläres Karzinom. Diese schwerste Form einer Hepatitis tritt vornehmlich in Afrika, Südamerika, in der Mongolei, in Russland und in Osteuropa auf; man schätzt, dass weltweit 25 Millionen Menschen betroffen sind. Annahmen des Robert Koch-Instituts zufolge, leben in Deutschland rund 240.000 Patienten mit einer chronischen Hepatitis-B-Infektion, von denen etwa 2,5% – das sind 6000 Betroffene – zusätzlich mit dem Hepatitis-D-Virus infiziert sind. Für diese spezielle Art der Hepatitis gab es bislang wenige Therapiemöglichkeiten, neben einer Transplantation und der Behandlung der Hepatitis B stand lediglich die Interferon-Gabe zur Verfügung. Mit der Entwicklung sogenannter Entry-Inhibitoren steht nun erstmals mit Bulevirtid ein vielversprechender Wirkstoff zur Verfügung.
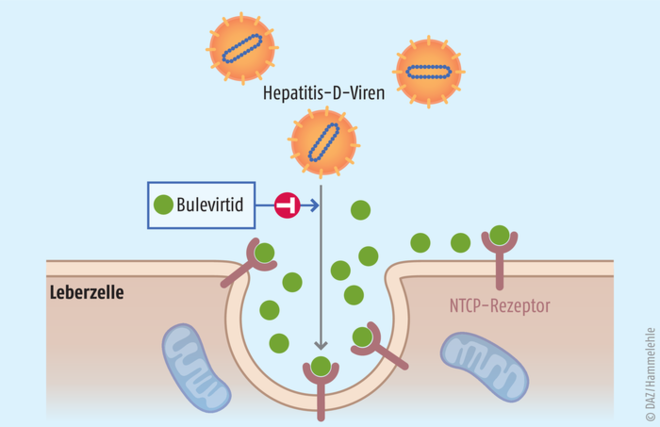
Bulevirtid blockiert auf der Oberfläche der Hepatozyten den Gallensalztransporter NTCP, den die Hepatitis-D-Viren als Eintrittspforte in die Leberzellen benötigen.
NTCP-Rezeptor als Target
Bulevirtid ist ein synthetisch hergestelltes Lioprotein aus 47 Aminosäuren, das sich von der preS1-Domäne des Oberflächenproteins des Hepatitis-B-Virus ableitet. Der Wirkstoff ist der erste Entry-Inhibitor, der den Eintritt von Hepatitis-B- und D-Viren in die Leberzelle verhindert. Er blockiert die Kopplung der Viren an den NTCP-Rezeptor (NTCP= Natrium-Taurocholat-Kotransport-Polypeptid; ein Gallensalzrezeptor) und verhindert so die Virusaufnahme in die Leberzellen. Dadurch wird die Infektion weiterer Hepatozyten verhindert. Dabei reicht es, wenn nur einige der Rezeptoren blockiert werden, sodass der Gallensalztransport nicht beeinträchtigt wird. Bereits infizierte Leberzellen sterben ab oder werden vom Immunsystem eliminiert. Hepatitis-D-Viren müssen, um langfristig überleben zu können, kontinuierlich gesunde Hepatozyten befallen. Dieser Vorgang wird durch den Entry-Inhibitor Bulevirtid verhindert.
Die antivirale Wirksamkeit von Bulevirtid wurde in mehreren Studien bestätigt, in denen der Wirkstoff sowohl in der Monotherapie als auch in der Kombinationstherapie eingesetzt wurde. In einer Phase-IIb-Studie mit 60 Patienten, die an Hepatitis D und Hepatitis B erkrankt waren, war eine Kombinationstherapie aus Bulevirtid und PEG-Interferon-α-2a gegen das Hepatitis-D-Virus wirksam. Bei einigen Patienten wurde auch das Hepatitis-B-Virus eliminiert. In einer aktuellen Phase-III-Studie werden Wirksamkeit und Sicherheit von Bulevirtid während einer 48-wöchigen Therapie untersucht (NCT03852719).
Bulevirtid (Hepcludex®; MYR GmbH; alter Name Myrcludex B) wurde am 28. Mai 2020 von der EMA zur Zulassung empfohlen und nun von der Europäischen Kommission zur Verschreibung in Europa zugelassen. Der Wirkstoff ist indiziert zur Therapie der chronischen im Plasma oder Serum nachgewiesenen (HDV-RNA-positiv) Hepatitis D bei Erwachsenen mit kompensierter Lebererkrankung. Bulevirtid wird als Injektion verabreicht. |
Literatur
Pressemitteilung des Universitätsklinikums Heidelberg und des Deutschen Zentrums für Infektionsforschung vom 4. August 2020
Hepcludex. Informationen der EMA, www.ema.europa.eu/en/medicines/human/summaries-opinion/hepcludex, Abruf am 7. August 2020
Wedemeyer H et al. Final results of a multicenter, open-label phase 2 clinical trial (MYR203) to assess safety and efficacy of myrcludex B in with PEG-interferon Alpha 2a in patients with chronic HBV/HDV co-infection. J Hepatol 2019;70:e81. doi: 10.1016/S0618-8278(19)30141-0P.
Ben L Da et al. Hepatitis D infection: from initial discovery to current investigational therapies, Gastroenterology Report, Volume 7, Issue 4, August 2019, Pages 231–245, https://doi.org/10.1093/gastro/goz023
Bogomolov P et al. Treatment of chronic hepatitis D with the entry inhibitor myrcludex B: First results of a phase Ib/IIa study. J Hepatol. 2016;65(3):490-498. doi:10.1016/j.jhep.2016.04.016





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.